
- •Алициклические углеводороды или циклоалканы
- •1. Определения, классификация.
- •2. Номенклатура.
- •3. Изомерия.
- •4. Напряжение циклов, конформации.
- •5. Способы получения.
- •5.1. Общие
- •5.2. Специальные
- •6. Физические свойства
- •7. Химические свойства
- •7.1. Гидрирование (восстановление)
- •7.2. Гидрогалогенирование и действие минеральных кислот
- •7.3. Галогенирование.
- •7.4. Окисление.
- •8. Непредельные алициклические соединения.
7.1. Гидрирование (восстановление)
Эта реакция, протекает неодинаково для различных циклоалканов. Низшие циклоалканы, и, прежде всего, циклопропан, реагируют с раскрытием цикла. При этом циклопропан проявляет наиболее высокую реакционную способность. Например, в реакции над никелевым катализатором молекула циклопропана раскрывается при 800С, а циклобутана - при 2000С. При применении платинового катализатора циклопропан раскрывается уже при комнатной температуре, циклобутан - при 500С:

Схема 22.Схема реакции гидрирования циклопропана и циклобутана до пропана и н-бутана.
Пячтичленный цикл раскрывается только при высоких температурах.
Соединения с шестичленным циклом при нагревании с катализаторами гидрирования дегидрируются и превращаются в ароматические соединения:

Схема 23.Схема реакции циклогексана над платиновым катализатором.
7.2. Гидрогалогенирование и действие минеральных кислот
Циклопропан и его гомологи реагируют с галогенводородами с раскрытием цикла в соответствии с правилом Марковникова.

Схема 23.Схема реакции этилциклогексана с бромистым водородом.
Циклопарафины с большим числом углеродных атомов, в том числе и циклобутан, с галогеноводородами не реагируют.
Под действием сильных минеральных кислот циклопропан также разрывается с образованием спирта:
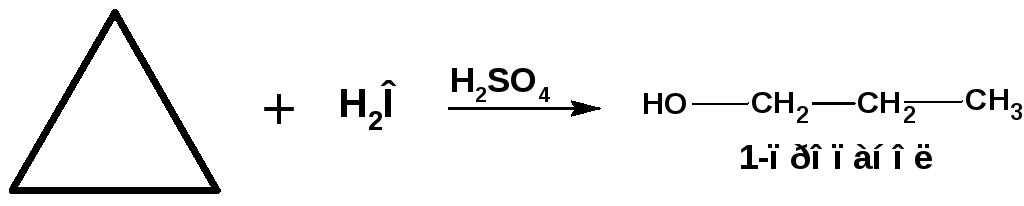
Схема 24.Схема действия минеральной кислоты на циклопропан.
7.3. Галогенирование.
Реакция циклопарафинов с галогенами идет в различных направлениях в зависимости от величины цикла. Циклопропан и его гомологи реагируют с галогенами с раскрытием цикла. Циклопентан и циклогексан вступают в обычное замещение. Циклобутан реагирует в обоих направлениях.

Схема 25.Схема действия галогенов на циклоалканы.
7.4. Окисление.
Все циклы окисляются с разрывом цикла и образованием дикарбоновых кислот с тем же числом углеродных атомов, что и в исходном циклоалкане. Этим они отличаются от изомерных олефинов, которые окисляются с образованием кислот и карбонильных соединений с меньшим числом углеродных атомов.

Схема 26.Схема реакций окисления циклоалканов.
8. Непредельные алициклические соединения.
Двойную связь можно ввести в любой цикл, начиная с трехчленного. Две двойные связи можно ввести только в пятичленный цикл:

Схема 27.Примеры непредельных алициклов.
Циклопропадиен не существует. Циклобутадиен весьма неустойчивое соединение. Его особенным свойством является антиароматичность. Циклопентадиен – устойчивое соединение. В шестичленный цикл можно ввести две двойные связи в сопряженном и несопряженном положениях и три двойные связи в сопряженном положении.
Тройную связь можно ввести в любой цикл - начиная с пятичленного. Но устойчивы только соединения, начиная с циклооктина.
Циклические углеводороды с кратными связями по химическим свойствам принципиально ничем не отличаются от соответствующих ациклических углеводородов. Исключение составляет склонность к реакциям изомеризации в момент реакции. Кратные связи в боковой цепи более реакционноспособны, чем находящиеся в цикле:

Схема 28.Пример реакции непредельных алициклов.
Из непредельных циклических углеводородов особый интерес представляет циклопентадиен, содержащийся в сыром бензоле, откуда его извлекают превращением в димер:

Схема 29.Синтез димера циклопентадиена.
При нагревании димер вновь переходит в циклопентадиен.
Циклопентадиен проявляет высокую химическую активность. Он легко присоединяет галогены и галогеноводороды, вступает в реакцию диенового синтеза:

Схема 30.Реакции с участием циклопентадиена.
Атомы водорода метиленовой группы, находящиеся между двумя двойными связями, обладают высокой подвижностью. Поэтому циклопентадиен обладает свойствами С-Н – кислоты и легко конденсируется в среде спиртовой щелочи с алифатическими альдегидами и кетонами, образуя так называемые фульвены – окрашенные соединения:

Схема 31.Синтез фульвена.
Циклопентадиен в форме аниона способен образовывать так называемые сэндвичевые соединения. Эти вещества глубоко окрашены, очень устойчивы, перегоняются без разложения и обладают ароматическим характером. Рентгеноструктурный анализ показал, что в молекулах сэндвичевых соединений два циклопентадиенильных фрагмента расположены друг над другом, как два куска хлеба в сэндвиче (отсюда происхождение названия), а между ними располагается ион металла, солдиненный со всеми 10-тью атомами углерода. Наиболее ярким примером сэндвичевых соединений является ферроцен:

Схема 32.Ферроцен.
С использованием димера циклопентадиена получается полициклический углеводород адамантан. Этот углеводород построен из четырех циклогексановых фрагментов. Особенностью его строения является то, что ни один цикл не является напряженным:

Схема 33.Схема синтеза адамантана.
