
Тема 4. Химическое равновесие. Влияние внешних условий на равновесное состояние
Задача №15
Запишите выражения для констант равновесия KC, Kр и KN и установите связь между ними для реакции, приведенной в табл. 2.
Решение:
Решение
задачи рассмотрим на примере реакции
![]() ,
считая реагирующие вещества идеальными
газами.
,
считая реагирующие вещества идеальными
газами.
В условиях равновесия при р, T = const схематическая запись химической реакции имеет вид:
![]() ,
,
где a, b, c, d – стехиометрические коэффициенты веществ A, B, C, D. Для рассматриваемой реакции закон действующих масс устанавливает постоянство отношения произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам, то есть
 .
.
На основании закона действующих масс запишем выражение для константы равновесия KC для реакции синтеза аммиака.
 .
.
Аналогичным образом записываются формулы для констант равновесия, выраженных через равновесные парциальные давления:

и равновесные мольные доли:
 .
.
Связь
между Kр
и KC
устанавливается
на основании уравнения (9). Для i-го
компонента газовой смеси
![]() ,
отсюда:
,
отсюда:![]() .
На основании данного выражения
.
На основании данного выражения
 .
.
Для реакции синтеза аммиака n = (2) – (1 + 3) = – 2. Следовательно,
![]() .
.
Связь
между Kр
и KN
устанавливается
на основании закона
Дальтона:
![]() ,
гдер
– общее давление в системе. Оперируя
данным выражением, получим
,
гдер
– общее давление в системе. Оперируя
данным выражением, получим
 .
.
Необходимо отметить, что при расчете констант всегда используется безразмерное относительное давление, равное отношению давления к стандартному значению ро = 1 атм = 1,01325∙105 Па.
Задача №16
Для реакции, приведенной в табл. 2, рассчитайте константы равновесия Kр, KC и KN при 298 К и общем давлении р Па (табл.15). Выразите константу равновесия Kр через состав равновесной смеси, если для проведения реакции исходные вещества взяты в стехиометрическом соотношении.
Таблица 15
|
Вариант |
р·10–6, Па |
Вариант |
р·10–6, Па |
|
1 |
9,73 |
16 |
9,76 |
|
2 |
9,74 |
17 |
9,78 |
|
3 |
9,75 |
18 |
9,79 |
|
4 |
9,73 |
19 |
9,73 |
|
5 |
9,73 |
20 |
9,73 |
|
6 |
9,73 |
21 |
9,79 |
|
7 |
9,74 |
22 |
9,74 |
|
8 |
9,77 |
23 |
9,75 |
|
9 |
9,78 |
24 |
9,73 |
|
10 |
9,73 |
25 |
9,71 |
|
11 |
9,77 |
26 |
9,77 |
|
12 |
9,77 |
27 |
9,75 |
|
13 |
9,78 |
28 |
9,78 |
|
14 |
9,79 |
29 |
9,77 |
|
15 |
9,76 |
30 |
9,76 |
Решение:
Решение
задачи рассмотрим на примере реакции
![]() .
Рассчитаем константы равновесияKN,
KC
и Kр
при Т
= 298 К и общем
давлении 9,73·106
Па, если для
проведения реакции исходные вещества
взяты в стехиометрическом соотношении
(1 моль N2
и 3 моль H2).
.
Рассчитаем константы равновесияKN,
KC
и Kр
при Т
= 298 К и общем
давлении 9,73·106
Па, если для
проведения реакции исходные вещества
взяты в стехиометрическом соотношении
(1 моль N2
и 3 моль H2).
Значение константы равновесия при температуре 298 К найдем из соотношения
![]() .
.
Отсюда
![]() .
.
![]() = –32953,5 Дж (см.
задачу №13).
= –32953,5 Дж (см.
задачу №13).
![]() .
.
Соотношения между KC, Kр и KN выведены в задаче 15:
![]() ,
,
![]()
где р – относительное давление, т.е. давление, отнесенное к стандартному: р = 9,73·106 / 1,01325∙105 = 96.
![]() ,
,
![]() .
.
Для расчета состава равновесной смеси определим количество молей в состоянии равновесия.
Обозначим
через х
число молей NH3
в момент равновесия. На основании
стехиометрии реакции, если образовалось
две молекулы NH3,
то израсходована одна молекула азота
и три молекулы водорода. Таким образом,
если образовалось х
молей NH3,
то израсходовано
![]() молейN2
и
молейN2
и
![]() молейH2.
По условию задачи для проведения реакции
взяты 1 моль N2
и 3 моль H2.
Следовательно,
к моменту равновесия в реакционной
смеси осталось
молейH2.
По условию задачи для проведения реакции
взяты 1 моль N2
и 3 моль H2.
Следовательно,
к моменту равновесия в реакционной
смеси осталось
![]() молейN2
и
молейN2
и
![]() молейH2
.
молейH2
.
Рассчитаем общее число молей компонентов реакции в момент равновесия
![]() .
.
Определим мольную долю каждого компонента реакции при равновесии по формуле (41). Определим также равновесное парциальное давление компонентов на основании закона Дальтона (табл.16).
Таблица 16
|
Вещество |
N2 |
H2 |
NH3 | |
|
Число молей |
В начале реакции |
y |
3y |
– |
|
В момент равновесия |
|
|
| |
|
Мольная доля компонента |
|
|
| |
|
Равновесное парциальное давление |
|
|
| |
Выражение для константы равновесия имеет вид:

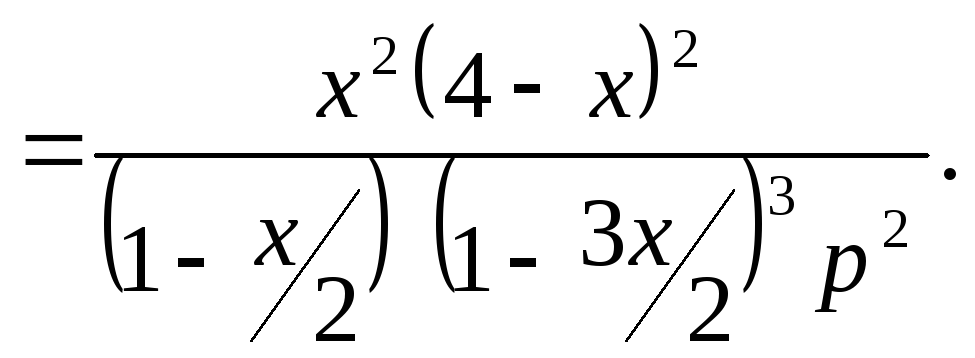
Задача №17
Рассчитайте при температуре Т К (табл. 6) изменение энергии Гиббса G0 для реакции, приведенной в табл. 2.
Решение:
Вычислим
G0
при 800 К
для реакции
![]() .
.
Вариант
а) Приближенный
расчет,
в котором принимается
энтропия реакции постоянной и не
учитывается изменение теплоемкости
реакции от температуры (т.е.
![]() ).
Такое приближенное решение необходимо
для быстрой оценки возможности реакции
при интересующей нас температуре.
).
Такое приближенное решение необходимо
для быстрой оценки возможности реакции
при интересующей нас температуре.
![]() =
– ΔS0298,
=
– ΔS0298,
Расчет ΔS0298, реакции показан в задаче №10. ΔS0298, реакции = – 197,74 Дж/К.
Разделим переменные и проинтегрируем:
dG0 = ΔS0298 dT,
 ,
,
GT0 = ΔG0298 – ΔS0298 (T – 298). (57)
Величину изменении энергии Гиббса для данной реакции при Т = 298 К ΔG0298, реакции рассчитываем по справочным данным (см. задачу №13): ΔG0298, реакции = – 32960 Дж.
![]() =
– 32960 – (–197,74)·(800 – 298) = 66305,5 Дж.
=
– 32960 – (–197,74)·(800 – 298) = 66305,5 Дж.
Вариант б) Точный расчет производим по формуле
![]() =
=
![]() – 800·
– 800·![]() ,
(58)
,
(58)
последовательно
рассчитав точные значения изменения
энтропии и теплового эффекта реакции,
с учетом зависимости теплоемкостей
участников реакции от температуры (т.е.
![]() )
(см. задачи №8 и №10):
)
(см. задачи №8 и №10):
![]() =
– 107815 Дж
=
– 107815 Дж
![]() =
– 230,36 Дж/K.
=
– 230,36 Дж/K.
![]() =
– 107815 – 800·(–230,36) = 76473 Дж.
=
– 107815 – 800·(–230,36) = 76473 Дж.
Вариант в) Точный расчет по методу Шварцмана–Темкина с учетом зависимости изменения теплоемкости реакции от температуры производят по уравнению:
![]() .
( 59).
.
( 59).
Вычисления по данному уравнению исключают интегрирование и сводятся к умножению и сложению.
В
данном уравнении
![]() – стандартный тепловой эффект реакции
при температуре 298 К,
– стандартный тепловой эффект реакции
при температуре 298 К,![]() = – 91880 Дж (см. задачу №2);
= – 91880 Дж (см. задачу №2);![]() – изменение энтропии в ходе реакции
при температуре 298 К,
– изменение энтропии в ходе реакции
при температуре 298 К,![]() = – 197,74 Дж/К (см. задачу № 10);
= – 197,74 Дж/К (см. задачу № 10);![]() ,
,![]() и др. –коэффициенты уравнения
и др. –коэффициенты уравнения![]() .
Их значения рассчитаны в задаче №7:
.
Их значения рассчитаны в задаче №7:
![]() –50,12;
–50,12;
![]() 36,91·10–3;
36,91·10–3;
![]() –3,34·105;
–3,34·105;
![]() –1,15·10–6.
–1,15·10–6.
Коэффициенты
![]() при необходимой температуре Т определяем
по справочнику. Для температуры 800 К:
при необходимой температуре Т определяем
по справочнику. Для температуры 800 К:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.

Во
всех трех вариантах расчета значение
![]() оказалось положительным в отличие от
оказалось положительным в отличие от
![]() ,
т.е. повышение температуры неблагоприятно
для протекания реакции в прямом
направлении, при температуре Т = 800 К
самопроизвольный процесс идет от
продуктов реакции к исходным веществам.
,
т.е. повышение температуры неблагоприятно
для протекания реакции в прямом
направлении, при температуре Т = 800 К
самопроизвольный процесс идет от
продуктов реакции к исходным веществам.
Задача №18
Рассчитайте
константу равновесия
![]() для реакции, приведенной в табл. 2, при
298 К и температуреТ
К (табл. 6).
для реакции, приведенной в табл. 2, при
298 К и температуреТ
К (табл. 6).
Решение:
Решение
задачи рассмотрим на примере реакции
образования аммиака
![]() .
Найдем константу равновесия при
температурах 298 К и 800 К.
.
Найдем константу равновесия при
температурах 298 К и 800 К.
Значение константы равновесия при температуре 298 К найдем из соотношения
![]() .
(60)
.
(60)
Отсюда
![]() .
.
![]() = –32953,5 Дж (см.
задачу №13).
= –32953,5 Дж (см.
задачу №13).
![]() .
.
Расчет константы равновесия при температуре, отличной от стандартной, можно произвести с различной степенью точности.
Вариант а) Приближенный расчет. Значение константы равновесия при температуре Т можно найти, воспользовавшись уравнением изобары Вант-Гоффа:
![]() (
61)
(
61)
Считая
тепловой эффект реакции
![]() постоянным в интервале температур от
Т1
до Т2.
постоянным в интервале температур от
Т1
до Т2.
![]() =
=![]() = – 91880 Дж (см. задачу №2).
= – 91880 Дж (см. задачу №2).
 .
( 62)
.
( 62)
После интегрирования уравнения (62) получаем следующее выражение:
![]() ,
,
![]() ,
,
Если
Т1
= 298, то
![]() .
.
![]() ,
,
![]() .
.
![]() .
.
Вариант б) Более точный расчет должен учитывать зависимость теплового эффекта реакции от температуры. Эту зависимость можно вывести также с разной степенью точности.
При
условии, что теплоемкость не зависит
от температуры (![]() )
)![]() Дж/К (см. задачу №8) получаем уравнение:
Дж/К (см. задачу №8) получаем уравнение:
![]() .
.
Подставим полученную зависимость в уравнение изобары Вант–Гоффа:
![]() ,
,
 ,
,
![]()
![]() ,
,
![]() ;
;
![]() .
.
Вариант
в) Точный
расчет.
Расчет будет точным, если при выводе
уравнения зависимости теплового эффекта
реакции от температуры учитывать
зависимости теплоемкостей участвующих
в реакции веществ от температуры, т.е.
учитывать уравнение ![]() :
:
![]() .
.
По
данным задачи №8 уравнение ![]() для реакции образования аммиака имеет
вид:
для реакции образования аммиака имеет
вид:
![]() =
–50,12 + 36,91·10–3Т
– 3,34·105/Т2
+ 1,50·10--6Т2.
=
–50,12 + 36,91·10–3Т
– 3,34·105/Т2
+ 1,50·10--6Т2.
Зависимость теплового эффекта этой реакции от температуры:
![]()

После подстановки этой зависимости в уравнение изобары Вант–Гоффа, получим


![]() ,
,

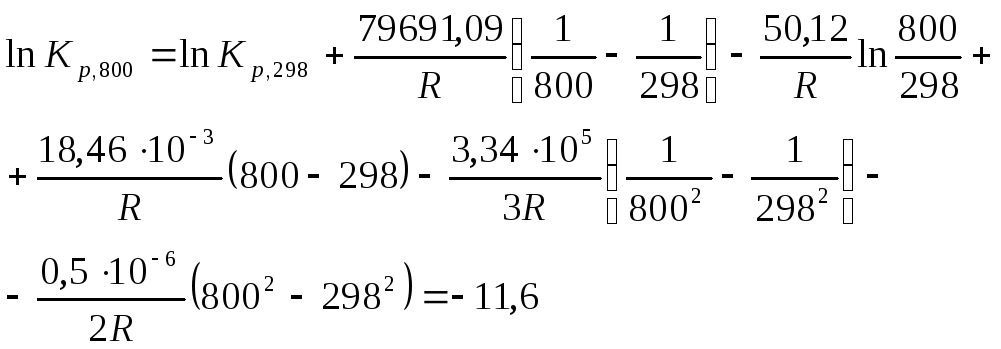
![]() .
.
Вариант
г) Точный расчет. Константа равновесия
реакции образования аммиака при
температуре 800 К может быть точно
рассчитана по значению изменения энергии
Гиббса, которое вычислено с учетом
влияния температуры на![]() ,
,![]() и
и![]() реакции (см. задачу №17):
реакции (см. задачу №17):
![]() = 76746,6 Дж.
= 76746,6 Дж.
![]() .
.
Задача №19
Определить
направление реакции, приведенной
в табл. 2, при температуре Т
К (табл. 6) и общем давлении р
Па, если
число молей неравновесной смеси
![]() ,
,![]() (исходные вещества),
(исходные вещества),![]() ,
,![]() (продукты реакции) даны в табл. 17. Значение
константы равновесия при температуреТ
взять из задачи №17.
(продукты реакции) даны в табл. 17. Значение
константы равновесия при температуреТ
взять из задачи №17.
Таблица 17
|
Вариант |
|
|
|
|
р·10–6, Па |
|
1 |
0,5 |
0,2 |
0,3 |
– |
9,73 |
|
2 |
0,5 |
0,1 |
0,5 |
0,1 |
9,74 |
|
3 |
0,5 |
– |
0,5 |
– |
9,75 |
|
4 |
0,25 |
0,25 |
0,25 |
0,25 |
9,73 |
|
5 |
0,3 |
0,2 |
0,2 |
0,3 |
9,73 |
|
6 |
0,25 |
0,35 |
0,15 |
0,25 |
9,73 |
|
7 |
0,6 |
– |
0,2 |
0,2 |
9,74 |
|
8 |
0,25 |
0,4 |
0,25 |
0,1 |
9,77 |
|
9 |
0,35 |
0,3 |
0,25 |
0,1 |
9,78 |
|
10 |
0,1 |
0,6 |
0,15 |
0,15 |
9,73 |
|
11 |
0,325 |
– |
0,325 |
0,35 |
9,77 |
|
12 |
0,4 |
– |
0,3 |
0,3 |
9,77 |
|
13 |
0,3 |
0,3 |
0,4 |
– |
9,78 |
|
14 |
015 |
0,15 |
0,7 |
– |
9,79 |
|
15 |
0,15 |
0,15 |
0,35 |
0,35 |
9,76 |
|
16 |
0,25 |
0,25 |
0,25 |
0,25 |
9,76 |
|
17 |
0,5 |
– |
0,15 |
0,35 |
9,78 |
|
18 |
0,35 |
0,5 |
0,15 |
– |
9,79 |
|
19 |
0,5 |
0,4 |
0,1 |
– |
9,73 |
|
20 |
0,3 |
0,2 |
0,2 |
0,3 |
9,73 |
|
21 |
0,2 |
0,2 |
0,6 |
– |
9,79 |
|
22 |
0,55 |
– |
0,15 |
0,3 |
9,74 |
|
23 |
0,35 |
0,55 |
0,1 |
– |
9,75 |
|
24 |
0,4 |
– |
0,4 |
0,2 |
9,73 |
|
25 |
0,25 |
0,4 |
0,25 |
0,1 |
9,71 |
|
26 |
0,8 |
0,15 |
0,15 |
- |
9,77 |
|
27 |
0,3 |
– |
0,3 |
0,4 |
9,75 |
|
28 |
0,1 |
0,6 |
0,15 |
0,15 |
9,78 |
|
29 |
0,25 |
– |
0,25 |
0,5 |
9,77 |
|
30 |
0,15 |
0,15 |
0,35 |
0,35 |
9,76 |
Решение:
Решение
задачи рассмотрим на примере реакции
образования аммиака
![]() .Определим
направление данной реакции при
температуре Т
= 800 К и общем давлении р
= 9,73·106
Па, если число молей компонентов реакции
в исходной неравновесной смеси составило
.Определим
направление данной реакции при
температуре Т
= 800 К и общем давлении р
= 9,73·106
Па, если число молей компонентов реакции
в исходной неравновесной смеси составило
![]() = 0,5;
= 0,5;
![]() = 0,3;
= 0,3;![]() = 0,2. Значение константы равновесия
= 0,2. Значение константы равновесия![]() (см. задачу № 17).
(см. задачу № 17).
Установим
знак величины
![]() .Воспользуемся
уравнением изотермы Вант–Гоффа:
.Воспользуемся
уравнением изотермы Вант–Гоффа:
![]() ,
(63),
,
(63),
где
![]() – величина, рассчитываемая по той же
формуле, что и
– величина, рассчитываемая по той же
формуле, что и![]() ,
но для неравновесных условий, как
отношение неравновесных парциальных
давлений компонентов реакции (
,
но для неравновесных условий, как
отношение неравновесных парциальных
давлений компонентов реакции (![]() )
)
 .
.
 .
.
При анализе уравнения изотермы Вант–Гоффа следует рассмотреть три случая:
1)
Если
![]() >
>
![]() ,
то
,
то
![]() > 0, т.е. реакция идет в обратном
направлении в сторону образования
исходных веществ.
> 0, т.е. реакция идет в обратном
направлении в сторону образования
исходных веществ.
2)
Если
![]() <
<
![]() ,
то
,
то
![]() < 0, т.е. реакция идет самопроизвольно
в прямом направлении в сторону образования
продуктов реакции.
< 0, т.е. реакция идет самопроизвольно
в прямом направлении в сторону образования
продуктов реакции.
3)
Если
![]() =
=
![]() ,
то
,
то
![]() = 0, т.е. система находится в равновесии.
= 0, т.е. система находится в равновесии.
Рассчитаем
величину
![]() через
через![]() – константу, выраженную через мольные
доли компонентов в неравновесной
исходной смеси.
– константу, выраженную через мольные
доли компонентов в неравновесной
исходной смеси.
 .
.
Для
этого рассчитаем величины мольных долей
компонентов неравновесной смеси
![]() с использованием формулы
с использованием формулы
![]() .
.
Общее число молей неравновесной смеси
![]() .
.
Мольные доли компонентов в данном случае:
![]() ;
;
![]() ;
;![]()
численно равны числу молей этих компонентов в системе.
![]() .
.
Так
как
![]() <
<
![]() ,
то выполняется условие (2), следовательно,
реакция будет протекать самопроизвольно
в прямом направлении. Подтвердим
полученные данные расчетом
,
то выполняется условие (2), следовательно,
реакция будет протекать самопроизвольно
в прямом направлении. Подтвердим
полученные данные расчетом
![]() :
:
![]() Дж/моль.
Дж/моль.
Задача №20
Оцените влияние температуры и давления на константу равновесия реакции, приведенной в табл. 2. Тепловой эффект реакции взять из решения задачи №2.
Решение:
Решение
задачи рассмотрим на примере реакции
синтеза аммиака
![]() .
.
а) Для оценки влияния температуры воспользуемся уравнением изобары Вант–Гоффа (61).
Анализ
уравнения изобары Вант-Гоффа показывает,
что характер зависимости константы
равновесия
![]() от температуры определяется знаком
теплового эффекта
от температуры определяется знаком
теплового эффекта![]() .
Возможны 3 случая:
.
Возможны 3 случая:
1)
![]() > 0 – для эндотермических реакций, т.е.
реакций, протекающих с поглощением
теплоты. Отсюда
> 0 – для эндотермических реакций, т.е.
реакций, протекающих с поглощением
теплоты. Отсюда![]() ,
зависимость константы равновесия от
температуры будет возрастающей, т.е. с
ростом температуры константа равновесия
,
зависимость константы равновесия от
температуры будет возрастающей, т.е. с
ростом температуры константа равновесия
![]() будет увеличиваться.
будет увеличиваться.
2)
![]() < 0 – для экзотермических реакций, т.е.
реакций, протекающих с выделением
теплоты. Отсюда
< 0 – для экзотермических реакций, т.е.
реакций, протекающих с выделением
теплоты. Отсюда![]() ,
зависимость константы равновесия от
температуры будет убывающей, т.е. с
ростом температуры константа равновесия
,
зависимость константы равновесия от
температуры будет убывающей, т.е. с
ростом температуры константа равновесия![]() будет уменьшаться.
будет уменьшаться.
3)
Если
![]()
0, то
0, то
![]() ,
следовательно, константа равновесия
от температуры не зависит.
,
следовательно, константа равновесия
от температуры не зависит.
Для рассматриваемой
реакции
![]() = –91,88 кДж, т.е. реакция является
экзотермической, следовательно,
выполняется условие (2). Поэтому с ростом
температуры константа равновесия будет
уменьшаться. Это согласуется с величинами
констант равновесия при температурахТ= 298 К иТ= 800 К (см. решение задачи
№ 18).
= –91,88 кДж, т.е. реакция является
экзотермической, следовательно,
выполняется условие (2). Поэтому с ростом
температуры константа равновесия будет
уменьшаться. Это согласуется с величинами
констант равновесия при температурахТ= 298 К иТ= 800 К (см. решение задачи
№ 18).
б) Для оценки влияния давления воспользуемся уравнением Планка:
![]() ,
(64),
,
(64),
где
![]() – изменение числа молей газообразных
веществ в ходе реакции. Проанализируем
уравнение Планка:
– изменение числа молей газообразных
веществ в ходе реакции. Проанализируем
уравнение Планка:
1)
Если реакция идет с увеличением числа
молей газообразных веществ,
![]() ,
то
,
то![]() ,
т.е. с ростом давления константа равновесия
,
т.е. с ростом давления константа равновесия![]() уменьшается.
уменьшается.
1Для органических веществ уравнение зависимости теплоемкости от температуры Ср= а +bT+cT2, для неорганических Ср= а +bT+c//T2.




