- •Сборник контрольных работ по курсу общей химии
- •1. Основные классы неорганических соединений
- •Назовите следующие вещества и укажите, к какому классу химических соединений они относятся:
- •Напишите формулы следующих соединений:
- •Составьте уравнения реакций получения следующих соединений и рассчитайте массы реагентов, необходимых для получения 1 г вещества:
- •1.4. Напишите уравнения соответствующих реакций, учитывая, что другие вещества можно использовать только в качестве катализаторов:
- •1.5. Изобразите графические (структурные) формулы следующих соединений:
- •2. Основные законы химии
- •2.1. Рассчитайте давление в сосуде:
- •2.2. Вычислите эквивалентную массу:
- •2.3. Определите простейшую формулу вещества, если оно содержит (по массе):
- •2.4. Расставьте стехиометрические коэффициенты в приведенных схемах реакций и рассчитайте, какую массу второго реагента нужно взять на 1 г первого, чтобы реакция прошла до конца:
- •Определите, какие продукты и в каком количестве (по массе) получатся при взаимодействии (обратите внимание на избыток одного из реагентов):
- •3. Строение атома и химическая связь
- •3.2. Определите, относится ли данная электронно-ячеечная формула к основному, возбужденному или невозможному состоянию атома, назовите химический элемент и укажите его порядковый номер:
- •Напишите уравнения ядерных реакций:
- •Определите тип гибридизации и пространственное строение следующих молекул и ионов:
- •Объясните с помощью метода молекулярных орбиталей возможность образования следующих молекул и ионов, определите порядок связи, установите, являются ли они диамагнитными или парамагнитными:
- •4. Химическая термодинамика
- •4.1. Пользуясь справочными данными, вычислите тепловой эффект (изменение энтальпии) реакций:
- •4.2. Не производя вычислений, определите знак изменения энтропии в следующих реакциях:
- •4.3. Вычислите изменение свободной энергии Гиббса и определите возможность протекания реакции при стандартных условиях:
- •5. Химическая кинетика и равновесие
- •5.1. Определите порядок реакции и рассчитайте, как изменится начальная скорость гомогенных химических реакций согласно закону действующих масс:
- •5.2. Рассчитайте, как изменится скорость реакции при изменении температуры:
- •5.3. Определите, в каком направлении сместится равновесие гомогенных химических реакций, для оценки влияния температуры на степень смещения химического равновесия рассчитать δн реакции:
- •5.4. Найдите константы равновесия гомогенных химических реакций и исходные концентрации реагентов, если в закрытом сосуде установились следующие равновесные концентрации:
- •6. Растворы
- •6.1. Определите массовую долю (в процентах) и молярную концентрацию раствора, содержащего:
- •6.2. Определите массовую долю (в процентах) и моляльную концентрацию растворов, полученных:
- •6.3. Определите относительное понижение давления пара над раствором, содержащим:
- •6.4. Найдите температуру кипения раствора, содержащего:
- •6.5. Найдите температуру замерзания раствора, содержащего:
- •7. Теория электролитической диссоциации
- •7.2. Определите pH следующих растворов электролитов (изменением объема при смешении растворов пренебречь):
- •7.4. Рассчитайте степень диссоциации в следующих растворах слабых электролитов, пользуясь справочными данными о Ка (для много-основных кислот учитывайте только первую ступень диссоциации):
- •8. Окислительно-восстановительные реакции
- •8.1. Определите степени окисления элементов в веществах:
- •8.2. Укажите, какие атомы окисляются, а какие восстанавливаются в указанных схемах, и определите, как изменяется их степень окисления:
- •8.3. Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций ионно-электронным способом:
- •8.4. Определите, в каком направлении протекает реакция в системе, используя справочные данные о стандартных восстановительных потенциалах полуреакций:
- •9. Электрохимические процессы и системы
- •Вычислите электродные потенциалы металлов, находящихся в контакте с растворами их солей заданной концентрации, при 25с:
- •Напишите уравнения электродных реакций на катоде и аноде и вычислите эдс гальванических элементов при 25с, для которых указаны концентрации ионов металла в растворах:
- •Каковы катодные и анодные процессы (угольный анод) при электролизе водного раствора, содержащего смесь солей:
- •9.5. Напишите уравнения, отражающие анодный и катодный процессы при электрохимической коррозии в указанных ниже системах:
- •10. Примеры решения типовых задач
- •11. Примеры задач повышенной трудности
- •Литература
- •Оглавление
- •Издательство «Экоцентр»
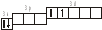
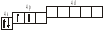
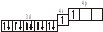
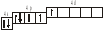
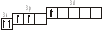
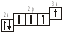
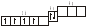
3.2. Определите, относится ли данная электронно-ячеечная формула к основному, возбужденному или невозможному состоянию атома, назовите химический элемент и укажите его порядковый номер:
|
3.2.1. |
|
|
3.2.10. |
| |
|
3.2.2. |
|
|
3.2.11. |
| |
|
3.2.3. |
|
|
3.2.12. |
| |
|
3.2.4. |
|
|
3.2.13. |
| |
|
3.2.5. |
|
|
3.2.14. |
| |
|
3.2.6. |
|
|
3.2.15. |
| |
|
3.2.7. |
|
|
3.2.16. |
| |
|
3.2.8. |
|
|
3.2.17. |
| |
|
3.2.9. |
|
|
3.2.18. |
| |
|
3.2.19. |
|
|
3.2.20. |
| |
Напишите уравнения ядерных реакций:
238U + 4He
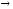 3n
+
...
3n
+
...
 ...
...225Th
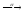 ...
... ...
...59Co+4He
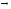 n+...
n+...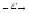 ...
...142Nd+p
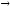 2n+
...
2n+
...
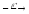 ...
...131Sn
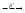 ...
...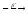 ...
...14N+12C
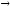 4He+...
4He+...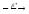 ...
...19F + p
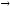 n
+ ...
n
+ ...
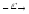 ...
...16O + 14N
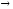 2p+...
2p+...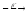 ...
...235U + n
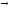 139Ba
+ 3n
+ ...
139Ba
+ 3n
+ ...213Bi
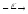 ...
... ...
...
30Si+3He
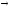 2p+...
2p+...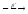 ...
...114Cd + n
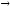 p+...
p+...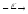 ...
...10B+4He
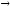 n+....
n+....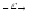 ...
...139Xe
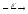 ...
...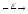 ...
...226Pa
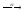 ...
...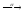 ...
...46Ti + 2H
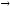 n+...
n+...
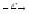 ...
...89Br
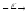 ...
...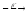 ...
...238U
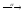 ...
...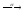 ...
...213Po
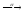 ...
...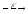 ...
...211Bi
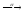 ...
...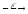 ...
...
Определите тип гибридизации и пространственное строение следующих молекул и ионов:
|
|
|
|
Объясните с помощью метода молекулярных орбиталей возможность образования следующих молекул и ионов, определите порядок связи, установите, являются ли они диамагнитными или парамагнитными:
|
|
|
|
4. Химическая термодинамика
Первое начало термодинамики:
U = Q – A,
где U— внутренняя энергия,Q— теплота,A— работа.
Закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояния, но не зависит от пути превращения.
Следствие из закона Гесса:
H(реакции) =Hf (продуктов) –Hf (реагентов),
где H — энтальпия (H = U + pV), Hf — энтальпия образования вещества.
Второе начало термодинамики:
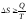 ,
где S— энтропия.
,
где S— энтропия.
Для изолированных систем: S0.
S(реакции) =S(продуктов) –S(реагентов).
Свободная энергия Гиббса:
G=H–TS,
G(реакции) =Gf (продуктов) –Gf (реагентов).
Для самопроизвольных реакций G < 0.
4.1. Пользуясь справочными данными, вычислите тепловой эффект (изменение энтальпии) реакций:
2SO2(г.) + O2(г.) = 2SO3(г.)
4NH3(г.) + 3O2(г.) = 2N2(г.) + 6H2O(г.)
2С2H2(г.) + 5O2(г.) = 4CO2(г.) + 2H2O(г.)
С2H5OH(ж.) + 3O2(г.) = 2CO2(г.) + 3H2O(ж.)
2KClO3(тв.) = 2KCl(тв.) + 3O2(г.)
4HCN(г.) + 5O2(г.) = 2H2O(ж.) + 4CO2(г.) + 2N2(г.)
CO2(г.) + C(графит) = 2CO(г.)
C2H4(г.) + 3O2(г.) = 2CO2(г.) + 2H2O(г.)
WO3(тв.) + 2Al(тв.) = Al2O3(тв.) + W(тв.)
TiO2(тв.) + 2Mg(тв.) = Ti(тв.) + 2MgO(тв.)
2H2O2(ж.) = 2H2O(ж.) + O2(г.)
(CuOH)2CO3(тв.) = 2CuO(тв.) + CO2(г.) + H2O(г.)
Fe2O3(тв.) + 3СO(г.) = 2Fe(тв.) + 3СO2(г.)
CH4(г.) + 2O2(г.) = CO2(г.) + 2H2O(г.)
2C2H6(г.) + 7O2(г.) = 4CO2(г.) + 6H2O(г.)
6CO2(г.) + 6H2O(ж.) = C6H12O6(тв.) + 6O2(г.)
2Fe2O3(тв.) + 3С(графит) = 4Fe(тв.)+3СO2(г.)
С6H12O6(тв.) = 2С2H5OH(ж.) + 2CO2(г.)
2H2S(г.) + SO2(г.) = 3S(ромб.) + 2H2O(г.)
4NH3(г.) + 5O2(г.) = 4NO(г.) + 6H2O(ж.)