
- •Определение отношения теплоемкостей по методу клемана и дезорма.
- •Теоретическое введение
- •Три состояния воздуха при сжатии и графики соответствующих переходов
- •Три состояния воздуха при расширении и графики соответствующих переходов
- •Результаты измерений и вычислений
- •Контрольные вопросы
- •Литература
Определение отношения теплоемкостей по методу клемана и дезорма.
Цель
работы
– определить отношение теплоемкостей
![]() для воздуха.
для воздуха.
Приборы и принадлежности – стеклянный баллон емкостью около 25 литров с краном, манометр, насос, соединительные трубки.
Теоретическое введение
Удельной теплоемкостью вещества называется физическая величина, равная количеству теплоты, необходимой для нагревания единицы массы вещества на 1 оС(К) в данном процессе.
![]()
Молярной теплоемкостью вещества называется физическая величина, равная количеству теплоты, необходимой для нагревания одного моля вещества на 1оС(К) в данном процессе.
![]()
Очевидно,
![]()
где
![]() молярная
масса вещества.
молярная
масса вещества.
Для
газов принято различать теплоемкость
при постоянном объеме Сv
и
при постоянном внешнем
давлении Cp,
в зависимости от процесса нагревания
газа.
Согласно первому закону термодинамики количество переданной системе теплоты расходуется на увеличение внутренней энергии системы и работу расширения
dQ=dU+dA
При нагревании газа при V=const работа расширения dA=0, и все тепло идет на увеличение внутренней энергии, т.е. на нагревание газа.
При нагревании газа при P=const тепло затрачивается не только на нагревание, но и на работу расширения газа. Поэтому Сp > Сv.
Согласно кинетической теории идеального газа
![]()
где z – число степеней свободы молекулы
n – число молей газа
T –температура по шкале Кельвина
R – универсальная газовая постоянная
![]()
![]()
![]()
![]()
Соответственно: для двухатомного газа z = 5 и γ = 1,40; для многоатомного z = 6 и γ = 1,33.
Для
экспериментального определения
![]() воздуха в данной работе используется
адиабатический процесс расширения или
сжатия.
воздуха в данной работе используется
адиабатический процесс расширения или
сжатия.
Адиабатическим процессом называется процесс без теплового обмена с окружающей средой. dQ=0
Первое начало термодинамики для адиабатического процесса запишется как
0=dU+dA
или
а) dU = – dA - увеличение внутренней энергии газа (нагревание) происходит за счет работы внешних сил, совершающих сжатие газа.
б) dA = – dU – работа расширения, совершаемая газом, происходит за счет уменьшения его внутренней энергии.
Таким образом, при адиабатическом сжатии газ нагревается, при адиабатическом расширении – охлаждается.
Для осуществления адиабатического процесса нужно либо теплоизолировать систему, либо вести процесс так быстро, чтобы теплообмен не успел произойти.
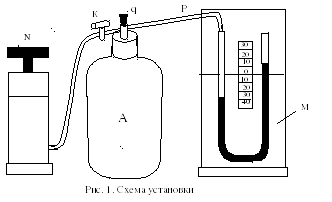
Описание установки.
Стеклянный баллон А емкостью 25 литров с пробкой q соединен резиновыми трубками с насосом N и манометром М. На трубке, соединяющей баллон с насосом, имеется кран К (см. рис. 1).
Проведение эксперимента
I.
Определение
![]() при сжатии воздуха.
при сжатии воздуха.
1) Перед опытом открыть пробку q. Давление воздуха в баллоне А станет равным атмосферному давлению, и жидкость в манометре установится на одном и том же уровне в обоих коленах.
2) Закрыть трубку сосуда пробкой q, открыть кран К и осторожно накачать при помощи насоса N некоторое количество воздуха. Уровень жидкости в левом (соединенном с баллоном) колене начинает при этом опускаться, а в правом – подниматься.
Накачивать воздух следует до тех пор, пока разность высот уровней жидкости в манометре не достигнет нескольких десятков сантиметров ( 25 – 30 см ). (При накачивании воздух в баллоне сжимается, и температура его повышается ).
3) Закрыть кран К и дать воздуху в баллоне охладиться до комнатной температуры. Так как при охлаждении газа в баллоне его давление понижается, то разность уровней жидкости в манометре несколько уменьшается. Когда температура в баллоне станет равной температуре окружающего воздуха, перемещение уровней жидкости в манометре прекратится, и установится определенная разность высот h1 , которую отмечают по шкале манометра. Давление внутри баллона будет равно
P1 = H + h1 ,
где Н – атмосферное давление. Удельный объем газа (объем, занимаемый единицей массы газа) в баллоне будет V1, а температура t1 = tкомн . Это состояние изобразится точкой А на графике, приведенном в таблице 1.
4). Открыть и очень быстро закрыть пробку q . При этом с воздухом в баллоне произойдут два следующие друг за другом процесса:
а).
В момент открытия пробки происходит
быстрое расширение воздуха, заключенного
в баллоне, которое можно считать
адиабатическим из-за его кратковременности.
Давление при этом упадет до атмосферного
и будет равно Р2
= Н.
Удельный
объем возрастает до V2
, так как часть воздуха вышла, и на единицу
массы теперь приходится больший объем.
Температура становится ниже комнатной
t2
<
t1
, так как воздух адиабатически расширился.
Это второе состояние изображается на
графике, приведенном в таблице 1, точкой
В.
б). После закрытия пробки q через 2 – 3 минуты воздух в баллоне в результате теплообмена снова нагревается до комнатной температуры tк . В процессе теплообмена происходит изохорическое нагревание воздуха, так как удельный объем V2 остается неизменным. При этом давление воздуха возрастает до
Р3 =Н + h2.
Разность уровней h2 ( после того, как она установится ) снова отмечают по шкале манометра. Это третье состояние газа изобразится точкой С (см. тот же график и таблицу).
Состояниям А и С соответствует одна и та же температура, поэтому на графике эти точки можно соединить изотермой.
Таблица трех состояний в процессе работы не заполняется, она нужна для вывода расчетной формулы.
Таблица 1
