
- •Особенности термодинамики как науки.
- •Основные определения термодинамики.
- •Координаты и потенциалы.
- •Пример 3. Химические реакции и фазовые превращения.
- •Правило знаков для потенциалов:
- •Теплота и работа. Внутренняя энергия.
- •Работа на деформацию (деформационная работа).
- •Взаимодействия равновесное и неравновесное. Процессы статические и нестатические.
- •Уравнения состояния системы.
- •Уравнения состояния реальных газов.
- •Работа и теплота. Свойства работы и теплоты.
- •Характеристические функции.
- •Дифференциальные соотношения термодинамики.
- •Отличительные особенности типов дифференциальных соотношений.
- •2. Теория теплоёмкости разнородных систем.
- •2.1. Виды теплоемкостей.
- •2.2. Общая формула для теплоемкостей однородных систем.
- •2.3. Теплоёмкость идеального газа.
- •2.4. Зависимость теплоёмкости от давления, объёма и температуры.
- •2.5.Исследование теплоемкостей идеального газа.
- •2.6.Исследование зависимости изохорной и изобарной теплоёмкостей идеального газа от величины температуры.
- •2.7.Зависимость теплоёмкости от температуры. Истинная и средняя теплоёмкости.
- •3.Вычисление энтропии.
- •3.1.Энтопия. Общие формулы для энтропии идеального а реального газов.
- •3.2.Уравнение адиабаты реального газа в общем виде.
- •4.Исследование термодинамических процессов.
- •4.1.Политропный (политропический) процесс.
- •4.2.Метод определения показателя политропы по двум точкам.
- •4.3.Теплоемкость в политропном проессе.
- •4.4.Работа, теплота и внутренняя энергия в политропном процессе.
- •Исследование изопроцессов. Работа, теплота и внутренняя энергия в изопроцессах.
- •Второй закон термодинамики.
4.3.Теплоемкость в политропном проессе.
Из общей формулы теплоёмкости однородных систем имеем:
 (62)
(62)
Была поучена:
 (64)
(64)
Здесь
Cn-
массовая теплоемкость в политропном
процессе
 .
.
Так как газ в политропном процессе полагается идеальным, то





Подставим в уравнение (64)
 подставим
в уравнение
подставим
в уравнение

Здесь
по уравнению Майера R=Cp-Cv
,

 (122)
(122)
(122)- массовая теплоемкость в политропном процессе.
Так как k>1, то при 1<n<k – имеем cn<0. С точки зрения физики это трудно объяснимо, поэтому продолжим процесс вычисления с этим значением:
В
силу универсальности уравнения
 можно формально рассмотреть изопроцессы
как частные случаи политропного процесса:
можно формально рассмотреть изопроцессы
как частные случаи политропного процесса:
При n=0 →p=const, np = 0
При n=0 → pv=const (T=const), nT = 1
При n=k →S=const(pvk=const), nA = k
При n=
 (v=const),
nv
= .
(v=const),
nv
= .
Изобразим процессы на pv-диаграмме, для кривых возьмём общую точку:

пунктирной линией изображены процессы не относящиеся к простейшим.
4.4.Работа, теплота и внутренняя энергия в политропном процессе.
Абсолютная работа термодеформационной системы определяется:

Для того чтобы взять интеграл надо знать связь между P и v. Найдем связь из уравнения политропы:
pvn=const,



 (123)
(123)
Получим ещё несколько формул для вычисления работы. Преобразуем формулу (123):

Окончательно:
 (124)
(124)
Выразим
отношение
 из уравнения политропы
из уравнения политропы


Выразим отношение температур из уравнения:


(125)
Или
 (126)
(125), (126) широко используются в теории
газовых турбин, теории компрессоров,
газовой динамике
(126)
(125), (126) широко используются в теории
газовых турбин, теории компрессоров,
газовой динамике
В
политропном процессе газ считается
идеальным, а для идеального газа
 ,
и
,
и
 для любого процесса, в том числе и для
политропного.
для любого процесса, в том числе и для
политропного.
Теплота в политропном процессе определяется:
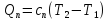
После подстановки
dQ = T dS
dQ = c dT
c
dT
= T
dS
=> dS
=
 =>dSn
= cn
=>dSn
= cn
 =
= ,
проинтегрировав, получим
,
проинтегрировав, получим
 .
.
Если за начало отсчета S взять нормальные физические условия, то можно получить формулу для энтропии:
 .
.
Получим ещё несколько формул:
 =>
=>
 =>
=>


 ,
при нормальных физических условиях
получим
,
при нормальных физических условиях
получим
 .
.
Исследование изопроцессов. Работа, теплота и внутренняя энергия в изопроцессах.
v = const,
 =>Av
= 0,
=>Av
= 0,
 ,
,
(Q
= U
+ A => Qv
= Uv)

T = const,
 ,
nT
= 1, p1v1
= p2v2
= RT = const
,
nT
= 1, p1v1
= p2v2
= RT = const
 ,
,
 ,
, ,
,
 ,
,
 ,
, ,UT
= 0
,UT
= 0
U = cv (T2 – T1) = 0,
Q = U + A => QT = AT

p = const,
 ,
np
= 0
,
np
= 0


Получим ещё одну формулу для расчёта теплоты. 1-ое начало термодинамики в энтальпийной форме

dU = TdS – p dv = dQ – p dv,
dU = dQ – p dv – v dp + v dp = dQ – d(pv) + v dp,
dQ = dU + d(pv) – v dp = d(U+pv) – v dp,
dQ = dI – v dp - 1-ое начало термодинамики в энтальпийной форме.
Из этого уравнения для изобарного процесса получим:
dQp = dI => Qp = I2 – I1.
Таким образом, в изобарном процессе теплота может быть вычислена по двум формулам:
 и
и
 ,
, .
.
 .
.
Адиабатный dQ=0, S=const
 ,
ns
= k,
,
ns
= k,
 ;
;
 ;
;
Из 1-ого начала термодинамики следует:
dQ = dU + dA, dAS = - dUS, AS = - US


