
- •Особенности термодинамики как науки.
- •Основные определения термодинамики.
- •Координаты и потенциалы.
- •Пример 3. Химические реакции и фазовые превращения.
- •Правило знаков для потенциалов:
- •Теплота и работа. Внутренняя энергия.
- •Работа на деформацию (деформационная работа).
- •Взаимодействия равновесное и неравновесное. Процессы статические и нестатические.
- •Уравнения состояния системы.
- •Уравнения состояния реальных газов.
- •Работа и теплота. Свойства работы и теплоты.
- •Характеристические функции.
- •Дифференциальные соотношения термодинамики.
- •Отличительные особенности типов дифференциальных соотношений.
- •2. Теория теплоёмкости разнородных систем.
- •2.1. Виды теплоемкостей.
- •2.2. Общая формула для теплоемкостей однородных систем.
- •2.3. Теплоёмкость идеального газа.
- •2.4. Зависимость теплоёмкости от давления, объёма и температуры.
- •2.5.Исследование теплоемкостей идеального газа.
- •2.6.Исследование зависимости изохорной и изобарной теплоёмкостей идеального газа от величины температуры.
- •2.7.Зависимость теплоёмкости от температуры. Истинная и средняя теплоёмкости.
- •3.Вычисление энтропии.
- •3.1.Энтопия. Общие формулы для энтропии идеального а реального газов.
- •3.2.Уравнение адиабаты реального газа в общем виде.
- •4.Исследование термодинамических процессов.
- •4.1.Политропный (политропический) процесс.
- •4.2.Метод определения показателя политропы по двум точкам.
- •4.3.Теплоемкость в политропном проессе.
- •4.4.Работа, теплота и внутренняя энергия в политропном процессе.
- •Исследование изопроцессов. Работа, теплота и внутренняя энергия в изопроцессах.
- •Второй закон термодинамики.
Особенности термодинамики как науки.
Термодинамика– наука о свойствах энергии в различных её видах и закономерностях перехода её от тела к телу, из вида в вид.
Термодинамика подразделяется на:
физическую термодинамику (общую);
техническую термодинамику;
химическую термодинамику;
термодинамику электрических и магнитных явлений и т.д.
Также существует деление термодинамики на:
равновесную (классическую);
неравновесную (находится в стадии развития).
Термодинамика – наука дедуктивная, позволяет получить наиболее общие закономерности, которые могут быть применены к конкретным частным случаям.
Термодинамика – наука макроскопическая. Она не рассматривает процессы на уровне микрочастиц. В этом заключается её сила и слабость. Термодинамике чужды представления о модельном строении вещества. Все кардинальные изменения в представлениях о строении вещества не сказываются на основных результатах термодинамики (это её сила), а слабость – в том, что термодинамика не может получить некоторые требуемые соотношения и вынуждена заимствовать эти результаты у других наук, например, обращаться к теоретической или экспериментальной физике.
Термодинамика феноменологична, т.е. некоторые положения в термодинамике не имеют должного теоретического основания и берутся лишь на основании многочисленных опытов и экспериментов.
Термодинамика базируется на понятии макроскопического равновесия, т.е. рассматривают состояния систем тогда, когда все термодинамические процессы находятся в равновесном состоянии. Макроскопическое равновесие не означает прекращение взаимодействия на уровне микрочастиц.
Основные определения термодинамики.
Система – тело или совокупность тел, являющихся объектом изучения.
Пр.: Если изучается газ, то системой является газ, всё остальное (сосуд, поршень и т.п.) – окружающая среда.
Процесс – изменение физических параметров системы, сопровождающиеся изменением термодинамических параметров системы.
Координаты и потенциалы.
Координатами состояния системы называются величины, которые изменяются при наличии данного взаимодействия и остаются неизменными при его отсутствии, т.о. координаты состояния системы – это индикаторы наличия данного взаимодействия.
Изменение величины, вызываемой координатой, свидетельствует о наличии процесса.
xk – обозначение координаты состояния при k-том взаимодействии.
Пример
1. Деформационное
(механическое), взаимодействие. Это
взаимодействие всегда сопровождается
изменением объема системы W,
м3.
В инженерных расчетах часто используется
удельный объем V,

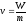 ,
m
– масса системы, кг.
,
m
– масса системы, кг.
т.о. при деформационном (механическом) взаимодействии координатой состояния взаимодействия является удельный объем V.
W
– м3,
v, - удельный объём
- удельный объём
Xдеф является удельный объём v.
Пример 2. Тепловое взаимодействие.
При тепловом взаимодействии всегда имеет место обмен между системой и окружающей средой.
В ходе развития науки было установлено, что координаты состояния системы является величина называемая энтропией.
Удельной
энтропией
системы
 называется отношение энтропии к ее
массе.
называется отношение энтропии к ее
массе.
Энтропия как термодинамический параметр системы опытным путем не определяется и определяется только опытным путём. Приборов для ее измерения нет. Значения энтропии определяются только расчетным путем по специальным методикам.
