
Химия, отчёт
.docФедеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ижевский государственный технический университет» имени М.Т. Калашникова
Кафедра «Химия и химическая технология»
Факультет «Современные технологии и автомобили»
Лабораторная работа
Тема: «Определение молярной массы эквивалента металла, методом вытеснения водорода»
Выполнил:
Студент группы Б-01-711-1 Костылев Р.А.
Проверил:
к.х.н. доцент Кубенко В.Д.
Ижевск 2012
Цель работы: Научиться экспериментально определять скорость химических реакций и оценивать влияние различных факторов на характер их протекания.
-
Теоретическая часть.
-
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
-
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в химической кинетике:
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для элементарной химической реакции:
![]()
-
Правило Вант-Гоффа : При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
-
Экспериментальная часть.
1. Опыт №1.
1) Влияние концентрации на скорость химической реакции.
Влияние концентрации на скорость изучаем на реакции взаимодействия тиосульфата натрия и серной кислоты:
Na2S2O3+H2SO4 = Na2SO4+SO2+S+H2O
2) Порядок выполнения опыта.
-
Приготовили в трёх пробирках равные объёмы растворов различной концентрации как указанно в таблице.
-
По секундомеру определили время с момента добавления капли кислоты до помутнения раствора в пробирке №1.
-
Опыт повторили поочерёдно с пробирками 2 и 3.
-
Посчитали скорость реакции с помощью формулы.
-
Данные опыта занесли в таблицу.
3) Таблица экспериментальных и расчётных данных
|
№ пробирки |
Количество капель |
Общий объём р-ра |
Концентрация р-ра Na2S2O3 |
Время течения реакции
|
Скорость реакции
|
||
|
p-ра Na2S2O3 |
H2O |
p-ра H2SO4 |
|||||
|
1 2 3 |
4 8 12 |
8 4 - |
1 1 1 |
13 13 13 |
C 2C 3C |
32 24 10 |
0.03 0.04 0.10 |
4) По полученным данным строим график зависимости скорости (V у.е.) от концентрации (С).
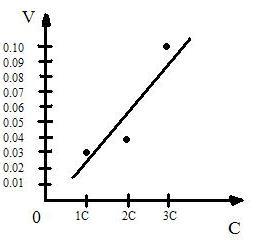
5) Вывод по опыту №1: С ростом концентрации реагирующих веществ, скорость реакции увеличивается.
2. Опыт № 2.
1) Влияние температуры на скорость химической реакции.
Влияние температуры на скорость изучаем на реакции взаимодействия тиосульфата натрия и серной кислоты:
Na2S2O3+H2SO4+S02+S+H20
2) Порядок выполнения опыта:
-
В трёх пробирках приготовили р-р Na2S203 одинаковой концентрации путём добавления в каждую 4-х капель р-ра Na2S203 и 8 капель H2O.
-
Разбавляя проточную воду кипятком до тех пор пока температура воды поднимется до 41°С, для измерения температуры воды, пользуемся термометром.
-
Помешаем в стакан с нагретой водой пробирку № 3, даём раствору прогреться, и не вынимая пробирку из стакана , определяем время с момента добавления капли кислоты до помутнения р-ра.
-
Повторяем опыт с пробирками № 2 и № 1 при температурах раствора 30°С и 20°С соответственно.
-
Данные полученные в ходе опыта записываем в таблицу.
|
№ пробирки |
Температура опыта t ° С |
Время
течения реакции
|
Скорость реакции
|
|
1 2 3 |
20 30 40 |
32 18 13 |
0,03 0,06 0,08 |
4) По полученным данным строим график зависимости скорости (V у.е.) от температуры (t°С).

5) Вывод по опыту №2: Опыт показал с ростом температуры реагирующих веществ, скорость реакции увеличивается.
6) Вычислим температурный коэффициент реакции по правилу Вант- Гоффа.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:

![]()

-
Общий вывод: Выполняя лабораторную работу по химии на тему «Скорость химических реакций», я научился экспериментально определять скорость химических реакций и оценивать влияние различных факторов на характер их протекания.
Экспериментально я убедился в том, что скорость протекания химических реакций во многом зависит от концентрации и температуры р-ра. Результаты проведённых опытов можно оценить по графикам, выводам и таблицам, приведённых в работе. Для того что бы получить данные результаты я пользовался Законом Действующих масс и Правилом Вант-Гоффа.
По полученным результатам опыта № 2, с
помощью уравнения Вант-Гоффа, я вычислил
температурный коэффициент равный 1,7.
Теоретический температурный коэффициент
(2![]() 4),
полученный мной коэффициент равный 1,7
не входит в данный промежуток. Причины
несовпадения теоретического и
практического коэффициента: 1) Не
соответствие теоретической и практической
концентрации вещества. 2) Неточная
фиксация временных промежутков, при
проведении опыта. 3) Не соответствие
практической и теоретической температуры
р-ра.
4),
полученный мной коэффициент равный 1,7
не входит в данный промежуток. Причины
несовпадения теоретического и
практического коэффициента: 1) Не
соответствие теоретической и практической
концентрации вещества. 2) Неточная
фиксация временных промежутков, при
проведении опыта. 3) Не соответствие
практической и теоретической температуры
р-ра.
