
- •Химия окружающей среды
- •Химия окружающей среды
- •Оглавление
- •Введение
- •I. Химия атмосферы
- •Лабораторная работа № 1
- •Определение содержания азота и кислорода в атмосферном воздухе
- •Методом газовой хроматографии
- •Состав атмосферы вблизи земной поверхности
- •Порядок выполнения работы
- •Требования к отчету
- •Лабораторная работа № 2 Определение содержания углекислого газа в атмосферном воздухе и в воздухе помещения
- •Порядок выполнения работы:
- •Требования к отчету
- •Лабораторная работа № 3 Определение концентрации аммиака в воздухе помещения
- •Порядок выполнения работы
- •Требования к отчету
- •Вопросы для самоподготовки
- •II. Химия гидросферы Лабораторная работа № 4 Определение рН, кислотности и щелочности воды
- •Порядок выполнения работы
- •Требования к отчету
- •Лабораторная работа № 5 Определение сухого и прокаленного остатков и жесткости воды
- •Порядок выполнения работы
- •Требования к отчету
- •Лабораторная работа № 6 Определение содержания анионов в поверхностных водах
- •Порядок выполнения работы
- •Требования к отчету
- •Лабораторная работа № 7 Определение окисляемости природных вод
- •Порядок выполнения работы
- •Требования к отчету
- •Вопросы для самоподготовки
- •III. Химия литосферы Лабораторная работа № 8 Катионообменная способность почв
- •Порядок выполнения работы
- •Требования к отчету
- •Лабораторная работа № 9 Определение содержания в почве подвижного алюминия
- •Порядок выполнения работы
- •Требования к отчету
- •Лабораторная работа№ 10 Определение содержания гумусовых веществ в почве
- •Порядок выполнения работы
- •Требования к отчету
- •Лабораторная работа № 11 Определение нитрифицирующей способности почвы
- •Порядок выполнения работы
- •Требования к отчету
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •IV. Миграции элементов и соединений в биосфере Лабораторная работа № 13 Исследование фотосинтезирующей деятельности высших растений
- •Последовательные стадии фотосинтеза
- •Порядок выполнения работы
- •Требования к отчету
- •Лабораторная работа 14 Изучение влияния токсичных соединений на фотосинтез водорослей
- •Порядок выполнения работы
- •Требования к отчету
- •Вопросы для самоподготовки
- •Лабораторная работа № 15 Определение содержания нитратов в растительных объектах
- •Порядок выполнения работы
- •Требования к отчету
- •Основные величины и единицы измерения ионизирующего излучения
- •Порядок выполнения работы
- •Требования к отчету
- •Вопросы для самоподготовки
- •Лабораторная работа № 17 Уменьшение содержания хлорофилла в листьях растений – биоиндикационный признак неблагоприятных условий среды
- •Порядок выполнения работы
- •Требования к отчету
- •Результаты анализа
- •Вопросы для самоподготовки
- •Критерии оценки загрязненности поверхностных вод
- •Характеристика индикаторов
- •Важнейшие индикаторы
- •Распределение нитратов в растениях, мг/кг сырой массы
- •Величины хпк, бпк5 и рН в водоемах с различной степенью загрязненности
- •Накопление радионуклидов в биологических объектах
- •Основные термины и определения
- •Библиографический список
- •Химия окружающей среды
- •280201 – Охрана окружающей среды и рациональное
- •308012, Г. Белгород, ул. Костюкова, 46
Порядок выполнения работы
Набрать в шприц воздух и под давлением ввести через иглу в емкость с поглотительным раствором. Воздух пропускать до изменения окраски раствора. Определить объем воздуха, израсходованного на изменение окраски поглотительного раствора, зная число ходов поршня и заполняемый воздухом объем шприца. Расчет произвести по формуле:
СNH3
=
![]() ,
,
где СNH3 – концентрация аммиака, мг/м3; 1020 – масса аммиак, мг в 1 дм3 раствора; V1− объем поглотительного раствора, см3; V2 – объем анализируемого воздуха, см3.
Требования к отчету
В отчете приводят результаты расчетов содержания аммиака воздухе помещения. Обосновывают полученные данные.
Вопросы для самоподготовки
1.Строение атмосферы. Химический состав различных слоев атмосферы.
2.Понятие о фотохимических реакциях. Законы фотохимии.
3.Характеристика солнечного излучения.
4.Основные типы физико-химических процессов в ионосфере.
5. Озоновый слой планеты. Атмосферные реакции с участием озона.
6.Свободные радикалы в тропосфере и стратосфере. Превращения гидроксидного и гидропероксидного радикалов.
7.Реакции метана и его гомологов в атмосфере. Превращения алкенов.
8.Образование и превращения пероксиацетилнитрата (ПАН).
9. Превращения бензола и его производных в атмосфере.
10. Пути образования и превращения альдегидов и кетонов.
11. Реакции оксидов азота.
12. Фотохимический смог, продукты. Условия возникновения.
13. Аэрозоли, их классификация, источники образования и пути вывода.
14. Конденсация паров воды в атмосфере. Облачность. Дожди.
15. Фреоны в атмосфере. Пути поступления и превращения.
16. Кислотные дожди. Пути образования, состав дождей.
II. Химия гидросферы Лабораторная работа № 4 Определение рН, кислотности и щелочности воды
Одним из показателей качества воды, позволяющих судить о химических и биологических процессах протекающих в ней, является значение рН. В природных водах, являющихся сложными растворами, концентрация ионов водорода зависит не только от диссоциации и гидролиза молекул воды, диссоциации и гидролиза солей, но и от содержания диоксида углерода и его производных, содержания гумусовых кислот и др.
Основной системой, регулирующей содержание ионов водорода в природных водоемах, является так называемая карбонатная система. Углекислый газ, растворяясь в воде, частично превращается в угольную кислоту, способную диссоциировать по уравнению:
Н2СО3НСО3-+Н+
Содержание ионов водорода определяется из соотношения:
 ,
,
где К1–первая константа диссоциации, равна 4.10-7.
Существенное влияние на содержание ионов водорода оказывает имеющиеся в воде гидрокарбонаты Са(НСО3) и Мg(НСО3)2, которые в результате диссоциация увеличивают содержание в воде ионов НСО3-и уменьшают содержание Н+.
Ионы НСО3- также диссоциируют с образованием протонов:
НСО3-![]() Н++ СО32-
Н++ СО32-
Условиям равновесия обычно отвечают следующие переходы:
СО2
+ Н2О![]() Н+ + НСО3-
Н+ + НСО3-![]() 2Н+ + СО32-
2Н+ + СО32-
Из уравнения видно, что различное значение рН воды указывает на различное содержание в воде различных составляющих данного уравнения.
При нормальных условиях рН природных вод близко к значению 8,5. При этом значении распространен гидрокарбонатион НСО3-. В этой форме углерод легко усваивается водными организмами. Содержание ионов водорода в природных водах может меняться в довольно широких пределах (рН = 4...9). Количественное соотношение между различными соединениями углекислоты определяется уравнениями диссоциации I и II ступени, которые зависят от концентрации ионов водорода, поэтому существование различных форм углекислоты в растворе определяется рН. При рН до 3,7-4,0 вся находящаяся в воде углекислота представлена только диоксидом углерода. По мере повышения рН доля СО2уменьшается, а следовательно, возрастает доля гидрокарбонатов– НСО3-. При рН = 8,3-8,4 практически вся углекислота находится в виде гидрокарбонта (98%), а на долю СО2+ СО32-приходится менее 2%. При дальнейшем повышении рН свободного СО2в воде нет, а только НСО3-и СО32-. При рН = 12 в растворе находятся только карбонаты. Зависимость содержания различных соединений углерода от рН приведена на рис. 2.
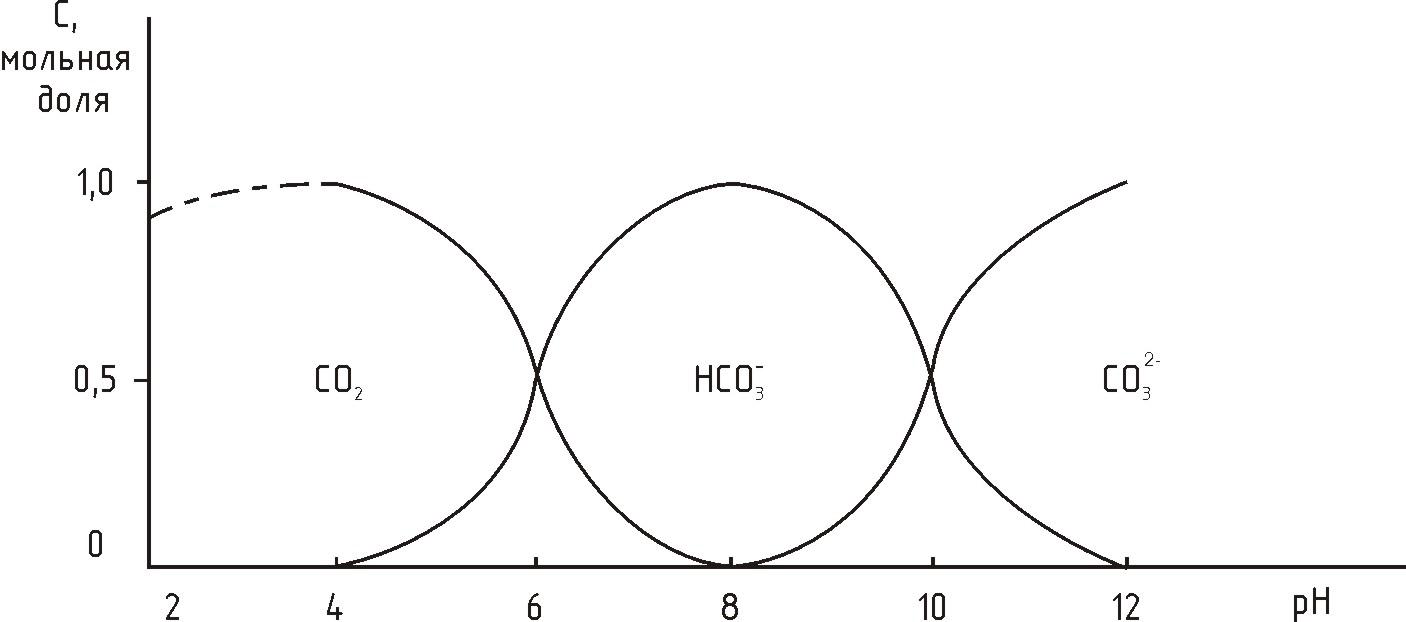
Рис. 2. Содержание различных форм углерода в зависимости от величины рН
Защелачивание водоемов свидетельствует об интенсивном процессе фотосинтеза. Закисление говорит о наличии гумусовых кислот. Изменение рН может быть вызвано гидролизом солей тяжелых металлов, поступлением кислых или щелочных стоков и другими причинами.
Карбонатная система обладает буферными свойствами и способна поддерживать определенное значение рН и нейтрализовать поступление кислых или щелочных стоков. К основным характеристикам природных вод относят их кислотность и щелочность. Под кислотностью понимают содержание в воде веществ, способных вступить в реакцию с сильными щелочами. К этим веществам можно отнести:
а) сильные кислоты, полностью диссоциирующие в воде;
б) слабые кислоты (уксусная, сернистая, угольная и др.);
в) катионы слабых оснований (ионы аммония, железа, органических оснований и др.).
Соединения, содержащие эти катионы, гидролизуются с образованием ионов водорода. При аналитическом определении кислотности вода различают общую и свободную кислотность. Свободная кислотность – это кислотность, которую обнаруживают при титровании щелочью до рН = 4,5.
Общая кислотность определяется суммарным количеством щелочи (мг-экв/л), пошедшей на титрование до щелочной среды (до рН ~ 8,3), Полагают, что в этом случае будут нейтрализованы все вещества, обусловливающие кислотность.
Щелочность воды обусловлена наличием растворимых оснований, средними и кислыми солями, обычно гидрокарбонатами щелочных и щелочноземельных металлов. Определяется щелочность воды титрованием сильными кислотами. Различают свободную и общую щелочность.
Если рН воды > 8,3, то количество кислоты (мг-экв/л) необходимое для снижения рН до 8,3, будет характеризовать свободную щелочность.
При дальнейшем титровании до рН = 4,5 определяют суммарное количество кислоты, которое характеризует общую щелочность воды.
Цель работы:научиться определять рН воды, кислотность и щелочность природных вод различными методами, анализировать причины, влияющие на данные свойства вод.
Оборудование и реактивы:иономер универсальный ЭВ-74; стеклянный и хлорсеребряный электроды; фенолфталеин, 1%-ный спиртовой раствор; метиловый оранжевый, 1%-ный спиртовой раствор; едкий натр (или калий), 0,1 н. раствор; серная кислота, 0,1 н. раствор.
