
Методические указания к ЛР по молекулярной физике и термодинамике
.pdf
где k=1,38×10-23 Дж/К − постоянная Больцмана. Для воздуха
s = 3,3 × 10 |
−25 |
T |
|
(20) |
|
h . |
|||
|
|
|||
Измеряя температуру воздуха термометром и атмосферное давление барометром, вычисляем  l
l и s по формулам (17) и (20). Диаметр молекул воздуха оцениваем по формуле
и s по формулам (17) и (20). Диаметр молекул воздуха оцениваем по формуле
d = |
s |
(21) |
p |
||
|
|
и сравниваем с табличным значением для молекул N2 и O2: d=3×10-10м. Результаты измерений и расчетов записать в протокол испытаний.
ПРОТОКОЛ ИСПЫТАНИЙ
Dh, |
V, |
t, |
h, |
p, |
T, |
l , |
s, |
d, |
м |
м3 |
c |
Па×с |
Па |
K |
м |
м2 |
м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Назовите основные задачи работы. Какие законы применяются для решения этих задач?
2.Приведите вывод закона Пуазейля, проанализируйте закон.
3.Опишите экспериментальную установку. Из каких основных частей она состоит и для чего предназначен каждый элемент установки?
4.Какой газ называется идеальным? Опишите модель идеального газа.
5.Что такое средняя квадратичная скорость молекул?
6.Запишите и проанализируйте основной закон молекулярно-кинетической теории идеального газа.
11
7.Какие явления называются явлениями переноса? Какие явления переноса Вы знаете?
8.Что такое вязкость? Запишите и поясните закон Ньютона для вязкого трения.
9.Каков механизм вязкости с точки зрения молекулярно-кинетической теории?
10.Как зависит динамическая вязкость газов от температуры?
11.Дайте определение динамической вязкости и установите её размерность в единицах СИ.
12.Что называется средней длиной свободного пробега молекул идеального газа? Как она связана с динамической вязкостью?
13.Как можно оценить среднюю длину свободного пробега молекул в опыте?
14.Выведите связь средней длины свободного пробега молекул идеального газа и эффективного сечения столкновения молекул. Как связать эффективное сечение столкновения молекул с динамической вязкостью?
15.Сравните диаметр молекул «воздуха» с табличными значениями для молекул азота и кислорода. Проанализируйте результаты.
12
ЛАБОРАТОРНАЯ РАБОТА № 2.2
ИЗУЧЕНИЕ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ. ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ПУАССОНА ПО МЕТОДУ КЛЕМАНА-ДЕЗОРМА
ЦЕЛЬ РАБОТЫ
1.Изучение тепловых процессов в идеальном газе.
2.Экспериментальное определение коэффициента Пуассона.
ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ
1.Стеклянный баллон с воздухом.
2.Насос.
3.Водяной манометр.
4.Измерительная линейка.
ВВЕДЕНИЕ
Равновесное состояние термодинамической системы характеризуется совокупностью величин, называемых параметрами состояния. В простейших случаях параметрами состояния являются давление р, объем V и абсолютная температура Т.
Уравнение, устанавливающее связь между р, V, Т, называется уравнением состояния. В явном виде уравнение состояния известно только для некоторых систем. Например, уравнение состояния идеального газа имеет вид
pV = νRT . |
(1) |
Равновесным состоянием термодинамической системы называется такое состояние, которое не изменяется со временем и неизменность его параметров не обусловлена каким-либо внешним относительно данной системы процессом. Состояние равновесия не означает, что в термодинамической системе нет никакого движения. Например, в газе, который находится в состоянии термодинамического равновесия, молекулы интенсивно движутся. Равновесие термодинамической системы есть равновесие статистическое. Оно характеризуется тем, что мгновенные значения параметров состояния близки к средним, и тем, что статистическое равновесие является наиболее вероятным состоянием. На диаграмме состояния равновесное состояние изображается точкой.
13

Если состояние системы со временем изменяется, то это значит, что в системе происходит процесс. Различают нестатические и квазистатические (равновесные) процессы.
Всякий процесс есть нарушение состояния равновесия. Пусть идеальный газ находится в цилиндре с подвижным поршнем. Если быстро опустить поршень так, что за время t объем уменьшается на очень малую величину V, то плотность газа возрастает сначала вблизи поршня. Молекулы слоя газа, прилегающего к поршню, получат за счет совершенной работы над газом дополнительную энергию, и температура слоя повысится. Состояние равновесия газа окажется нарушенным. Через некоторое время молекулы снова равномерно распределятся по всему объему, а полученная молекулами дополнительная энергия распределится между всеми молекулами, и снова установится состояние равновесия.
Процесс перехода системы из неравновесного состояния в равновесное
называется релаксацией. Если скорость изменения объема V |
гораздо больше |
t
V
скорости восстановления равновесия ,
τ
V |
V |
, |
|
τ |
|||
t |
|
то процесс изменения объема будет нестатическим.
Если скорость изменения объема много меньше скорости восстановления равновесия,
V |
V |
, |
|
τ |
|||
t |
|
то изменением состояния системы в любой момент времени можно пренебречь, считая, что система последовательно переходит из одного состояния равновесия в другое, бесконечно близкое к нему. Такой процесс называется квазистатическим.
Подобные рассуждения можно провести относительно изменения других параметров состояния.
На диаграмме состояния квазистатический процесс изображается непрерывной линией. Рассмотрим квазистатические процессы. В основу классификации термодинамических процессов можно положить признак неизменности какого-нибудь из параметров состояния или величин, являющихся функциями параметров состояния. Процессы, когда тот или иной параметр остается неизменным в течение всего процесса, называются ИЗОПРОЦЕССАМИ.
Процесс, происходящий при постоянном давлении p=const, называется ИЗОБАРНЫМ, при постоянном объеме V=const − ИЗОХОРНЫМ, при постоянной
14

температуре Т=const − ИЗОТЕРМИЧЕСКИМ. Если процесс протекает без теплообмена, то его называют АДИАБАТНЫМ. При квазистатическом адиабатном процессе сохраняется энтропия системы S=const, поэтому адиабатный процесс называют иначе ИЗОЭНТРОПИЙНЫМ.
Для идеального газа соответствующие процессы описываются уравнениями: Гей-Люссака
V |
|
= const ; |
|
|
||||
T m , p |
|
(2) |
||||||
Шарля |
|
|
|
|
|
|||
|
|
|
|
|
||||
p |
|
|
= const ; |
|
|
|||
|
|
|
|
|
|
(3) |
||
|
|
|
||||||
T |
m ,V |
|
|
|
||||
Бойля-Мариотта |
|
|
|
|
|
|||
( pV )m ,T = const ; |
(4) |
|||||||
|
||||||||
Пуассона |
|
|
|
|
|
|||
(pV |
γ |
)m ,S = const |
, |
(5) |
||||
|
||||||||
|
|
|||||||
где γ − коэффициент Пуассона, равный отношению изобарной и изохорной теплоемкостей идеального газа,
γ = |
cμp |
. |
(6) |
cμV
Остановимся на адиабатном процессе. Применим к адиабатному процессу первое начало термодинамики:
δQ = dE + δA. |
(7) |
Так как δQ = TdS = 0 при S = const, то |
|
dE = − δA. |
(8) |
Внутренняя энергия Е системы при адиабатном процессе изменяется за счет работы.
Для идеального газа внутренняя энергия зависит только от температуры:
E = νcμV T , |
(9) |
|||
поэтому согласно (8) можно записать уравнение |
|
|||
νcμV dT = − pdV . |
|
|||
dT = − |
|
p |
|
|
|
|
dV . |
(10) |
|
|
|
|||
|
νcμV |
|
||
При адиабатном расширении dV > 0 идеальный газ охлаждается dТ < 0, а при сжатии dV < 0 − нагревается dТ > 0.
15
Если в (10) подставить |
p = |
νRT |
и учесть соотношение |
Майера |
||||
|
|
|||||||
R = cμp − cμV , то получим |
|
|
|
V |
|
|||
|
|
|
|
|
|
|||
|
dT |
+ (γ − 1) |
dV |
= 0 . |
(11) |
|||
|
|
|
||||||
|
T |
|
V |
|
||||
Проинтегрировав, найдем уравнение Пуассона в параметрах Т, V: |
|
|||||||
|
TV γ −1 = const . |
(12) |
||||||
Заменяя в (12) Т~pV по формуле (1), можно получить уравнение Пуассона в параметрах p, V (5).
ОПИСАНИЕ УСТАНОВКИ И ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ПУАССОНА
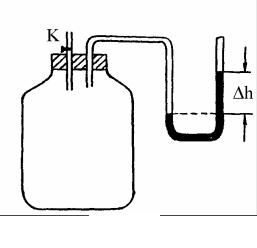
Коэффициент Пуассона можно измерить с помощью прибора Клемана−Дезорма (рис. 1), состоящего из стеклянного баллона с воздухом, насоса
Рис. 1
и водяного манометра. В баллон накачивается с помощью насоса воздух. При этом давление воздуха в баллоне повысится и станет равным
где p1 = ρ g |
h1 – |
p1 = p0 + p1 , |
(13) |
превышение давления воздуха в баллоне над атмосферным |
|||
давлением p0 . |
h1 |
− разность уровней воды в коленах манометра (рис. 1). |
|
Открывают на короткое время кран К, чтобы давление в баллоне сравнялось с атмосферным p2 = p0 , после чего закрывают кран.
16
Процесс расширения кратковременный, заметного теплообмена между воздухом в баллоне и окружающей средой не происходит, поэтому процесс можно считать адиабатным. После адиабатного расширения температура воздуха в баллоне понизится и станет меньше температуры окружающей среды. В результате теплообмена через некоторый промежуток времени температура воздуха в баллоне сравняется с комнатной. На этом этапе имеет место изохорный процесс нагревания. При этом давление в баллоне возрастает, достигая значения
p3 = p0 + p2 , |
(14) |
где p2 = ρ g h2 − превышение давления в баллоне над атмосферным p0 после |
|
изохорного нагрева. h2 − разность уровней воды в коленах манометра. Представим на диаграмме состояний в параметрах p, V вышеуказанные
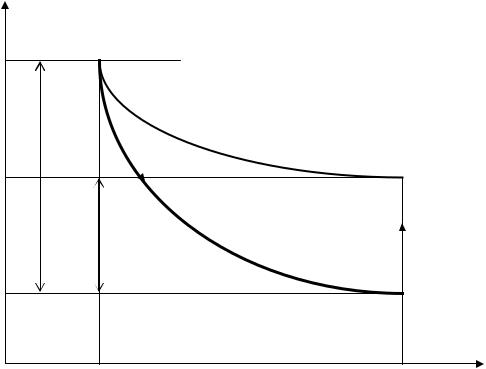
процессы (рис. 2). До открытия крана в баллоне находился сжатый воздух объемом V1 при комнатной температуре Т0 и давлении p1 = p0 + p1 .
p |
(p1, V1, T0) |
p1 1
p3 |
h1 |
(p3, V2, T0) |
|
|
|
3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
h2 |
|
|
|
p0 |
|
2 |
|
|
|
|
|
|
|
|
|
(p0, V2, T2) |
|
|
0 |
V1 |
V2 |
V |
|
|
|
Рис. 2 |
|
|
Это состояние соответствует т.1. После того как открыли кран К, воздух адиабатно расширяется до объема V2 и охлаждается до температуры Т2. При этом давление понижается до атмосферного p2 = p0. Это состояние изображается т.2. Состояния 1 и 2 связаны уравнением Пуассона
17
p1V1γ = p2V2γ . |
(15) |
После закрытия крана К начинается изохорный процесс нагревания воздуха. По окончании теплообмена в баллоне установится комнатная температура Т0 при давлении p0 > p3. Это состояние изображается т.3 на диаграмме состояний. Состояния 1 и 3 соответствуют одной и той же температуре Т0, поэтому т.1 и т.3 должны принадлежать одной изотерме, а параметры этих состояний связаны уравнением (4):
|
|
|
p1V1 = p3V2 . |
|
||||||
Из (15) и (16), исключая отношение V2/V1 , получим |
||||||||||
|
|
|
pγ |
= p |
pγ −1 . |
|
||||
Учтём (13) и (14): |
|
|
3 |
0 |
1 |
|
|
|
||
|
|
|
γ |
|
|
|
γ −1 |
|
||
|
|
|
p2 |
|
|
p1 |
|
|||
|
1 |
+ |
|
= 1 + |
|
. |
||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p0 |
|
|
p0 |
|
|||
В нашем эксперименте |
|
|
|
|
||||
поэтому можно записать |
p2 p0 , |
p1 p0 , |
||||||
|
|
|
|
|
|
|
||
1 + γ |
p2 |
= 1 + (γ − 1) |
p1 |
. |
||||
|
|
|||||||
|
p0 |
|
|
p |
||||
Откуда находим |
|
|
|
0 |
|
|||
|
|
|
|
|
|
|
||
|
γ = |
|
p1 |
|
||||
или, учитывая, что |
p1 |
− p2 |
||||||
|
|
|||||||
p1 = ρ g h1 , |
p2 = ρ g h2 , |
|||||||
получим |
|
|
|
|
|
|
|
|
(16)
(17)
(18)
γ = |
|
h1 |
. |
(19) |
|
h1 |
− h2 |
||||
|
|
|
|||
Экспериментальное определение коэффициента Пуассона сводится к |
|||||
измерению разности уровней манометра |
h1 и |
h2. |
|||
18

ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. В баллон с помощью насоса накачивают немного воздуха. При накачивании воздух, сжимаемый поршнем насоса, нагревается. Необходимо выждать некоторое время, чтобы воздух в баллоне снова принял температуру окружающей среды. После этого измеряют разность уровней воды в коленах манометра h1 (мм).
2. Открывают кран К. К моменту времени, когда уровни жидкости в коленах манометра сравняются, кран закрывают. Выждав 2-3 минуты, чтобы газ, охлажденный при адиабатном расширении, нагрелся до комнатной температуры, измеряют разность уровней воды в коленах манометра h2.
3.По формуле (19) вычисляют значение коэффициента Пуассона γэ.
4.Измерения повторяют 5-7 раз.
5.Находят среднее значение коэффициента Пуассона <γэ>.
6.Выражают коэффициент Пуассона для идеального газа через число
степеней свободы. Находят теоретическое значение коэффициента Пуассона γт, считая воздух мономолекулярным двухатомным газом.
7. Вычисляют расхождение между экспериментальным и теоретическим
значениями коэффициента Пуассона ε = γ т − γ э 100%.
γ т
ПРОТОКОЛ ИСПЫТАНИЙ
№ |
h1, |
h2, |
γэ |
<γэ> |
γт |
ε, |
|
мм |
мм |
|
|
|
% |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
19
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Назовите основные задачи работы. Какие законы применяются для решения этих задач?
2.Выведите расчетную формулу для коэффициента Пуассона методом Клемана-Дезорма.
3.Опишите экспериментальную установку. Из каких основных частей она состоит и для чего предназначен каждый элемент установки?
4.Что такое термодинамическая система? Какие системы называются изолированными? Приведите примеры.
5.Какие термодинамические параметры являются функциями состояния, а какие являются функциями процесса?
6.Какие состояния называются равновесными? Какие процессы называются равновесными?
7.Что такое уравнение состояния? Запишите и проанализируйте уравнение состояния идеального газа.
8.Какие процессы являются изотермическими, изобарическими, изохорическими? Запишите и поясните законы, которым подчиняются приведенные изопроцессы.
9.Что такое релаксация? От чего зависит время релаксации?
10.Выведите уравнение Пуассона.
20
