
- •Молекулярная физика и термодинамика
- •Методические указания к выполнению
- •Рассчетно-графического задания
- •По физике №2
- •Программа курса "Молекулярная физика и термодинамика"
- •I. Уравнение состояния идеального газа процессы идеального газа
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •II. Основы молекулярно-кинетической теории
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •III. Первый закон термодинамики
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •IV. Второй закон термодинамики
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Библиографический список
IV. Второй закон термодинамики
1. Коэффициент полезного действия (КПД) тепловой машины
![]() ,
,
где A– работа, совершенная тепловой машиной за цикл;
Qн– количество теплоты, полученное от нагревателя за цикл;
Qх– количество теплоты, переданное холодильнику за цикл.
2. КПД идеальной тепловой машины, работающей по циклу Карно
![]() ,
,
где Tх– температура холодильника;Tн– температура нагревателя.
3. Бесконечно малое изменение
энтропии термодинамической системы ![]() .
.
Изменение энтропии при переходе
системы из состояния 1 в состояние 2:
![]() .
.
4. Энтропия одного моля идеального газа (определяется с точностью до аддитивной постоянной):
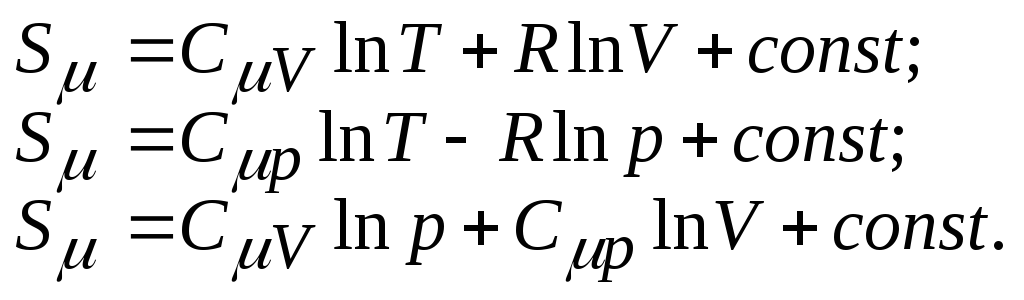
5. Изменение энтропии одного моля идеального газа при переходе системы из состояния 1 в состояние 2:

6. Аддитивность энтропии:
![]() .
.
7. Связь между энтропией и
статистическим весом (формула
Больцмана): ![]() ,
,
где Ω– статистический вес.
Примеры решения задач
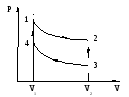
Задача 1.Цикл состоит из двух изохор и двух адиабат. Отношение наибольшего объема газа к наименьшему в цикле равно 8. Рабочим веществом является одноатомный идеальный газ. Определить КПД цикла.
Д ано: Решение:
ано: Решение:
![]()
i = 3
![]()

КПД тепловой машины определяется отношением работы за цикл к количеству теплоты, получаемому рабочим телом за цикл:
![]() .
.
Применим первый закон термодинамики для адиабатных процессов. С учетом выражения для изменения внутренней энергии и определения адиабатного процесса получаем
![]() ,
,
![]() .
.
В данном цикле работа равна
алгебраической сумме работ, выполняемых
системой в двух адиабатных процессах
![]()
![]() .
В изохорных процессах 2-3 и 4-1 работа не
совершается.
.
В изохорных процессах 2-3 и 4-1 работа не
совершается.
Для процесса 4-1 применим уравнение изохорного процесса:
![]() .
.
Так как р1> р4, тоT1>T4. Газ получает количество теплоты от нагревателя. Это количество теплоты, согласно первому закону термодинамики, равно
![]() .
.
Для КПД цикла получаем
![]() .
.
Применим уравнение Пуассона для процессов 3-4 и 1-2. Применим уравнение изохорного процесса для процессов 4-1 и 2-3. Получим систему из четырех уравнений:

![]() ,
,![]() .
.
Решая систему уравнений, получаем
![]() .
.
Таким образом, КПД цикла
![]() .
.
Применим уравнение Пуассона в параметрах ТVдля процесса 1-2:
![]()
Окончательное выражение для КПД цикла:
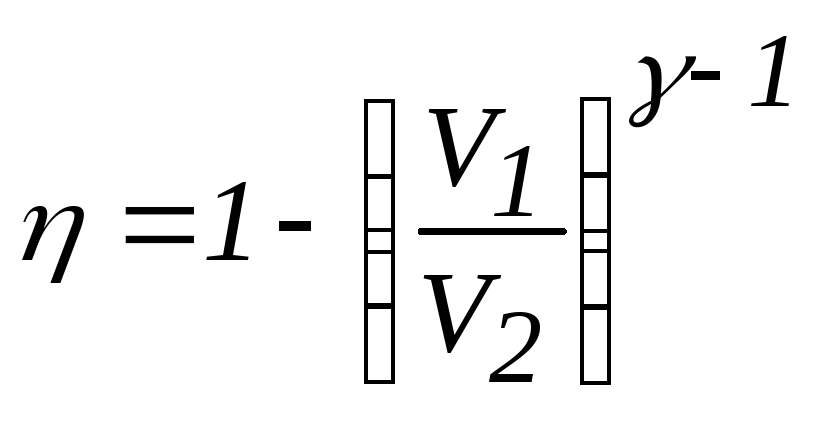 .
.
Правая часть уравнения является безразмерной.
Учитывая, что для одноатомного идеального газа i = 3, γ = 5/3, производим вычисления:
![]() .
.
Ответ: 0,75 (75 %).
Задача 2. Азот совершает цикл Карно. Определить КПД цикла, если при адиабатном расширении объем газа увеличивается в 3 раза.
Д ано: Решение:
ано: Решение:
![]() КПД цикла Карно
КПД цикла Карно![]() .
.
i = 5ОпределимTх/Tн, воспользовавшись уравнением
![]()
 Пуассона
Пуассона![]() для
процесса адиабатного
для
процесса адиабатного
расширения газа:
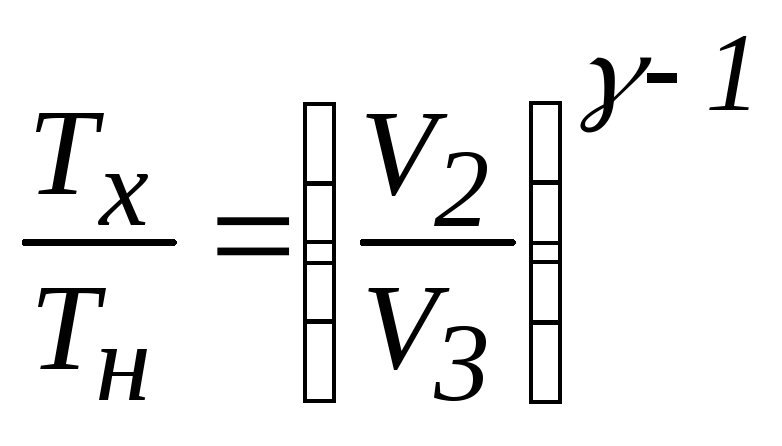 .
.
Для КПД цикла Карно получаем
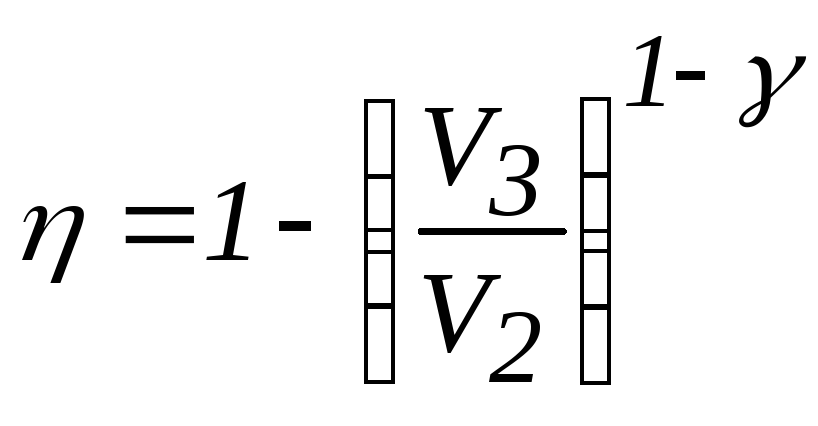 .
.
Правая часть выражения является безразмерной.
Учитывая, что для азота
![]() ,
производим вычисления:
,
производим вычисления:
![]() .
.
Ответ: 0,36 (36 %).
Задача 3.Идеальный газ с коэффициентом Пуассона γ=5/3 совершает процесс, в котором давление изменяется по законуp=p0–αV, где р0=0,1 МПа, α=50 кПа/м3. При каком значении объема энтропия газа будет максимальной?
Д ано:
Решение:
ано:
Решение:
![]() Энтропия
идеального газа
Энтропия
идеального газа
ро=0,1 МПа=105Па![]() . (1)
. (1)
α =50 кПа/м3=5·104 Па Используя уравнения состояния
 идеального
газа и уравнение про-
идеального
газа и уравнение про-
![]() цесса,
получим зависимостьT(V):
цесса,
получим зависимостьT(V):
![]() . (2)
. (2)
Подставив (2) в (1), получим зависимость энтропии газа от объема:
![]() .
.
Объем V0, соответствующий максимуму энтропии, найдем из условий
![]()
Этот объем ![]() .
.
Проверка размерности: ![]() .
.
Вычисления:
![]() .
.
Ответ: 1,25 м3.
Задача 4.Во сколько раз следует изотермически увеличить объем идеального газа в количестве 3 моль, чтобы его энтропия увеличилась на 25 Дж/К?
Д ано: Решение:
ано: Решение:
ν = 3 мольДля обратимого
процесса![]() ,
,
∆S = 25
Дж/Кгде![]() .
.
![]()
 Так
как процесс изотермический, то для
идеального газа
Так
как процесс изотермический, то для
идеального газа![]() ,
а элементарная работа равна
,
а элементарная работа равна
![]() .
.
Изменение энтропии
![]() для изотермического процесса будет
равно
для изотермического процесса будет
равно
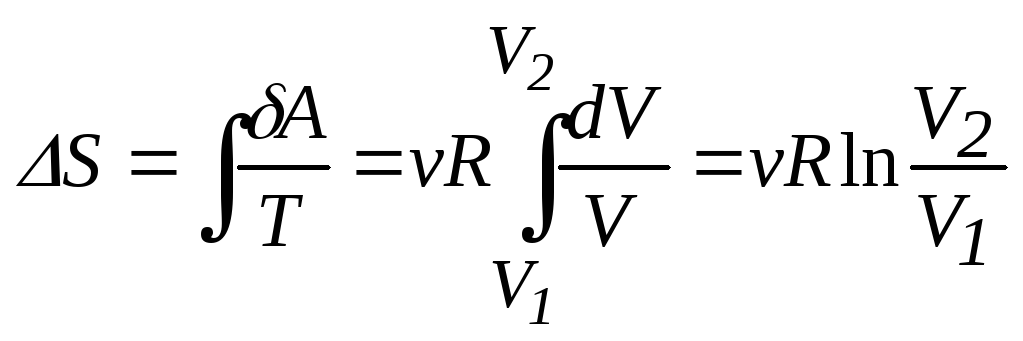 .
.
Из последнего соотношения находим
![]() .
.
Показатель экспоненты – величина безразмерная.
Вычисления:
![]() .
.
Ответ:
![]() .
.
