
- •Молекулярная физика и термодинамика
- •Методические указания к выполнению
- •Рассчетно-графического задания
- •По физике №2
- •Программа курса "Молекулярная физика и термодинамика"
- •I. Уравнение состояния идеального газа процессы идеального газа
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •II. Основы молекулярно-кинетической теории
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •III. Первый закон термодинамики
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •IV. Второй закон термодинамики
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Библиографический список
III. Первый закон термодинамики
1. Первый закон термодинамики:
![]() ,
,
где δQ– элементарное количество теплоты, сообщенное термодинамической системе;
dU– бесконечно малое изменение внутренней энергии термодинамической системы;
δA– элементарная работа, совершенная термодинамической системой.
2. Количество теплоты, полученное или отданное системой в процессе,
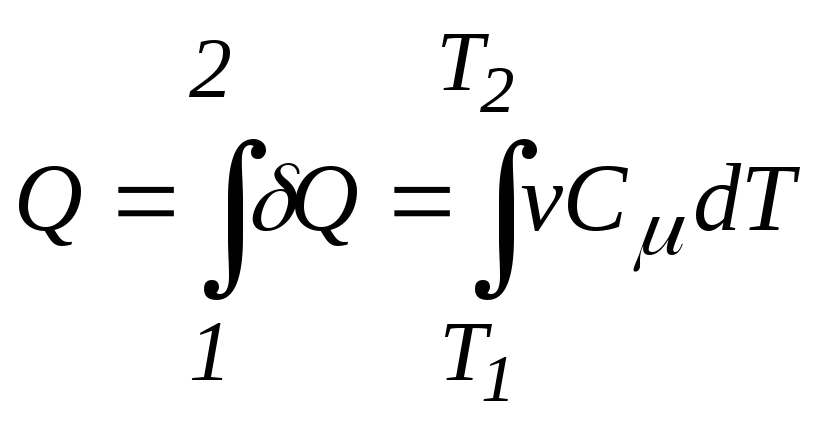 ,
,
где T1иT2– температуры начального и конечного состояния газа;
v– количество
молей газа;![]() – молярная теплоемкость газа в процессе.
– молярная теплоемкость газа в процессе.
3. Внутренняя энергия идеального газа
![]() .
.
Изменение внутренней энергии идеального газа в процессе:
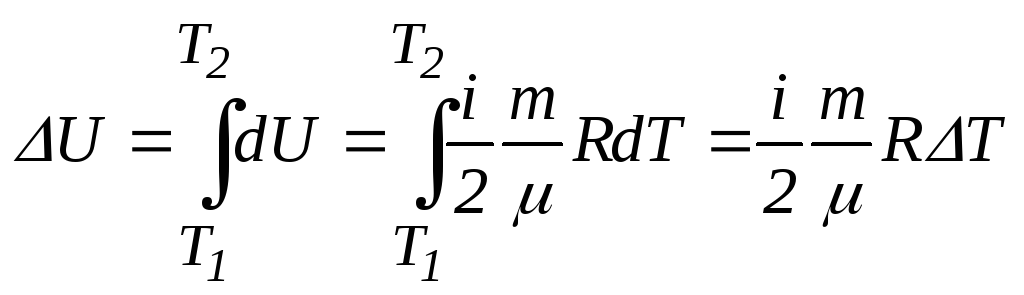 .
.
4. Элементарная работа газа (работа газа при равновесном, бесконечно малом изменении объема)
![]() .
.
Работа газа в процессе
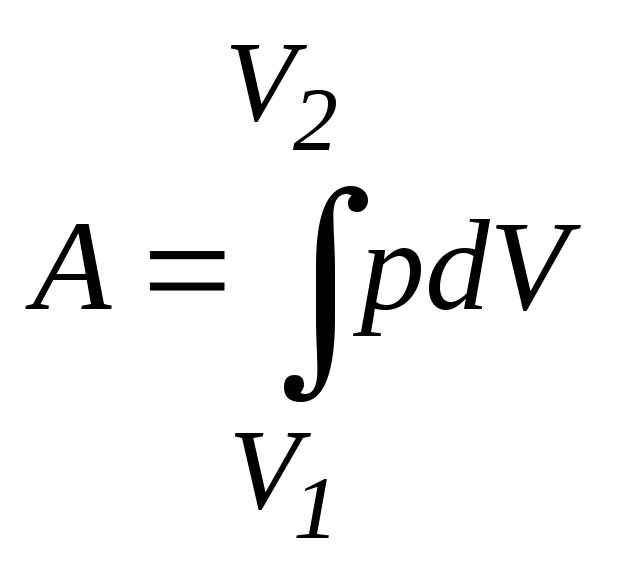 ,
,
где V1иV2– объемы начального и конечного состояния газа.
5. Теплоемкости идеального газа при постоянном объеме и постоянном давлении:
![]() ,
,![]() .
.
6. Соотношение Майера:
![]() .
.
7. Уравнение адиабатного (происходящего без теплообмена) процесса:
![]() ,
,
где
![]() – коэффициент Пуассона.
– коэффициент Пуассона.
8. Уравнение политропного (происходящего при постоянной теплоемкости) процесса:
![]() ,
,
где n– показатель политропы.
Примеры решения задач
Задача 1.Газообразный водород, находившийся при нормальных физических условиях в закрытом сосуде объемом 5,0 л, охладили на 55 К. Определить приращение внутренней энергии газа и количество отданного им тепла.
Дано: Решение:
р о=
105 ПаПервый закон
термодинамики:
о=
105 ПаПервый закон
термодинамики:
То= 273 К![]() . (1)
. (1)
Vo= 5,0·10-3 м3Для изохорного процесса работа газа
∆ Т
= – 55 К
Т
= – 55 К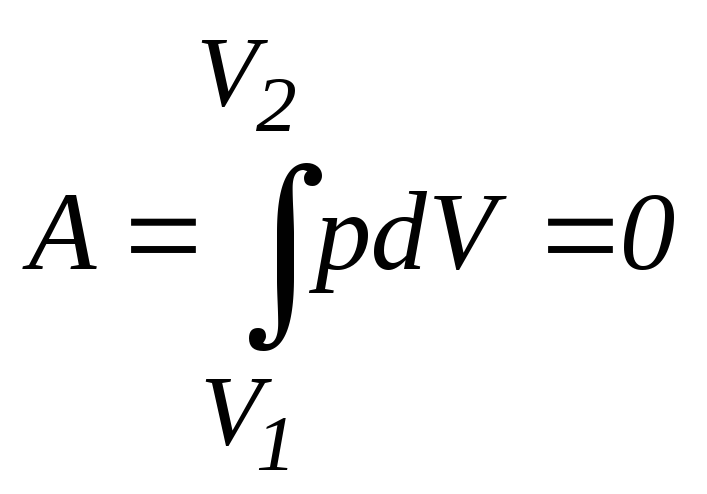 . (2)
. (2)
Q, ∆E – ?
Изменение внутренней энергии идеального газа
![]() . (3)
. (3)
Уравнение состояния идеального газа:
![]() . (4)
. (4)
Решая систему уравнений (1) – (4), получаем
![]() .
.
Для молекулярного водорода число степеней свободы молекулы i=5.
Проверка размерности:
![]() .
.
Вычисления:
![]() .
.
Ответ:
![]() .
.
Задача 2. Три моля идеального газа при температуре 300 К изотермически расширили в 4 раза, а затем изохорно нагрели так, что его давление стало равно первоначальному. За весь процесс газу сообщили количество теплоты 67 кДж. Определить коэффициент Пуассона для этого газа.
Д ано: Решение:
ано: Решение:
Т1= 300 КВ процессе изотермического расширения
![]() газа из состояния
газа из состояния
![]() в состояние
в состояние
Q= 6,7·104
Дж![]() к газу подводится теплота
к газу подводится теплота
![]()

![]() .
.
В процессе изохорного нагрева к газу подводится количество теплоты
![]()
Для нахождения T3воспользуемся уравнениями изохорного и изотермического процессов:
![]() ,
,![]() .
.
Для T3получим![]() .
.
Коэффициент Пуассона связан с числом степеней свободы молекулы
газа соотношением
![]() .
.
Из этого выражения следует,
что
![]() .
.
Для
![]() окончательно получаем
окончательно получаем
![]() .
.
При переходе газа из состояния Iв состояниеIIIзатрачивается количество теплоты
![]() .
(1)
.
(1)
Из (1) выразим коэффициент Пуассона
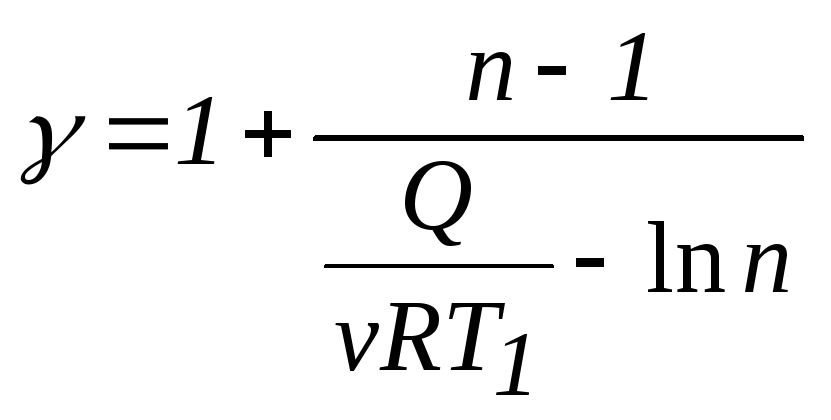 .
.
Убедимся, что соотношение
![]() является безразмерной величиной:
является безразмерной величиной:
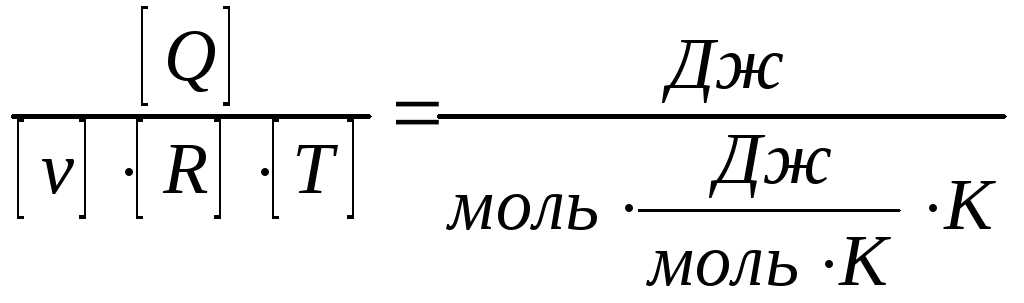 .
.
Вычисления:
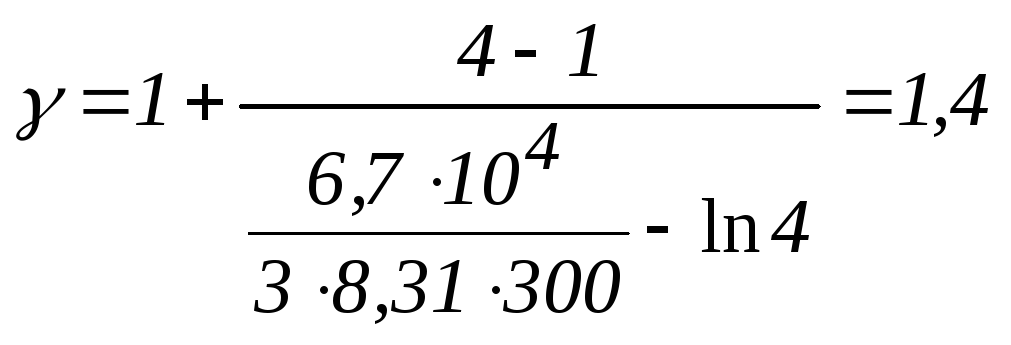 .
.
Ответ: 1,4.
Задача 3.Объем одного моля идеального газа с коэффициентом Пуассона γ = 5/3 изменяют по законуVT=a, где а – положительная константа. Определить количество теплоты, полученное газом в этом процессе, если его температура возросла на 60 К.
Д ано: Решение:
ано: Решение:
![]() Первый
закон термодинамики:
Первый
закон термодинамики:
ν = 1 моль![]() . (1)
. (1)
∆Т = 60 КБесконечно малое изменение внутренней энергии
![]()

![]() . (2)
. (2)
Элементарная работа ![]() . (3)
. (3)
Перепишем первый закон термодинамики, выразив изменения термодинамических функций через изменения термодинамических параметров, т.е. подставим уравнения (2) и (3) в уравнение (1):
![]() .
(4)
.
(4)
Выразим уравнение процесса в параметрах PиV. Для этого воспользуемся уравнением состояния газа и уравнением процесса, данным в условии задачи:
![]() .
.
Исключая температуру, получим
![]() . (5)
. (5)
Выразим число степеней свободы через коэффициент Пуассона:
![]() . (6)
. (6)
Подставляя уравнения (5) и (6) в уравнение (4) приходим к выражению
![]() .
(7)
.
(7)
Интегрируя (7), получаем
![]() .
.
Проверка размерности:
![]() .
.
Вычисления:
![]() .
.
Ответ: 0,25 кДж.
Задача 4.Определить молярную теплоемкость
идеального газа в политропном процессе![]() ,
еслиn= 3, а коэффициент
Пуассона этого газа γ = 5/3.
,
еслиn= 3, а коэффициент
Пуассона этого газа γ = 5/3.
Д ано: Решение:
ано: Решение:
n = 3Первый закон термодинамики:
γ = 5/3 
![]() . (1)
. (1)
![]() Выразив
изменения термодинамических функций
через изменения термодинамических
параметров,
Выразив
изменения термодинамических функций
через изменения термодинамических
параметров,
![]() ,
,![]() ,
,![]() ,
,
и подставив их в уравнение (1), получаем
![]() . (2)
. (2)
Выразив давление из уравнения процесса, данного в условии, и подставив в уравнение (2), получаем
![]() . (3)
. (3)
Определим производную
![]() .
Для этого воспользуемся уравнениями
политропического процесса и состояния
идеального газа и выразим уравнение
процесса в параметрахV
иT:
.
Для этого воспользуемся уравнениями
политропического процесса и состояния
идеального газа и выразим уравнение
процесса в параметрахV
иT:
![]() . (4)
. (4)
Дифференцируя (4), получаем
![]() и подставляем в (3):
и подставляем в (3):
![]() .
.
Проверка размерности:
![]() .
.
Предельные случаи:
1) при n = 0получаемр = const, т.е. теплоемкость дли изобарного процессаCμn = Cμp;
2) при n = γполучаемS = const, т.е. теплоемкость адиабатного процессаCμn = 0.
Вычисления:
![]() .
.
Ответ:
![]() .
.
