

|
|
|
æ |
¶S ö |
æ |
¶P ö |
|
|
æ |
¶U ö |
æ ¶P |
ö |
|
|
|
|||||||
dF=SdTPdVÞç |
|
÷ |
|
=ç |
|
÷ |
|
Þç |
¶V |
÷ |
=T ç |
|
÷ –P; |
|||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
è |
¶V øT |
è |
¶T øV |
|
è |
øT |
è ¶T |
øV |
|
|
|||||||||
|
|
æ |
¶P ö |
|
|
|
R |
|
|
|
|
a |
|
|
æ |
¶U ö |
|
|
a |
|
|
|
За ВдВ, Tç |
÷ |
=T |
|
|
|
=P+ |
|
|
; Þ ç |
÷ |
= |
|
|
|
|
Þ |
||||||
V - B |
V 2 |
|
V 2 |
|
||||||||||||||||||
|
|
è |
¶T øV |
|
|
|
|
|
è |
¶V øT |
|
|
|
|||||||||
|
a |
|
|
|
|
|
|
æ ¶U |
ö |
|
|
|
df |
|
|
|
|
a |
|
|
||
U= |
|
+f(T), але СV= |
ç |
¶T |
÷ |
|
= |
|
|
ÞU=CVT |
|
|
|
. |
||||||||
V |
|
|
dT |
V |
||||||||||||||||||
|
|
|
|
|
|
|
è |
øV |
|
|
|
|
|
|
||||||||
∞ |
- a2 |
|
a |
|
V∞ = |
− a |
|
|
DU= ò |
dV= |
|
; обумовлено роботою проти сил внутрішнього тиску. |
|||||
|
|
|||||||
V V |
V |
|
|
V |
|
|||
|
|
|
||||||
Ентропія газу В.д.В.
æ |
¶S ö |
æ |
¶S ö |
æ |
¶P ö |
|
C |
R |
|
C |
||
dS=ç |
|
÷ |
dV+ç |
|
÷ |
dT=ç |
÷ |
dV+ |
V dT= |
|
dV+ |
V dT |
|
|
|
||||||||||
|
|
V - B |
||||||||||
è |
¶V øT |
è |
¶T øV |
è |
¶T øV |
T |
|
T |
||||
ÞS=Rln(V–b)+CVlnT+Const Þ
ÞS=n[Rln(Vnb)+CVlnT+Const].
§ Ефект Джоуля – Томсона для газу В.д.В. Конец |
|||||||
T |
=ç |
÷ |
= |
æ ¶V ö |
-V |
16− й лекции!!! |
|
è |
¶T øP |
||||||
æ |
¶T ö |
|
T ç |
÷ |
|
||
DP |
è |
¶P øI |
|
|
CP |
|
|
|
|
|
|
|
|
|
|
DP<0 Þефект Джоуля – Т. є позитивним, якщо DТ<0. Якщо DТ>0, то ефект Д – Т є
негативним.
æ ¶V ö
Скористаємося ç ÷ = - è ¶T øP
æ |
¶V ö |
æ |
¶P ö |
|
(¶P/ ¶T)V |
|
|
ç |
÷ |
ç |
÷ |
= - |
|
Þ |
|
(¶P/ ¶V)T |
|||||||
è |
¶P øT è |
¶T øV |
|
||||
|
T |
|
T (∂P / ∂T )V + V (∂P / ∂V ) |
|
|
T |
|
|
|
bRT |
- |
|
2a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
||||||
Þ |
|
= |
|
|
|
Þ |
|
= (V - b) |
V |
|
|
|
|
|
|
|
|||||
DP |
|
- CP (¶P / ¶V )T |
|
DP |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
CP (¶P/ ¶V)T |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
RT |
|
∂P |
= - RT |
|
|
|
T |
|
|
2a |
- b |
|
||||
1. Якщо газ є розрідженим Þ(Vb)2» V2; P» |
; Þ |
Þ |
|
|
|
|
|
||||||||||||||
|
= RT |
; |
|||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
V |
|
¶V |
V 2 |
|
|
|
DP |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
CP |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
b=0 Þгаз охолоджується, що пояснюється тим, що виконується робота проти сил
молекулярного притягання; а=0 Þгаз нагрівається, що не очевидно, не витікає ні з яких фізичних міркувань.

Температура інверсії диференціального ефекту Джоуля–Томпсона
2a 27
Ti= Rb = 4 Tk=2TB;
Якщо температура, за якої відбувається дослід T<TiÞ газ прохолоджується (в
основному). Якщо ж T>TiÞгаз нагрівається (He, H2).
|
|
|
|
|
|
2a |
æV - b ö2 |
|
|
|
|
|
||
|
2. |
Густий газ: T> |
|
ç |
÷ |
ÞDT>0 |
|
|
||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
Rb è V |
ø |
|
|
|
|
|
|
|
|
|
2a |
æV - b ö2 |
|
|
|
|
27 |
æj - 1 |
|
ö2 |
|||
T= |
|
|
ç |
÷ |
крива інверсії t= |
4 |
ç |
|
3 |
÷ . |
||||
|
|
|
||||||||||||
|
|
j |
|
|||||||||||
|
|
Rb è V |
ø |
|
|
|
|
|
ç |
|
÷ |
|||
|
|
|
|
|
|
|
|
|
|
|
è |
|
|
ø |
Малюнок
§Зрідження реальних газів
1.Інтегральний ефект Джоуля–Томпсона має місце за умови великої різниці
тисків (10¸ 100 атм.), здійснюється шляхом дроселювання газу, тобто протіканням його через вентиль, по різні сторони якого підтримується велика різниця тисків. При цьому ентальпія зберігається. Процес є нерівноважним.
P |
æ |
¶T ö |
|
|
æ |
¶V ö |
-V |
|
|
2 |
dP = |
P2 T ç |
÷ |
. |
|||||
T2–T1= |
ç |
÷ |
|
è |
¶T øP |
|
|
||
Pò |
è |
¶P ø |
|
ò |
|
|
|
dP |
|
I |
|
CP |
|
|
|||||
1 |
|
|
P1 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Процеси не тотожні, але обидва процеси приведуть до одного і тому ж кінцевому стану.
2.Газ знижують використовуючи:
примусове випаровування рідини (охолодження рідини);
ефект Джоуля–Томпсона;
зворотне адіабатичне розширення газу, що робить зовнішню роботу;
адіабатне розмагнічування парамагнітної солі (0,0014 К)
Рекорд 2004 рік: МТІ. Т¯450 пК.
При розширенні через вентиль за Джоулем–Томпсоном від 220 атм. до 20 атм. Т

повітря падає на 50°С. У турбодетандері газ розширюється від 67 атмосфер до 1.3
атм.
Малюнок
Ентропія парамагнітної солі в магнітному полі є нижчою, ніж при Н=0. При низькій температурі в гелієвому випарнику накласти на зразок магнітне поле Þ S↓ (аб)
ізотермічно внаслідок контакту солі з Не. Ізолювавши зразок, знімемо H Þ зростає частина ентропії, пов'язана з порушенням порядку в магнітних моментах, але загальна ентропія не змінюється Þ зменшиться частина ентропії, пов'язана з тепловими коливаннями кристалічних ґрат солі ÞТ↓ (бв). Погрішності теплоізоляції
дають «г» замість «в».
Тема 5. Рідина
Молекулярнокінетична модель рідини
1.Для рідини (як і для твердого тіла) характерна наявність певного об’єму.
2.У полі тяжіння рідина набуває форми займаної судини.
3.Ближній порядок: для кожної молекули положення найближчих сусідів є упорядкованим, але швидко порядок цілком зникає. (У кристалах – далекий порядок) ÞСтруктура рідини є квазікристаличною.
4.Зазвичай рідина є ізотропною, анізотропними є рідини з подовженими молекулами, як от рідкі кристали, вони є анізотропними за оптичними і

іншими властивостями.
5.Тепловий рух молекул рідини – це коливання біля змінного положення рівноваги. (Нове положення рівноваги відстоїть від попереднього на відстань порядку розмірів молекул). Час осілого життя безладно змінюється, але середній час різко зменшується із зростанням температури.
6.Тверді тіла, які мають близький порядок і не мають анізотропії, називають аморфними. Перехід від аморфного твердого тіла до рідини здійснюється
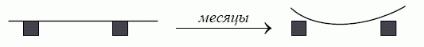 без розривів Þ аморфні тверді тіла – це переохолоджена рідина. (Приклад: скло, смоли і бітуми…) Асфальт
без розривів Þ аморфні тверді тіла – це переохолоджена рідина. (Приклад: скло, смоли і бітуми…) Асфальт
випливає з бочки, скляна паличка прогинається і деформація не зникає, якщо паличку зняти з підставок.
7.Питомий об’єм рідини в 103 разів менший за питомий об’єм газів Þчлен Va2
у рідини в 106 разів більше, ніж у газах Þрівняння В.д.В. набуває вигляду
|
|
a(V − b) |
=RT |
|
|
V 2 |
|
Розрахункове |
a |
для Н2О дає 11 000 атмосфер (розраховують з роботи виходу) |
|
V 2 |
|||
Þстискальність рідин є мізерно малою (бомби руйнують підводні човни). Коефіцієнт стискальності
K= − 1 dV V dP
P-ÞK¯; T¯ÞK¯.
8.Радіус сфери дії молекулярних сил ~10−9м.
9.Теплоємність твердих тіл поблизу точки плавлення є близькою до теплоємності рідини після плавлення.
10.Довжина вільного пробігу в газі ~10−7м є набагато більшою за середню відстань між молекулами, а в рідині переміщення ~10−10м міжмолекулярної
