
- •Тема 3. Основные реакции сталеплавильных процессов (4 часа)
- •5.1. Термодинамический анализ сталеплавильных реакций
- •5.1.1. Сродство элементов - примесей чугуна к кислороду
- •5.1.2. Окисление кремния
- •5.1.3. Окисление марганца
- •5.1.4. Окисление и восстановление фосфора
- •5.1.5. Удаление серы из металла
Тема 3. Основные реакции сталеплавильных процессов (4 часа)
5.1. Термодинамический анализ сталеплавильных реакций
Сталеплавильные реакции относятся к категории гетерогенных. Гетерогенными называют реакции в том случае, если реагирующие вещества находятся в различных фазах, а сам процесс протекает на границе раздела фаз. Гетерогенные реакции являются сложными и протекают в несколько стадий, важнейшими из которых являются:
Массоперенос реагирующих веществ в объеме фаз и доставка их на границу раздела.
Собственно химическая реакция взаимодействия реагирующих веществ.
Отвод продуктов реакции в объем фаз.
Первую и третью стадии реакций называют диффузионными стадиями, поскольку сущностью этих стадий является диффузия веществ.
Вторая стадия - кинетическая. Скорости протекания различных стадий обычно сильно различаются и скорости диффузионных стадий значительно меньше скоростей кинетической стадии. Следовательно, в сталеплавильном процессе скорость определяется законом диффузионных стадий. Наиболее важным средством перемешивания металла и шлака в сталеплавильном производстве является протекание реакций окисления углерода.
5.1.1. Сродство элементов - примесей чугуна к кислороду
Под химическим сродством понимают способность элементов вступать в химическое взаимодействие между собой. Критерием химического сродства является значение константы равновесия реакции взаимодействия элементов:
Si + O2 = (SiO2) + Q Mn + 1/2 O2 = (MnO) + Q
C + 1/2 O2 = CO + Q 2P + 5/2O2 = (P2O5) + Q
Fe + 1/2 O2 = (FeO) + Q
Сродство примесей к кислороду меняется с температурой, т.о. порядок окисления примесей в сталеплавильных процессах определяется их сродством к кислороду и соответственно изменяется с температурой (рис.5.1).
Mn Si C P Fe K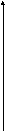







Рис.5.1. Зависимость констант
равновесия
реакций окисления
примесей чугуна от темпер
t,oC 1470 1560
Для всех реакций константа равновесия уменьшается с увеличением температуры, но при t 1470oC наибольшая константа у Si, затем у Mn - C - P - Fe; при t = 1470-1560С: Si - C - Mn - P - Fe; при t 1560oC: C - Si - Mn - P - Fe.
5.1.2. Окисление кремния
Кремний сплавляется с железом в любых соотношениях. При растворении кремния в железе выделяется заметное количество тепла. Кремний - элемент легко окисляющийся. Окисление кремния, растворенного в металле, может происходить в результате его взаимодействия с кислородом, растворенным в металле, с кислородом газовой фазы, с оксидами железа шлака. В общем виде можно записать
Si + O2 = (SiO2) + Q, Q = 775 кДж/моль. (5.1)
Во всех случаях при окислении кремния выделяется значительное количество тепла. Окисление кремния может протекать интенсивно во всем интервале температур сталеварения при наличии окислителя. Продукт реакции (SiO2) образует шлак. Образование шлака изолирует металл от непосредственного контакта с газовой фазой. При наличии шлакового покрова окисление кремния проходит по схеме:
Si + (FeO) = (SiO2) + 2Fe , (5.2)
т.е. кремний окисляется оксидами железа шлака,
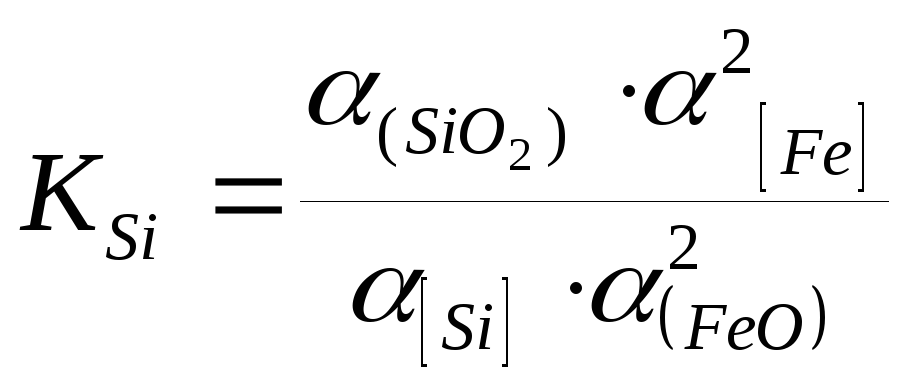 ,
(5.3)
,
(5.3)
Fe 1, т.к. чистый элемент Si = Si, тогда
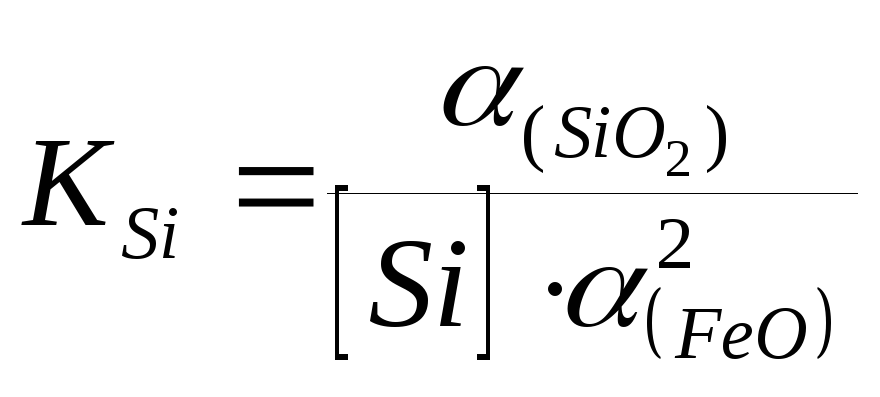 ,
(5.4)
,
(5.4)
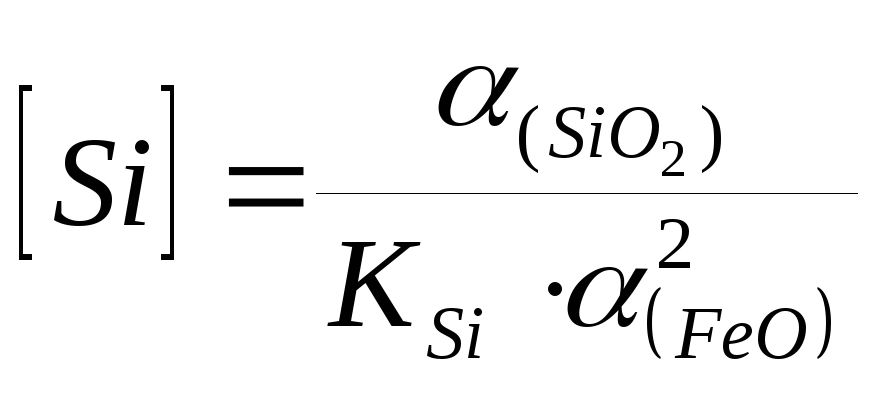 .
(5.5)
.
(5.5)
Концентрация кремния зависит от температуры, т.к. константа зависит от температуры, и от состава шлака.
Q 0, следовательно Т, К; К1400Si = 20000: К1600Si = 15000.
(SiO2) = N(SiO2) (SiO2) , (5.6)
(SiO2) - коэффициент активности SiO2 в шлаке, зависит от степени взаимодействия (SiO2)с компонентами шлака.
а) В кислых процессах, т.е. при кислых шлаках активность (SiO2) равняется концентрации (SiO2) и соответственно (SiO2) = 1, тогда SiO21600 0,02 0,03%.
б) В основных процессах, при основных шлаках образуется метасиликат кальция:
(SiO2) + (CaO) = (CaOSiO2), (5.7)
(SiO2) 0, т.е. активность (SiO2) в основных шлаках снижается до нуля и концентрация Si 0.
В основных процессах кремний окисляется полностью.
