
Галогены
.pdf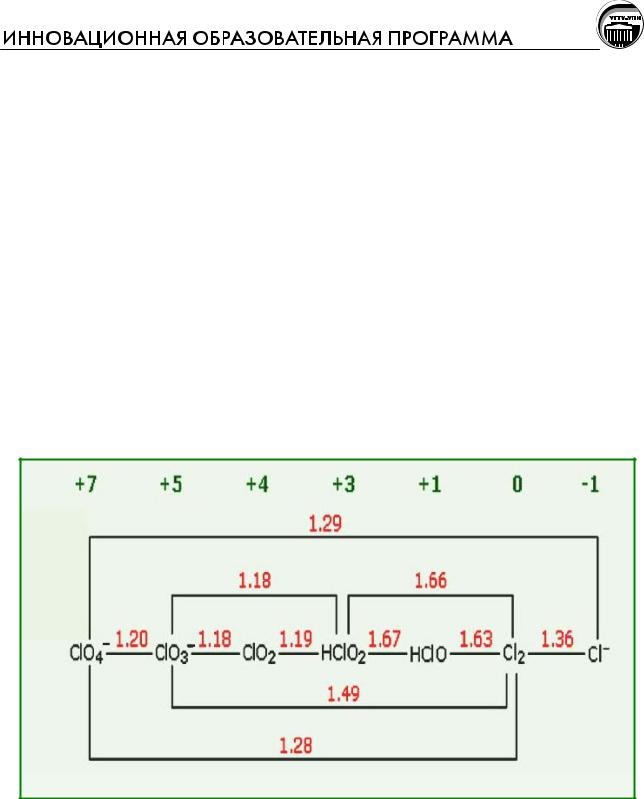
Броматы и иодаты диспропорционированию не подвергаются.
Кислородсодержащие кислоты и оксоанионы галогенов являются сильными окислителями, особенно в кислых растворах. Кислоты по срав-
нению с солями значительно менее устойчивы.
В качестве окислителя из кислородных солей галогенов шире всего используется сильный и быстрый гипохлорит. Хлорат калия используется в в пиротехнике и в производстве спичек (входит в состав спичечной головки и окисляет Р, входящий в состав пасты, нанесенной на коробок). Хлораты и пер-
хлораты в смеси с органическими веществами или Al и Мg являются непремен-
ной составной частью твердотопливных ускорителей для ракет.
При обсуждении окислительно-восстановительных свойств соеди-
нений химических элементов часто опираются на диаграммы Латимера.
Рис. Диаграмма Латимера для хлора в кислой среде. Вверху указаны степени окисления, а красным (или синим) – значения стандартных электродных потенциалов (В) для соответствующих превращений
Следует помнить, что из этих диаграмм можно получить информацию лишь о принципиальной возможности окислительно-восстановительного пре-
вращения в стандартных условиях. Для окислительно-восстановительных реак-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ций в водных растворах часто характерны кинетические затруднения, поэтому можно и не получить продукты, образование которых вероятно с точки зрения термодинамики. Этот факт очень актуален при обсуждении окислительно-
восстановительных свойств соединений галогенов.
Анализ значений потенциалов прежде всего указывает на тот факт, что
Cl2 и его кислородные соединения являются очень сильными окислителями,
достаточно сильными термодинамически для окисления кислорода из воды (Ео для полуреакции 2Н2О + 4е– = О2 + 4Н+ равен 1,23 В). И в самом деле, как уже отмечалось, при длительном хранении хлорной воды происходит ее медленное разложение с выделением О2. Но реакции окисления воды всеми оксосоедине-
ниями хлора при обычной температуре идут очень медленно. Быстрее, чем ре-
акция окисления воды, идут реакции диспропорционирования.
В кислой среде диспропорционирование Cl2 не возможно.
HClO может диспропорционировать на Cl– и ClO3–.
HClO2 может диспропорционировать на Cl2 и ClO3–, а также на Cl– и ClO3–.
Оксид ClO2 может диспропорционировать на Cl2 и ClO3–, а также на Cl– и ClO3–. ClO3– может диспропорционировать на Cl– и ClO4–.
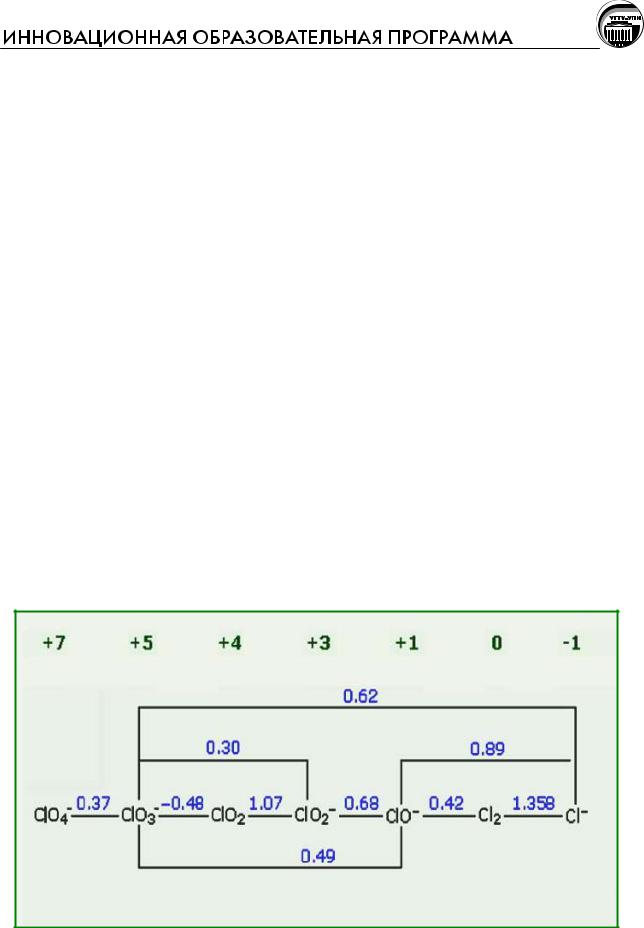
Рис. Диаграмма Латимера для хлора в щелочной среде
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Возможность диспропорционирования в щелочной среде заметно увели-
чивается. Становится возможным и реально происходит в щелочной среде диспропорционирование Cl2 на Cl– и ClO–. Как уже отмечалось, на этом осно-
вано получение гипохлорита NaClO и белильной извести Ca(ClO)Cl.
Ион ClO– может диспропорционировать на Cl– и ClO2–.
Ион ClO2– может диспропорционировать на Cl– и ClO3–.
Действительно, в горячих растворах щелочей при 60 – 80оС Cl2, ClO–,
– диспропорционируют на Cl– и ClO3–.
Несмотря на то, что ClO3– может диспропорционировать с образованием
Cl– и ClO4–, в растворе это диспропорционирование не происходит. Перхлора-
ты получают только электрохимическим окислением растворов хлоратов.
Для элементов Br и I качественная картина аналогична хлору. Но ионы ГО– и ГО2– диспропорционируют у Br и I значительно быстрее, чем у хлора, и
в водных растворах не существуют. Диспропорционирование простых веществ протекает в более слабой степени и для I2 возможно лишь в сильнощелочных растворах. Анион BrО4– слишком сильный окислитель, поэтому BrО3– практи-
чески не проявляет восстановительных свойств.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Заключение
 VIIА-подгруппу образуют р-элементы: F, Cl, Br, I и At.
VIIА-подгруппу образуют р-элементы: F, Cl, Br, I и At.
 Общее групповое название элементов VIIА-подгруппы «галогены».
Общее групповое название элементов VIIА-подгруппы «галогены».
 Общая формула валентных электронов: ns 2np5.
Общая формула валентных электронов: ns 2np5.
 Атомам не хватает всего одного электрона для формирования ус-
Атомам не хватает всего одного электрона для формирования ус-
тойчивой восьмиэлектронной оболочки, поэтому у них сильно выра-
жена тенденция к присоединению электрона.
 Это типичные неметаллы с высокой электротрицательностью.
Это типичные неметаллы с высокой электротрицательностью.
 Элемент второго периода – фтор наиболее сильно отличается от других элементов подгруппы.
Элемент второго периода – фтор наиболее сильно отличается от других элементов подгруппы.
 Фтор – это самый электроотрицательный элемент.
Фтор – это самый электроотрицательный элемент.
 Фтор не проявляет положительных степеней окисления.
Фтор не проявляет положительных степеней окисления.
 Самая устойчивая степень окисления у всех галогенов – (–1)
Самая устойчивая степень окисления у всех галогенов – (–1)
 Все галогены, кроме F, проявляют положительные степени окисле-
Все галогены, кроме F, проявляют положительные степени окисле-
ния вплоть до максимальной +7.
Наиболее характерные степени окисления галогенов:
F : -1, 0;
Cl, Br, I: -1, 0, +1, +3, +5, +7.
У Cl известны оксиды, в которых он находится в степенях окис-
ления: +4 и +6.
 Все галогены находятся в природе в степени окисления (–1).
Все галогены находятся в природе в степени окисления (–1).
 Простые вещества состоят из двухатомных молекул, в которых атомы связаны ковалентной связью.
Простые вещества состоят из двухатомных молекул, в которых атомы связаны ковалентной связью.
 Простые вещества являются сильными окислителями. Особенно высокой окислительной активностью обладает фтор.
Простые вещества являются сильными окислителями. Особенно высокой окислительной активностью обладает фтор.
В ряду F2, Cl2, Br2, I2 окислительная способность ослабевает.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 Для простых веществ характерны реакции диспропорционирова-
Для простых веществ характерны реакции диспропорционирова-
ния. Диспропорционирование усиливается в щелочной среде.
 При диспропорционировании Cl2 в щелочи образуются Cl– и ClO–.
При диспропорционировании Cl2 в щелочи образуются Cl– и ClO–.
 При диспропорционировании I2 в щелочи образуются I– и IO3–. Br2 диспропорционирует аналогично I2.
При диспропорционировании I2 в щелочи образуются I– и IO3–. Br2 диспропорционирует аналогично I2.
 К наиболее важным и широко используемым соединениям галоге-
К наиболее важным и широко используемым соединениям галоге-
нов относятся галогенводородные кислоты и их соли. Природные со-
единения являются солями галогенводородных кислот.
 Сила галогенводородных кислот увеличивается от HF к HI.
Сила галогенводородных кислот увеличивается от HF к HI.
HFслабая кислота; HCl, HBr, HI – сильные кислоты.
Все галогенводородные кислоты обладают общими свойствами
кислот. Две галогенводородные кислоты соляная и плавиковая ши-
роко используются в промышленности.
 Галогенид-ионы способны к образованию комплексных соедине-
Галогенид-ионы способны к образованию комплексных соедине-
ний с катионами многих металлов.
 Все галогениды способны проявлять восстановительные свойства.
Все галогениды способны проявлять восстановительные свойства.
 В ряду F –, Cl –, Br –, I – восстановительные свойства усиливаются.
В ряду F –, Cl –, Br –, I – восстановительные свойства усиливаются.
Наиболее сильным восстановителем из галогенид-ионов является
иодид, самый слабый восстановитель – фторид-ион.
 Галогены с кислородом непосредственно не реагируют.
Галогены с кислородом непосредственно не реагируют.
 Оксиды галогенов - неустойчивые соединения. При 25оС сравни-
Оксиды галогенов - неустойчивые соединения. При 25оС сравни-
тельно стабильны: Cl2O, ClO2, Cl2O6, Cl2O7; I2O5 устойчив до 300 оС.
 Все оксиды галогенов обладают сильным окислительным действи-
Все оксиды галогенов обладают сильным окислительным действи-
ем.
 Наиболее распространенными кислородными соединениями хлора,
Наиболее распространенными кислородными соединениями хлора,
брома, иода являются кислородсодержащие кислоты и их соли.
 Кислородсодержащие кислоты галогенов – это одноосновные ки-
Кислородсодержащие кислоты галогенов – это одноосновные ки-
слоты, с общей формулой HЭОх |
|
ЭОm(OH). |
|||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

 Их сила растет по мере увеличения числа кислородных атомов.
Их сила растет по мере увеличения числа кислородных атомов.
 Исключение составляет слабая йодная кислота H5IO6.
Исключение составляет слабая йодная кислота H5IO6.
 Для Cl известны кислоты: HClO, HClO2, HClO3, HClO4 ;
Для Cl известны кислоты: HClO, HClO2, HClO3, HClO4 ;
для Br – HBrO, HBrO2, HBrO3, HBrO4; для I – HIO3, H5IO6.
 Сильными являются кислоты: HClO4 , HBrO4, HClO3, HBrO3, HIO3.
Сильными являются кислоты: HClO4 , HBrO4, HClO3, HBrO3, HIO3.
 При переходе от Cl к Br сила оксокислот ослабевает.
При переходе от Cl к Br сила оксокислот ослабевает.
 Хлорная кислота HClO4 – это самая сильная из всех оксокислот.
Хлорная кислота HClO4 – это самая сильная из всех оксокислот.
 Кислородсодержащие кислоты и оксоанионы галогенов являются сильными окислителями, особенно в кислых растворах.
Кислородсодержащие кислоты и оксоанионы галогенов являются сильными окислителями, особенно в кислых растворах.
 В качестве окислителя из кислородных солей галогенов шире все-
В качестве окислителя из кислородных солей галогенов шире все-
го используется сильный и быстрый гипохлорит и хлорат калия.
 Для соединений, в которых галогены находятся в положительной степени окисления (кроме+7), характерны реакции диспропорциони-
Для соединений, в которых галогены находятся в положительной степени окисления (кроме+7), характерны реакции диспропорциони-
рования.
УЧЕБНИКИ И УЧЕБНЫЕ ПОСОБИЯ
1.Степин Б.Д., Цветков А.А. Неорганическая химия: Учебник для вузов /
Б.Д. Степин, А.А. Цветков.– М.: Высш. шк., 1994.- 608 с.: ил.
2.Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студен-
тов вузов / М.Х. Карапетьянц, С.И. Дракин. - 4-е изд., стер. - М.: Химия,
2000. - 592 с.: ил.
3.Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов,
обучающихся по направлению и специальности "Химия" / Я.А. Угай. - 3-е
изд., испр. - М.: Высш. шк., 2007. - 527 с.: ил.
4.Никольский А.Б., Суворов А.В. Химия. Учебник для вузов /
А.Б. Никольский, А.В. Суворов.– СПб: Химиздат, 2001. - 512 с.: ил.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
