
Хром, молибден, вольфрам
.pdf
|
|
Металлы VIБ-подгруппы |
|
||||
|
|
|
|
Общая характеристика |
|
|
|
периоды |
|
группы |
VI Б подгруппу образуют d-элементы: Cr, Mo, W. |
||||
ряды |
|
|
|
|
|||
VI |
Валентные электроны: |
|
|
||||
|
|
Cr – 3d54s1; |
Mo – 4d55s1; |
W – 5d46s2; |
|
||
|
|
O |
8 |
|
|||
|
|
|
|
|
|
||
III |
3 |
кислород |
Переход одного электрона с ns-орбитали на (n–1)d обу- |
||||
|
|
15,999 |
|
|
5 |
. |
|
|
|
|
|
словлен устойчивостью электронной конфигурации d |
|||
|
|
24 |
Cr |
Простые вещества – металлы, серебристо-серые, |
|||
|
4 |
|
хром |
тяжелые, с высокими температурами плавления, которые |
|||
|
|
51,996 |
|||||
IV |
|
|
|
|
|
||
|
S |
16 |
повышаются при переходе от Сr |
к W. Вольфрам самый |
|||
|
|
||||||
|
5 |
сера |
|
тугоплавкий металл (температура плавления 3410оС). |
|
||
|
|
32,066 |
|
|
|
|
|
|
|
42 |
Mo |
Элементы Mo и W более сходны между собой, |
|||
|
|
|
|
|
|
||
|
6 |
молибден |
чем с хромом. У Mo и W наиболее устойчива высшая |
||||
V |
|
95,94 |
|
степень окисления и распространены соединения в |
|||
|
Se |
34 |
|||||
|
|
|
|
|
|
||
|
7 |
селен |
|
степени окисления + 6. |
|
|
|
|
|
78,96 |
|
Для Cr известны степени окисления: 3, 6 и ма- |
|||
|
|
|
|
||||
|
|
74 |
W |
лоустойчивая +2. Степень окисления +3 наиболее ус- |
|||
|
8 |
вольфрам |
|||||
|
|
|
|
|
|||
VI |
|
183,84 |
тойчива. Соединения Cr(+6) – сильные окислители, а |
||||
|
Te |
52 |
|
|
|
|
|
|
|
соединения Cr(+2) – восстановители. |
|
||||
|
|
телур |
|
|
|||
|
9 |
|
Наибольшее сходство элементы VIБ–подгруппы |
||||
|
|
127,60 |
|||||
|
|
|
|
|
|
||
VII |
10 |
106 |
|
проявляют в высшей степени окисления, оно выража- |
|||
[263] |
|
ется в кислотном характере высших оксидов и гидрокси- |
|||||
|
|
|
|
||||
дов и в способности оксоанионов к полимеризации. |
|
|
|||||
|
|
2CrO42– + 2H+ Cr2O72– |
+ H2O |
||||||||||||||
|
|
7MoO42– +8 H+ Mo7O246– |
+ 4H2O |
||||||||||||||
|
|
12WO42– +14 H+ W12O4110– + 7H2O |
|||||||||||||||
Элемент Сr достаточно распространен, его содержание в земной коре |
|||||||||||||||||
составляет около 0,01 %. Содержание Mo и W составляет ~10 – 4%. |
|||||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

В природе преобладают соединения Cr(+3). Наибольшее значение имеет смешанный оксид FeO Cr2O3 (минерал хромит). Среди природных соединений
Mo и W преобладают соединения Me(+6): CaWO4 – шеелит, (Fe,Mn)WO4 –
вольфрамит, повелит – CaMoO4 . Для получения Mo используют также молиб-
денит – MoS2. Среди природных соединений Cr известен минерал, в котором хром находится в степени окисления +6 – крокоит PbCrO4. В составе этого минерала был впервые открыт элемент Cr.
Наибольшее практическое значение из металлов VIБ– подгруппы
имеет хром.
Хром
Характерные степени окисления
24Сr |
Валентные электроны Cr: |
|
Хром |
|
|
3d |
|
|
4s |
3d54s1 |
|
|
|
|
|
|
|
|
|
|
|
|
51,996 |
У Cr известны степени окисления: 2, 3, 6. |
|
Наиболее устойчивой является степень окисления + 3. Соединения Cr(+6)
– сильные окислители. Соединения Cr(+2) неустойчивы, в водных раство-
рах они окисляются до Cr(+3), восстанавливая воду.
Кислотно-основной характер оксидов и гидроксидов Cr закономерно из-
меняется в зависимости от степени окисления: в степени окисления +3 оксид и гидроксид – амфотерны, а в высшей степени окисления имеют кислотный ха-
рактер.
В водных растворах Cr(+3) существует в виде аквакатионов [Cr(H2O)6]3+,
которые для простоты обозначают Cr3+.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Хром в высоких степенях окисления находится в растворе в форме ок-
соанионов: CrO42– и Cr2O72–.
Природные соединения и получение металла
Минерал хромит FeO Cr2O3 используют для получения хрома и сплава хрома с железом - феррохрома, необходи-
мого для изготовления нержавеющих ста-
лей.
Рис. Хромит FeO.Cr2O3 – основной минерал, используемый для получения Cr
Для получения феррохрома хромит восстанавливают углем.
FeCr2O4 + 4C = Fe + 2Cr + 4CO
Вместе с оксидами Cr восстанавливаются и оксиды Fe, содержащиеся в руде. Получе-
ние хрома с минимальным содержанием Fe
и С включает несколько стадий:
Окислительная щелочная плавка:
4FeCr2O4 + 20NaOH(расплав) + 7O2 = 8Na2CrO4 + 4Na2FeO2 + 10H2O
Плав после охлаждения выщелачивают водой и осаждают в виде Na2Cr2O7. 2Na2CrO4 + Н2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 2C = Na2CO3 + Сr2O3 + CO
Затем оксид Сr2O3 восстанавливают алюминием:
Сr2O3 + 2Al = 2Cr + Al2O3
Простое вещество
Хром – светло-серый с голубоватым блеском металл с температурой плавления 1857ОС. Плотность – 7,2 г/см3. Хром является очень твердым и ус-
тойчивым к коррозии металлом. На воздухе он покрывается тонкой и плотной пленкой инертного оксида Cr2O3 и практически не окисляется, даже в присут-
ствии влаги. В кислороде при высокой температуре хром сгорает с образовани-
ем оксида Cr2O3.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При нагревании хром реагирует с галогенами и серой, азотом.
Электродный потенциал Ео (Cr3+/Cr) = – 0,74 В, хром растворяется в разбавленных кислотах с выделением водорода.
В концентрированных серной и азотной кислотах хром пассивируется.
Соединения хрома
Соединения хрома в подавляющем большинстве окрашены.
Соединения хрома (+3) имеют цвет от фиолетового до зеленого, а
соединения хрома (+6) _ от желтого до красного. Из-за красивых и разнооб-
разных окрасок своих соединений элемент и получил свое название – «хром»,
что в переводе с греческого означает «цвет».
Соединения хрома (+6)
Все соединения Cr(+6) проявляют сильные окислительные свойства.
Оксид CrO3 – темно-красное кристаллическое вещество, оксид гигро-
скопичен и сильно ядовит.
Получают CrO3 по реакции:
K2CrO4 + 2Н2SO4 (конц.) = 2KHSO4 + CrO3 + H2O
С водой оксид CrO3 реагирует с образованием двух кислот H2CrO4 и
Н2Cr2O7, известных только в растворе.
В водном растворе устанавливается равновесие:
Cr2O72– + H2O 2HCrO4– CrO42–- + 2Н+
В щелочных растворах более устойчив CrO42–- (желтого цвета), в интер-
вале рН от 2 до 6 сосуществует в равновесии с Cr2O72– (оранжевого цвета) и
HCrO4– ионы, в кислых растворах преобладают дихромат-ионы Cr2O72–.
При подкислении раствора концентрированной серной кислотой из него выпадают красные кристаллы CrO3.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Рис. Растворы солей Cr(+6). В щелочных растворах преобладают желтые хроматы, а в кислых – оранжевые дихроматы.
В щелочной среде соединения хрома (VI) получают окислением хрома (+3):
2 Na3[Cr(OH)6] + 3H2O2 = 2Na2CrO4 + 8H2O + 2NaOH
Хромат калия K2CrO4 – кристаллизуется в виде безводных желто-
лимонных кристаллов. Бихромат калия K2Cr2O7 – в виде безводных оранжевых пластинок. При обычных температурах его растворимость сравнительно мала и сильно увеличивается с ростом температуры (от 4,6 г на 100 г воды при 0оС до
94,1 г при 100оС).
Бихромат аммония (NH4)2Cr2O7 при нагревании до 200 оС энергично сго-
рает с образование тонкодисперсной окиси хрома(+3). (NH4)2Сr2O7 = Cr2O3 + 4H2O + N2
Бихроматы и хроматы являются сильными окислителями.
Сr2O72– + 14H+ +6 e– = 2Cr3++ 7H2O; (E0= +1,33 В). CrO42– + 4H2O +3e– = Cr(OH)3 + 5OН– ; (E0= +0,13 В).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Галогензамещенные хроматы
Хлористый хромил CrO2Сl2 – представляет собой темно-красную жид-
кость с температурой кипения 117 оС. Это соединение образуется при дейст-
вии газообразного HCl на сухую трехокись хрома:
2HCl + CrO3 = CrO2Сl2 + H2O или
K2Cr2O7 + 3H2SO4 + 4KCl = 2CrO2Сl2 + 3K2SO4 + 3H2O
Водой хлористый хромил разлагается с выделением тепла.
Хлорохромат калия К[CrO2Сl] получают добавлением избытка концен-
трированной соляной кислоты к бихромату калия:
K2Cr2O7 + 2HCl = 2K[CrO2Сl]
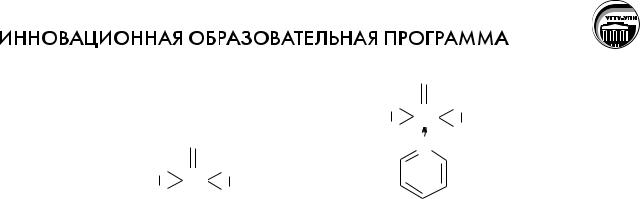
Пероксохроматы
При взаимодействии соединений Сr(VI) с перекисью водорода в зависи-
мости от условий проведения реакции можно получать различные пероксохроматы: красные [CrO8]3– и синие [Cr2O12]2–.
|
|
O |
|
|
O |
|
|
|
3- |
|
O |
|
|
O |
|
O |
|
O |
|
|
2- |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
O |
|
|
|
O |
|
O |
|
|
|
|
O |
|
|
|
|
|
|||||
|
|
Cr |
|
|
|
|
|
Cr |
O |
Cr |
O |
|
|||||||||
|
|
O |
|
|
|||||||||||||||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
O |
|
|
O |
|
|
|
|
|
O |
|
|
O |
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Красный пероксохромат калия K3CrO8 получают при взаимодействии
30% -ной перекиси водорода на сильнощелочной раствор хромата калия.
Синий пероксохромат калия K2Cr2O12 получают при взаимодействии
30% -ной перекиси водорода на раствор бихромата калия, охлажденный до 0oC.
Синяя перекись хрома CrO5 известна в растворах и продуктах присоеди-
нения (например, с пиридином).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
Cr |
O |
|
|
|
|
|
|
O |
O |
|
O |
|
|
N |
|
|
|
|
|
|
|
O |
Cr |
O |
|
|
|
|
|
|
|
O |
|
O |
|
|
В водном растворе при обычной температуре пероксохроматы неустой-
чивы и разлагаются с выделением кислорода.
Соединения хрома (+3)
Оксид Cr2O3 – наиболее устойчивое соединение Cr(+3) . Это кристал-
лическое темно-зеленое вещество, нерастворимое в воде. Оксид Cr2O3, полу-
ченный при высокой температуре, является очень инертным соединением и не растворяется в водных растворах кислот и щелочей. Оксид взаимодействует с расплавами щелочей с образованием оксохромита:
Cr2O3(кр.) + 2NaOH(ж.) = 2NaCrO2(кр.) + H2O(г.)
При растворении оксохромита в щелочном растворе он переходит в гид-
роксокомплекс:
NaCrO2(кр.) +2H2O(ж.) = Na[Cr(OH)4](р.)
Гидроксид хрома (+3) выпадает в виде серо-зеленого осадка неопреде-
ленного состава Cr2O3 nH2O при добавлении щелочи к растворам солей Cr (+3).
При слабом нагревании он переходит в гидроксид, состав которого более соот-
ветствует формуле CrOOH, но чаще всего гидроксид хрома (+3) описывают условной формулой Cr(OH)3.
При нагревании Cr2O3 nH2O выше 150оС он разлагается на воду и оксид
Cr2O3.
Гидроксид хрома (+3) амфотерен. При его растворении
вкислоте образуются катионы Cr3+, вернее, [Cr(H2O)6]3+,
вщелочи - комплексные анионы [Cr(OH)4] ─ , при большом избытке щелочи образуются анионы [Cr(OH)6]3 ─.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Соли хрома (+3) в растворе могут быть окрашены по-разному, по-
скольку часть молекул воды в аквакатионе может легко замещаться на анио-
ны, например, аквакатион [Cr(H2O)6]3+ – фиолетовый, а [Cr(H2O)4Cl2]+ –темно-
зеленый.
Из водных растворов соли хрома(+3) кристаллизуются в виде кристалло-
гидратов, например: [Cr(H2O)6]Cl3 – фиолетового цвета, [CrСl(H2O)5]Cl2•H2O –
бледно-зеленого цвета и [CrСl2(H2O)4]Cl•2H2O – темно-зеленого цвета.
Хромовые квасцы KCr(SO4)2 • 12H2O кристаллизуются из смешанного раствора сульфата хрома и сульфата калия, по составу и кристаллической структуре полностью соответствуют алюмокалиевым квасцам
KAl(SO4)2•12H2O.
Безводный хлорид хрома CrСl3 – блестящие листочки красно-
фиолетового цвета.
Удобным способом получения безводного CrCl3 является взаимодейст-
вие кристаллогидрата Cr(+3) с четыреххлористым углеродом:
[CrСl2(H2O)4]Cl• 2H2O + CCl4 → CrCl3 + H2O + ....или
Cr2O3 + 3CCl4 = 2CrCl3 + 3СOCl2
Соли хрома (+3) в водных растворах в сильной степени подвержены гидролизу и создают в растворе кислую среду. Если в растворе присутству-
ют также анионы очень слабых и летучих кислот CO32─, SO32─, S2─, гидролиз за-
вершается образованием гидроксида:
2CrCl3 + 3Na2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 6NaCl
Степень окисления (+3) у хрома более устойчива, чем (+6). Но под дейст-
вием сильных окислителей хром (+3) можно окислить до хрома (+6). Окисление легче проходит в щелочной среде.
(Cr3+, [Cr(OH)4]─ ) + окислитель + щелочь CrO42─
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Ярко выраженная способность трехвалентного хрома к образованию комплексных соединений особенно отчетливо проявляется в комплексных про-
дуктах присоединения аммиака, например [Cr(NH3)6]3+. Известно большое чис-
ло многоядерных комплексов, содержащие гидроксильные или кислородные мостики:
[(NH3)5Cr(OH)Cr(NH3)5]5+ → [(NH3)5CrOCr(NH3)5]4+ (при pH>7)
Соединения хрома (+2)
В водных растворах соединения Cr(+2) сильные и быстродействую-
щие восстановители.
Водные растворы Cr(+2) используют в качестве поглотителей кисло-
рода:
4CrCl2 + 4HCl + O2 = 4CrCl3 + 2H2O
Безводные галогениды Cr(+2) получают взаимодействием металла с HCl, HBr или с I2 с при 600 – 700оС или восстановлением безводных CrX3 (где Х =
Cl, Br, I) водородом при 600 –700оС:
Cr + 2HX = CrX2 + H2
2CrX3 + H2 = 2CrX2 + 2HX
Cr + I2 = CrI2
Одним из самых доступных и кинетически устойчивых соединений
Cr(+2) является [Cr2(CH3COO)4(H2O)2]. Его легко выделить при добавлении к концентрированному раствору ацетата калия в инертной атмосфере водного раствора CrX2. Твердая фаза соединения Cr(+2) образована двухядерными мо-
лекулами [Cr2(CH3COO)4(H2O)2].
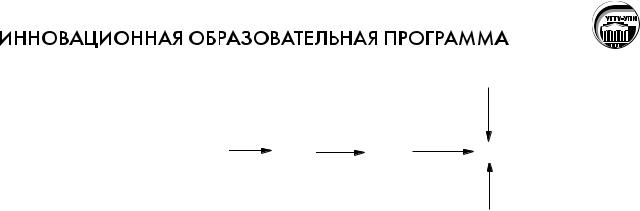
Для оценки окислительно-восстановительных свойств соединений хрома можно воспользоваться диаграммой Латимера.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+0,293 |
|
|
|
|
|
Cr |
|
2O72- +1,33 |
Cr3+ -0,406 |
Cr 2+ -0,913 |
Cr 0 |
||||
|
|||||||||
|
|
|
|
-0,744 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
Диаграмма Латимера (рH<7)
УЧЕБНИКИ И УЧЕБНЫЕ ПОСОБИЯ
1.Степин Б.Д., Цветков А.А. Неорганическая химия: Учебник для вузов /
Б.Д. Степин, А.А. Цветков.– М.: Высш. шк., 1994.- 608 с.: ил.
2.Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студен-
тов вузов / М.Х. Карапетьянц, С.И. Дракин. - 4-е изд., стер. - М.: Химия,
2000. - 592 с.: ил.
3.Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов,
обучающихся по направлению и специальности "Химия" / Я.А. Угай. - 3-е
изд., испр. - М.: Высш. шк., 2007. - 527 с.: ил.
4.Никольский А.Б., Суворов А.В. Химия. Учебник для вузов /
А.Б. Никольский, А.В. Суворов.– СПб: Химиздат, 2001. - 512 с.: ил.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
