
- •2) Функция распределения по энергиям и относительным скоростям (вывод).
- •3) Распределение Больцмана (Вывод):
- •4) Внутренняя энергия иг, число степеней свободы.
- •5) Газовые законы и их графики в разных координатных осях (изотерм, изохор., изобар., круговой)
- •7) Первое начало термодинамики и его применение к изопроцессам.
- •8) Адиабатический процесс. Уравнение Пуассона(вывод). Работа на адиабатическом процессе(вывод).
- •9) Теплоемкости иг. Политропический процесс и вывод его уравнения. Показатель политропы.
- •10) Необратимые процессы. Их направленность. Макро- и микросостояния.Вероятность осуществления данного макросостояния.
- •12) Энтропия. Второе начало термодинамики, Следствие Клаузиуса.
- •15) Число столкновений и средняя длина свободного пробега молекул
- •20) Электростатическое поле.Напряженность электростатического поля. Принцип суперпозиции полей. Примеры расчетов полей для двух точечных зарядов
- •21) Электрическое поле. Напряженность электрического поля. Принцип суперпозиции. Расчет поля на оси стержня, равномерно заряженного линейной плотностью заряда λ. Графическое представление полей.
- •22)Потенциал электрического поля. Разность потенциалов. Связь напряженности и разности потенциалов в электростатическом поле в интегральной и дифференциальной форме
- •23)Работа сил электрического поля.
- •24)Теорема о циркуляции e.
4) Внутренняя энергия иг, число степеней свободы.
ИГ- газ состоящий
из невзаимодействующих частиц.
U-Внутренняя
энергия. U=Uk+Uп+Uвращ+…Для
ИГ внутренняя энергия –сумма кинетических
энергий всех молекул. 1)![]() на каждую степень свободы молекулы;2)i-число
степеней молекул - число разрешенных
направлений поступательного и
вращательного движения, зависит от
степени сложности газовой молекулы: 1)
одноатомные(He,
Ar);2)двухатомные(H2,
O2,
N2);
3) трехатомные(CO2,
NH3)
Найдем суммарную энергию для всех
молекул
на каждую степень свободы молекулы;2)i-число
степеней молекул - число разрешенных
направлений поступательного и
вращательного движения, зависит от
степени сложности газовой молекулы: 1)
одноатомные(He,
Ar);2)двухатомные(H2,
O2,
N2);
3) трехатомные(CO2,
NH3)
Найдем суммарную энергию для всех
молекул
![]() Свойства:
1) Является функцией состояния газа,
значение определяется нач и кон значениемT
Свойства:
1) Является функцией состояния газа,
значение определяется нач и кон значениемT![]() ;
2)U
может быть записана через показатель
адиабаты γ
;
2)U
может быть записана через показатель
адиабаты γ![]()
5) Газовые законы и их графики в разных координатных осях (изотерм, изохор., изобар., круговой)
Изопроцесс в ИГ-процесс, при котором один из параметров (T,P,V) и количество газа остается неизменным.
-
Изопроцессы
Переменные
параметры
Газовые законы
Графики
Изотермический процесс

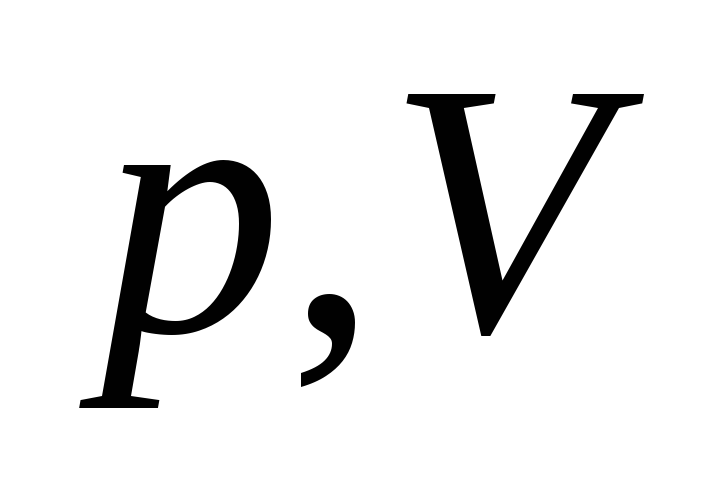
З. Бойля-Мариотта
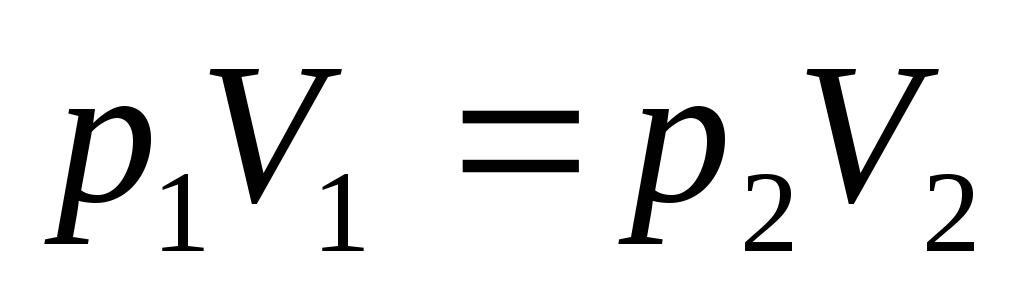 или
или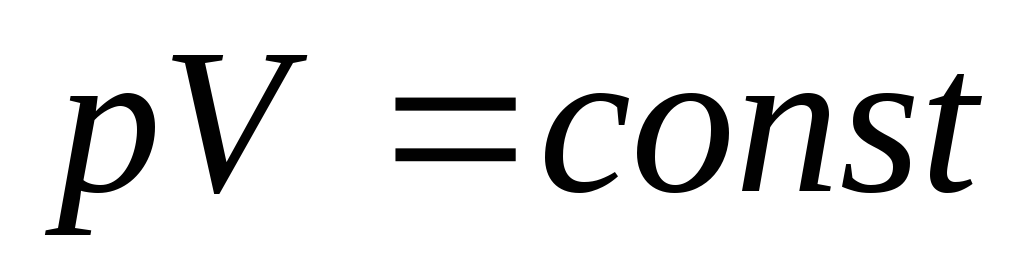 ,
зависимость между
,
зависимость между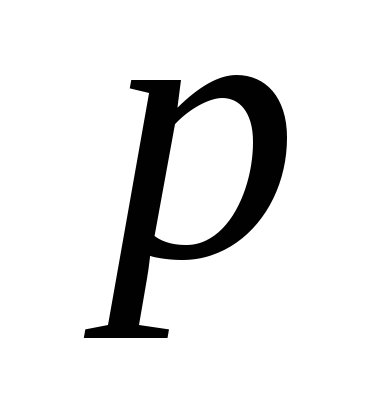 и
и обратно
пропорциональная
обратно
пропорциональная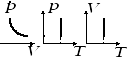
изотермы
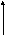
Изобарный процесс

З.Гей-Люссака
 или
или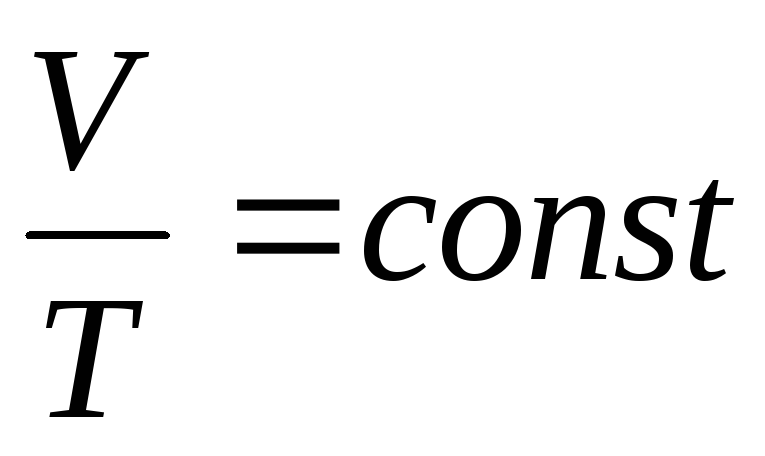 ,
зависимость между
,
зависимость между и
и прямо
пропорциональная
прямо
пропорциональная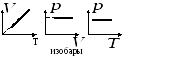
Изохорный процесс
З. Шарля
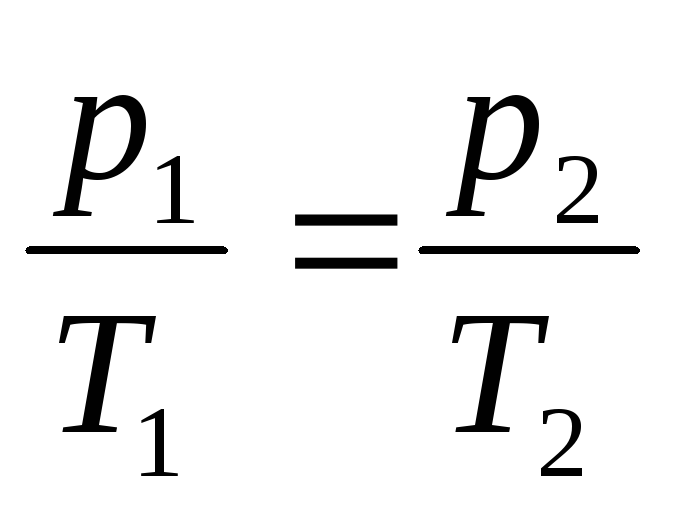 или
или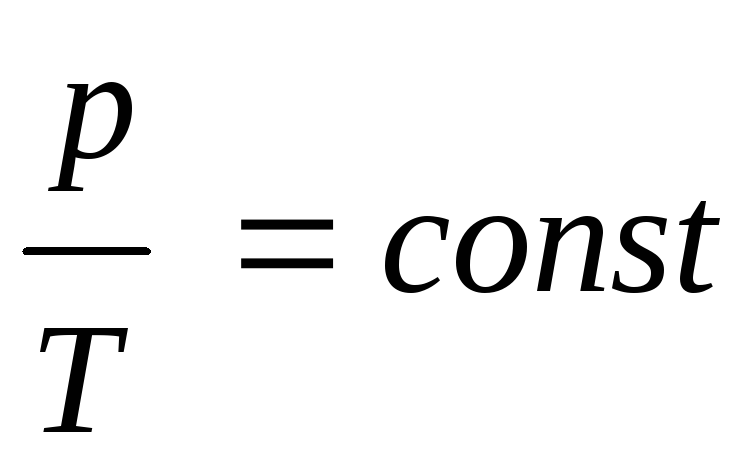 ,зависимость
между
,зависимость
между и
и прямо
пропорциональная
прямо
пропорциональная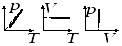
изохоры
6) Работа в термодинамике, ее свойства и вычисление для разных изопроцессов.
=
7) Первое начало термодинамики и его применение к изопроцессам.
Количество теплоты подведенное к системе идет на изменение внутренней энергии системы и на совершение системой работы против внешних сил.Q=∆U+A. Qдля изопроцессов:
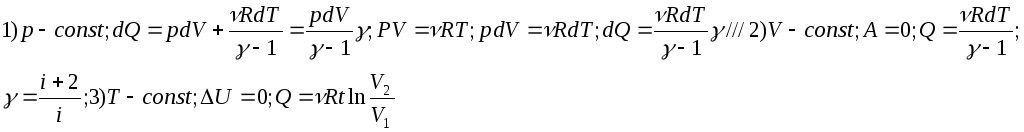
8) Адиабатический процесс. Уравнение Пуассона(вывод). Работа на адиабатическом процессе(вывод).
А.П.-Процесс, протекающий без теплообмена с окр. Средой.dQ=0:dA=-dU. Работа газа совершается за счет убыли его внутренней энергии.Сжатие газа сопроождается его нагревом, а расширение-охлаждением, то есть изменением внутренней энергии.

9) Теплоемкости иг. Политропический процесс и вывод его уравнения. Показатель политропы.
Теплоемкость-
количество теплоты, которое необходимо
сообщить ИГ, чтобы нагреть его на один
градус. С=dQ/dT.Удельная
теплоемкость Суд-сфв,
характеризующая способность тела
поглощать или отдавать тепло и равная
Q
необходима для нагревания 1 гр вещ-ва![]() Дж/кгК
Дж/кгК
Молярная
теплоемкостьСм-СФВ,
равная Q
необходимому для нагревания 1 моля
вещ-ва на 1 Кельвин.![]()
-
Тепловой
процесс
Формула для расчета
количества теплоты
Физический смысл
Нагревание и
охлаждение
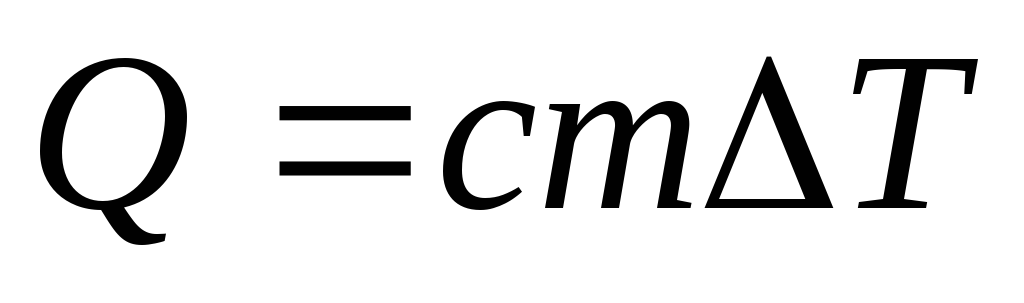 ,
где
,
где
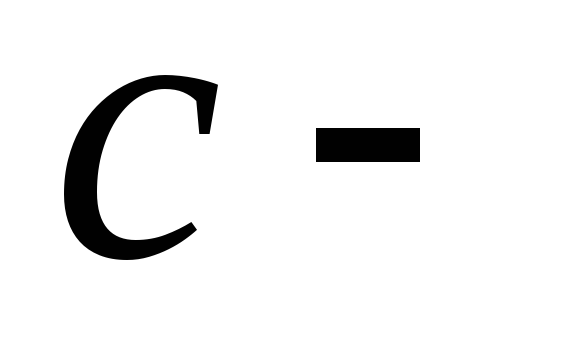 удельная
теплоемкость вещества.
удельная
теплоемкость вещества. где
где
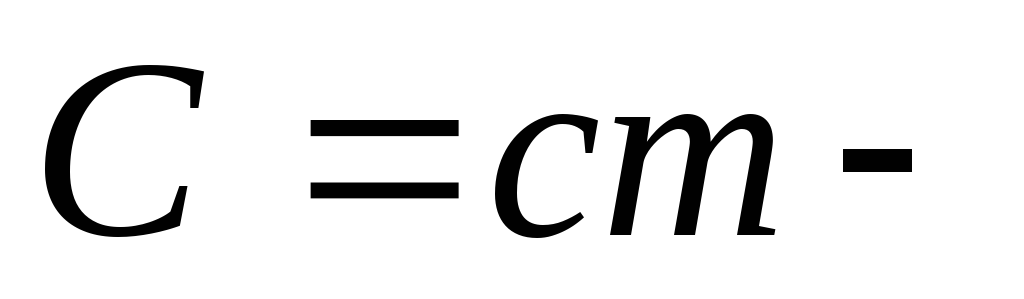 теплоемкость
тела.
теплоемкость
тела.Удельная теплоемкость вещества численно равна количеству теплоты, которое поглощается или выделяется 1
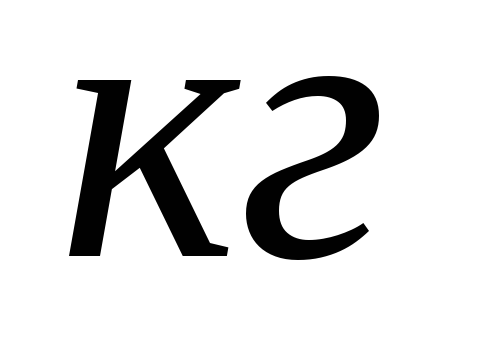 данного
вещества при изменении температуры
на 1
данного
вещества при изменении температуры
на 1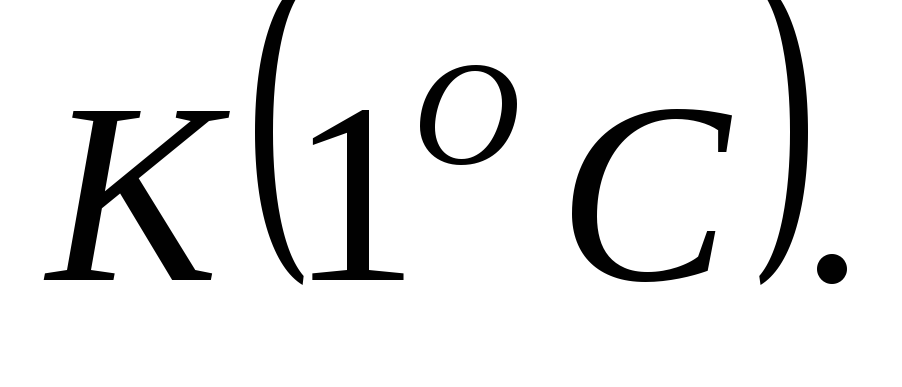
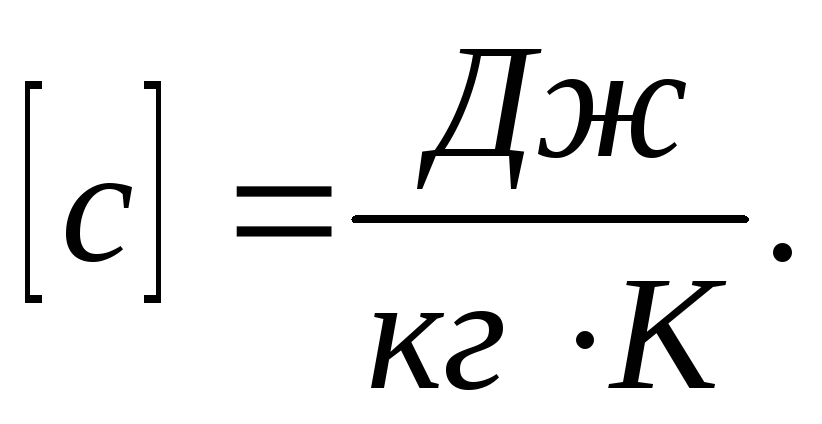


1Плавление и отвердевание

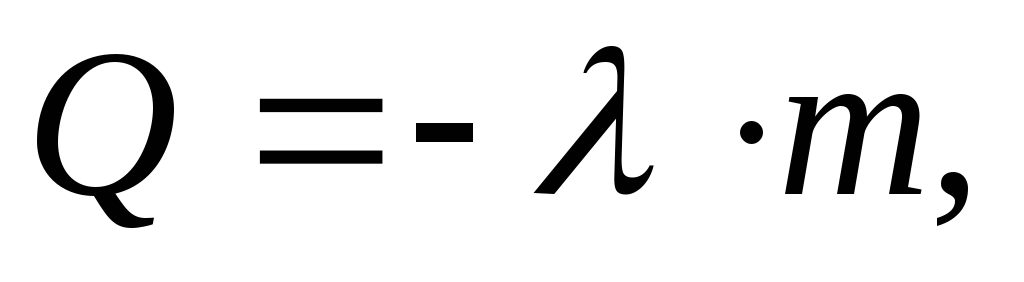 где
где
 удельная
теплота плавления вещества.
удельная
теплота плавления вещества.Удельная теплота плавления вещества численно равна количеству теплоты, которое необходимо сообщить 1
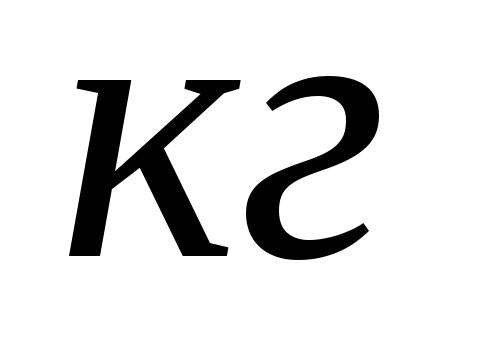 веществапри
температуре плавления,
чтобы его расплавить.
веществапри
температуре плавления,
чтобы его расплавить.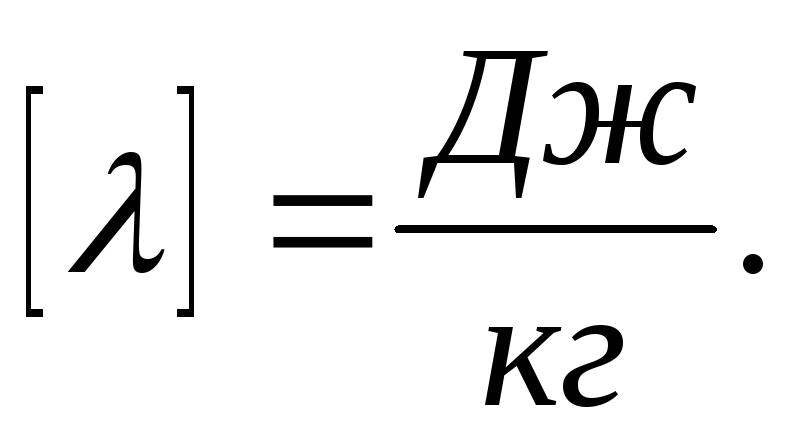
Парообразование
и конденсация

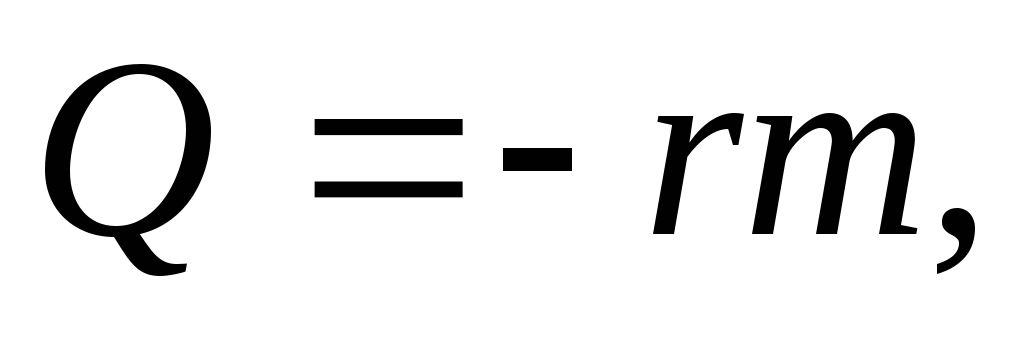 где
где
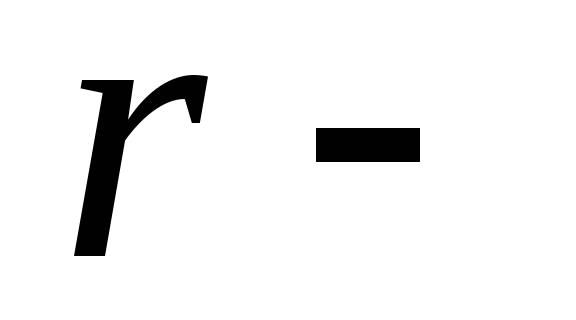 удельная
теплота парообразования.
удельная
теплота парообразования.Удельная теплота парообразования вещества численно равна количеству теплоты, которое необходимо сообщить 1
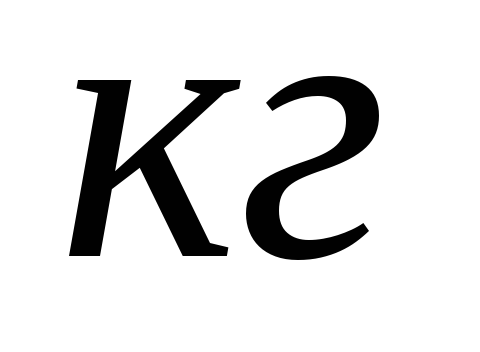 вещества
при температуре кипения, чтобы его
превратить в пар.
вещества
при температуре кипения, чтобы его
превратить в пар.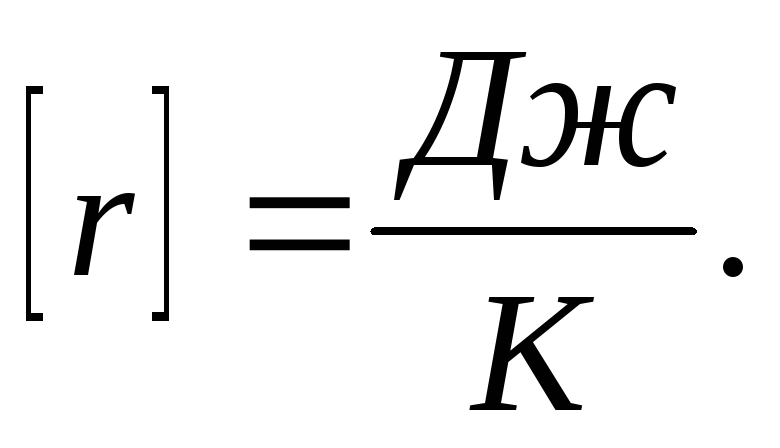
Сгорание топлива
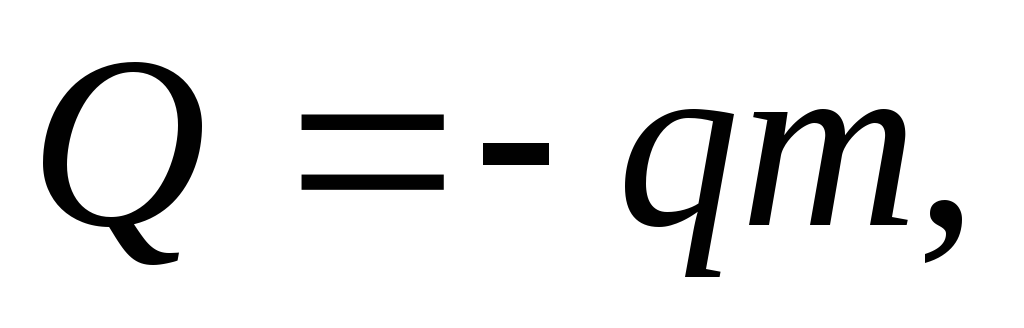 где
где
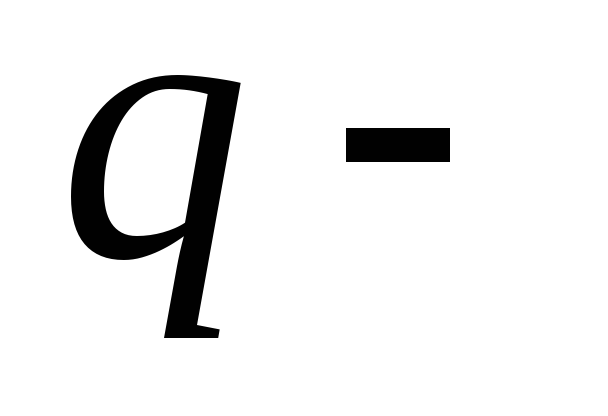 удельная
теплота сгорания топлива.
удельная
теплота сгорания топлива.Удельная теплота сгорания топлива. численно равна количеству теплоты, которое выделяется при полном сгорании 1
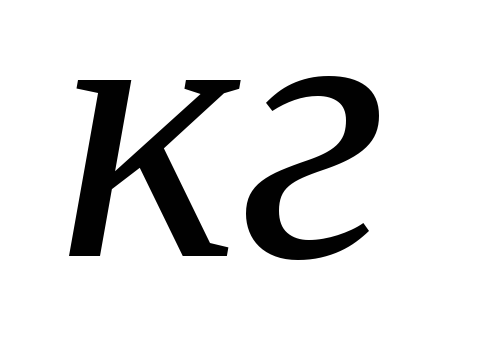 данного
топлива.
данного
топлива.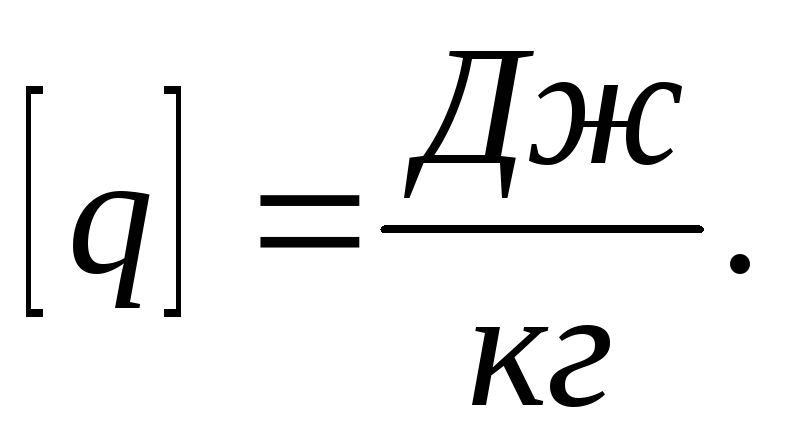
Политропический
процесс —
термодинамический
процесс,
во время которого удельная
теплоёмкость
c
газа
остаётся неизменной. Предельными
частными явлениями политропного процесса
являются изотермический
процесс
и адиабатный
процесс.
В случае идеального газа изобарный
процесс
и изохорный
процесс
также являются политропическими.Для
идеального
газа
уравнение политропы может быть записано
в виде:pVn
= const
где величина
![]() называется
показателем политропы.В зависимости
от процесса можно определить значение
n:1. Изотермический процесс:n
= 1, так как PV1
= const,
значит PV
= const,
значит T
= const.2.
Изобарный процесс: n
= 0, так как PV0
= P
= const.3.
Адиабатный процесс: n
= γ, это следует
из уравнения
Пуассона.4.
Изохорный процесс:
называется
показателем политропы.В зависимости
от процесса можно определить значение
n:1. Изотермический процесс:n
= 1, так как PV1
= const,
значит PV
= const,
значит T
= const.2.
Изобарный процесс: n
= 0, так как PV0
= P
= const.3.
Адиабатный процесс: n
= γ, это следует
из уравнения
Пуассона.4.
Изохорный процесс:
![]() ,
так как
,
так как![]() ,
значитP1
/ P2
= (V2
/ V1)n,
значит V2
/ V1
= (P1
/ P2)(1
/ n),
значит, чтобы P1
и P2
обратились в 1, n должна быть бесконечность.
,
значитP1
/ P2
= (V2
/ V1)n,
значит V2
/ V1
= (P1
/ P2)(1
/ n),
значит, чтобы P1
и P2
обратились в 1, n должна быть бесконечность.
