
- •1. ОБЩИЕ МЕТОДЫ И ПРИЕМЫ АНАЛИЗА КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
- •5. АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ ГРУППЫ АЛИФАТИЧЕСКИХ АЛКАНОВ, ИХ ГАЛОГЕНО- И КИСЛОРОДОСОДЕРЖАЩИХ СОЕДИНЕНИЙ
- •9. АНАЛИЗ ПРОИЗВОДНЫХ ФЕНОЛОВ, ХИНОНОВ, АРОМАТИЧЕСКИХ КИСЛОТ, ФЕНОЛОКИСЛОТ, АРОМАТИЧЕСКИХ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
- •10. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ АРИЛАЛКИЛАМИНОВ
- •11. АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ ГРУППЫ БЕНЗОЛСУЛЬФОНИЛАМИДОВ
- •14. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ ХИНОЛИНА И ИЗОХИНОЛИНА
- •15. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ ПИРИМИДИНА
- •16. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ ПУРИНА
- •18. АНАЛИЗ ЛЕКАРСТВЕННЫХ СМЕСЕЙ В УСЛОВИЯХ АПТЕК
- •19. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ (фармакокинетические исследования лекарственных средств)
- •20. ВАЛИДАЦИЯ ФАРМАКОПЕЙНЫХ МЕТОДОВ

Тема 15. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ ПИРИМИДИНА
Лекарственные вещества данного класса являются производными гетероцикла пиримидина − 1,3-диазина:
N |
Пиримидин − слабое основание, растворим в |
N |
воде; t0 пл. 22,50 С, t0 кип. 1240 С. В медицине |
самостоятельного применения не имеет. |
|
пиримидин |
|
Фрагмент пиримидина является составной частью некоторых жизненно необходимых биологически активных веществ, например, нуклеотидов, витаминов группы В1. К веществам класса пиримидина относятся и многие синтетические лекарства, не являющиеся копиями природных соединений, а производных барбитуровой кислоты в природе вообще нет.
Классификация
Большинство синтетических лекарственных средств производных пиримидина можно разделить на следующие подгруппы:
1. производные (1Н,3Н,5Н)пиримидин-2,4,6-триона , или барбитура-
ты;
2.производные пиримидин-4,6-диона (гексамидин);
3.производные пиримидин-2,4-диона, или урацила (метилурацил, фторурацил, фторафур, азидотимидин);
4.производные пиримидин-2-она, или цитозина (цитарабин).
1. ПРОИЗВОДНЫЕ ПИРИМИДИН-2,4,6-ТРИОНА
По фармакологическому эффекту барбитураты разделяются на снотворные (барбитал, барбитал-натрий, фенобарбитал); наркозные (гексенал, тиопентал-натрий); противосудорожные (бензонал, фенобарбитал).
В основе структуры данных лекарственных средств лежит барбитуровая кислота, являющаяся продуктом конденсации мочевины и малоновой кислоты:
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
NH2 |
HO |
|
|
C |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
O |
|
|
|
|
|
|
|
|
|
|
|
N |
4 |
H |
|
C |
+ |
|
|
|
CH2 |
|
|
O |
|
2 3 |
|||
|
|
|
|
_ |
|
|
6 |
5 |
||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
NH2 |
|
|
|
|
|
2 H2O |
|
1 |
H |
|||
|
|
HO |
|
|
C |
|
|
|
|
N |
|
|||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
H |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
барбитуровая кислота; (1Н,3Н,5Н)пиримидин- 2,4,6-трион
489
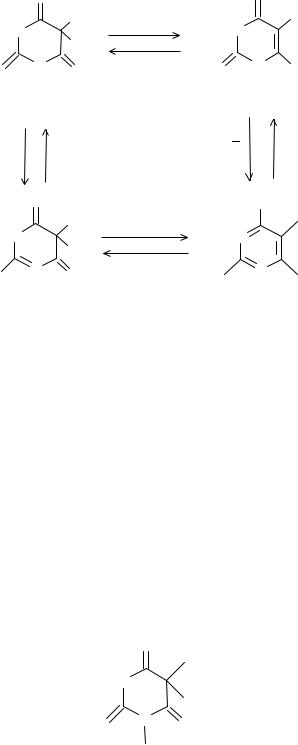
Барбитуровая кислота является циклическим уреидом, для которого возможны два типа изомерии: 1) кето - енольная и 2) лактим – лактамная:
|
O |
|
|
_ |
|
|
O |
H |
|
|
|
H |
|
|
|
||
HN 3 4 |
5 |
H |
OH |
|
HN |
|
|
|
2 |
1 |
6 |
H + |
|
|
|
|
|
|
|
|
N |
|
||||
O |
N |
|
O |
|
O |
OH |
||
H |
|
|
|
H |
||||
кето-форма |
|
|
енольная |
форма |
||||
(лактамная) |
|
|
|
|
|
|||
_ |
|
|
|
|
|
избыток |
|
+ |
|
|
|
|
|
ОН |
|
||
|
Н+ |
|
|
|
|
Н |
||
ОН |
|
|
|
|
|
|
|
|
|
O |
|
|
|
_ |
|
OH |
|
|
|
|
H |
избыток |
|
|
H |
|
НN |
|
|
ОН |
|
|
|||
|
|
|
N |
|
|
|||
|
|
H |
|
|
|
|
||
|
|
|
Н+ |
|
|
|
|
|
HO |
N |
|
O |
|
HO |
N |
OH |
|
|
|
|
|
|
||||
лактимная форма
Лекарственные средства, производные кислоты барбитуровой, представляют собой ее 5,5- дизамещенные, способные к лактим - лактамной таутомерии. Эта способность позволяет иметь два типа лекарственных веществ данной группы:
1)в кислотной форме (лактамной) и
2)в солевой форме (лактимной, водорастворимой).
Производные лактамной формы барбитуровой кислоты
Лекарственные вещества, относящиеся к этой подгруппе имеют общую формулу:
|
O |
|
|
HN 3 |
4 |
|
R1 |
5 |
R2 |
||
2 |
1 |
6 |
|
O |
N |
|
O |
|
|
||
|
R3 |
|
|
Общие свойства лекарственных веществ лактамной формы кислоты барбитуровой представлены в таблице 1.
490
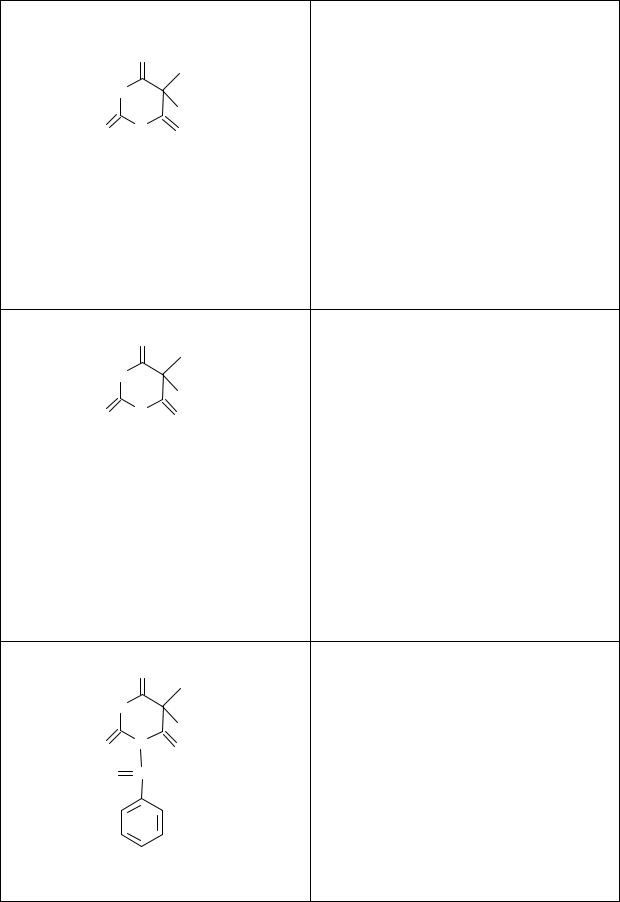
Таблица 1. Производные лактамной формы кислоты барбитуро-
вой
Химическая структура |
Описание |
||
|
O |
|
Barbitalum. Барбитал. |
|
C2H5 |
5,5-диэтилбарбитуровая кислота или |
|
HN 3 4 5 |
5,5-диэтил-2,4,6-(1Н,3Н,5Н)пирими- |
||
2 |
1 6 |
C2H5 |
динтрион. |
O |
N |
O |
Белый кристаллический порошок |
|
H |
без запаха, слабо горького вкуса. |
|
|
|
|
|
|
|
|
Мало растворим в воде, растворим в |
|
|
|
кипящей воде и спирте, легко рас- |
|
|
|
творим в растворах щелочей, трудно |
|
|
|
растворим в эфире и хлороформе. |
|
|
|
Лекарственная форма: порошки. |
|
|
|
Снотворное средство. |
|
O |
|
Phenobarbitalum. Фенобарбитал. |
|
C2H5 |
5-Этил-5-фенилбарбитуровая кисло- |
|
|
HN |
та или 5-этил-5-фенил-2,4,6- |
|
|
|
C6 H5 |
(1Н,3Н,5Н)пиримидинтрион. |
O |
N |
O |
Белый кристаллический порошок |
H |
|||
|
|
|
без запаха, слабо горького вкуса. |
|
|
|
Очень мало растворим в холодной |
|
|
|
воде, трудно растворим в кипящей |
|
|
|
воде и хлороформе, легко раство- |
|
|
|
рим в 95 % спирте и в растворах |
|
|
|
щелочей, растворим в эфире. |
|
|
|
Лекарственные формы: порошок, |
|
|
|
таблетки. |
|
|
|
Снотворное, противосудорожное. |
|
O |
|
Benzonalum. Бензонал. |
|
C2H5 |
1-Бензоил-5-этил-5-фенилбарбиту- |
|
HN |
|
ровая кислота |
|
|
|
||
|
|
C6 H5 |
Белый кристаллический порошок. |
O |
N |
O |
Очень мало растворим в воде, легко |
|
|||
O |
C |
|
растворим в хлороформе, растворим |
|
|
|
в эфире, трудно растворим в спирте. |
|
|
|
Лекарственные формы: порошок, |
|
|
|
таблетки |
|
|
|
Противоэпилептическое средство. |
491
O
C2 H5
HN |
|
|
|
|
|
|
|
|
O |
N |
CH2 |
CH2 |
|
CH |
|
CH3 |
|
|
||||||||
|
|
|||||||
O |
|
CH3 |
||||||
C |
|
|||||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
Benzobamilum. Бензобамил.
1-Бензоил-5-этил-5-изоамилбарби- туровая кислота.
Белый кристаллический порошок. Практически нерастворим в воде, легко растворим в спирте.
Лекарственная форма: таблетки. Противоэпилептическое средство.
Препараты лактимной (водорастворимой) формы барбитуратов отвечают общей формуле:
R3 |
O |
||
|
|
R1 |
|
|
|
||
|
N |
||
R 2
NaO N O
Таблица 2. Общие свойства лекарственных веществ лактимной формы барбитуратов
Химическая структура |
Описание |
|||||
|
O |
Barbitalum-natrium. Барбитал-на- |
||||
|
|
|
|
|
C2H 5 |
|
|
|
|
|
|
трий. |
|
|
HN |
|||||
|
|
|
||||
|
|
C2H5 |
5,5-Диэтилбарбитурат натрия или |
|||
|
|
|
|
|
||
|
|
|
|
|
||
NaO |
N O |
5,5-диэтил-2,4,6(1Н,3Н,5Н)пири- |
||||
|
|
|
|
|
|
мидинтриона мононатриевая соль. |
|
|
|
|
|
|
Белый кристаллический порошок |
|
|
|
|
|
|
без запаха, горького вкуса. Водный |
|
|
|
|
|
|
раствор имеет щелочную реакцию |
|
|
|
|
|
|
по фенолфталеину. |
|
|
|
|
|
|
Легко растворим в воде, мало рас- |
|
|
|
|
|
|
творим в |
|
|
|
|
|
|
95 % спирте, практически нераство- |
|
|
|
|
|
|
рим в эфире. |
|
|
|
|
|
|
Лекарственные формы: порошок, |
|
|
|
|
|
|
таблетки |
|
|
|
|
|
|
Снотворное средство. |
|
|
|
|
|
|
|
|
|
|
|
|
|
492 |

|
ONa |
CH3 |
Hexenalum. Гексенал. |
|
|
1,5-Диметил-5-(циклогексен-1-ил)- |
|
|
N |
|
|
|
|
барбитурат натрия или |
|
|
|
|
|
O |
N |
O |
1,5-Диметил-5-(циклогексен-1-ил)- |
|
2,4,6 (1Н,3Н,5Н)пиримидинтриона |
||
|
CH3 |
|
|
|
|
мононатриевая соль. |
|
|
|
|
|
|
|
|
Белая пенообразная масса. На воз- |
|
|
|
духе под влиянием углекислоты |
|
|
|
разлагается. Гигроскопичен.Очень |
|
|
|
легко растворим в воде и 95 % спир- |
|
|
|
те, практически нерастворим в эфи- |
|
|
|
ре и хлороформе. |
|
|
|
Лекарственная форма: порошок в |
|
|
|
герметически закрытых флаконах. |
|
|
|
Средство для внутривенного нарко- |
|
|
|
за. |
|
O |
|
C2H5 |
|
Thiopentalum-natrium. Тиопентал- |
|||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
CH2 CH3 |
натрий. |
|
HN |
|
HC |
|
CH2 |
|||||
|
|
|
Смесь натриевой соли 5-этил-5-(1- |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
+ Na2CO3 |
||||
Na S |
N |
|
метил- |
|||||||
|
O |
|||||||||
|
|
|
|
|
|
|
|
|
|
бутил)-2-тиобарбитуровой кислоты |
|
|
|
|
|
|
|
|
|
|
с безводным карбонатом натрия. |
|
|
|
|
|
|
|
|
|
|
Сухая пористая масса желтоватого |
|
|
|
|
|
|
|
|
|
|
или желтовато-зеленого цвета со |
|
|
|
|
|
|
|
|
|
|
своеобразным запахом. Гигроско- |
|
|
|
|
|
|
|
|
|
|
пичен. Водный раствор имеет ще- |
|
|
|
|
|
|
|
|
|
|
лочную реакцию. |
|
|
|
|
|
|
|
|
|
|
Легко растворим в воде, практиче- |
|
|
|
|
|
|
|
|
|
|
ски нерастворим в бензоле и эфире. |
|
|
|
|
|
|
|
|
|
|
Лекарственная форма: порошок в |
|
|
|
|
|
|
|
|
|
|
герметически закрытых флаконах. |
|
|
|
|
|
|
|
|
|
|
Средство для внутривенного нарко- |
|
|
|
|
|
|
|
|
|
|
за. |
493
Физико-химические свойства
Барбитал, барбитал-натрий, фенобарбитал и бензонал − белые кристаллические порошки; гексенал − белая пенообразная масса; тиопенталнатрий − пенообразная масса или порошок желтого или зеленоватого цвета.
Препараты кислотной (лактамной) формы очень мало или практически не растворимы в воде; растворимы в спирте, эфире, хлороформе; легко растворимы в разбавленных растворах щелочей и карбонатов.
Лекарства солевой (лактимной) формы легко растворимы в воде. Препараты кислотной формы имеют четкую температуру плавления. Все барбитураты имеют характерные спектры поглощения в УФ- и
ИКобластях.
Общая схема синтеза
Синтез барбитуратов включает несколько стадий.
1. Получение диэтилового эфира малоновой кислоты.
Так как малоновая кислота легко декарбоксилируется, на первой стадии получают ее диэтиловый эфир из натриевой соли циануксусной кислоты при действии на нее этиловым спиртом в кислой среде:
C |
|
N |
|
|
COOC2H5 |
|
|
|
|||
|
|
|
|||
|
|
|
|||
CH2 |
|
|
|
|
t 0 |
|
+ 2 C H OH |
+ H O |
CH2 |
||
|
2 |
5 |
2 |
H2SO4 |
|
COONa |
|
|
COOC2H5 |
||
|
|
|
|
|
|
2. Введение соответствующих заместителей в метиленовую группу.
Существует несколько способов получения замещенных малоновой кислоты. По одному из них соответствующие алкил- (или арил-) бромиды нагревают с полученным на первой стадии диэтиловым эфиром малоновой кислоты в присутствии натрия. Так, для получения барбитала действуют этилбромидом:
|
COOC2H5 |
|
H |
COOC2H5 |
|
|
C2H5 |
COOC2H5 |
CH |
|
C2H5Br |
C |
C H Br |
C |
|||
2 |
Na |
0 |
2 |
5 |
||||
|
|
Na, t |
0 |
|
||||
|
COOC2H5 |
, t |
C2H5 |
COOC2H5 |
C2H5 |
COOC2H5 |
||
|
|
|
|
|||||
Образующаяся на этой стадии часть моноэтилзамещенной малоновой кислоты может далее конденсироваться с мочевиной с образованием моно-
494

этилбарбитуровой кислоты, наличие которой проверяется в барбитале в соответствии с требованиями НД.
3. Конденсация с мочевиной:
C2H5 |
COOC2H5 |
H2N |
|
|
|
O |
|
|
|
|
|
t 0 |
C H |
N |
|||||
C |
+ |
C |
|
O |
2 5 |
|
|
ONa |
|
|
CH3ONa |
C2H5 |
|
|
|||||
|
|||||||||
C2H5 |
COOC2H5 |
H2N |
|
|
N |
||||
|
|
|
O |
H |
|||||
Реакция проводится в присутствии метилата натрия, поэтому препарат может содержать в качестве примеси метиловый спирт.
Далее на натриевую соль барбитала действуют разбавленной кислотой серной, переводя его в кислотную форму.
При получении солевой формы препарата на барбитал действуют разбавленным раствором натрия гидроксида. Поэтому в барбитале-натрии и других препаратах лактимной формы определяют в качестве примеси свободную щелочь.
Химические свойства и характерные типы реакций
Кислотные свойства
Вследствие лактам-лактимной таутомерии барбитураты являются слабыми кислотами или солями слабых кислот. При образовании солевой формы отрицательный заряд делокализуется с образованием амбидентного иона, так как образующаяся система более выгодна энергетически:
O
|
|
|
|
|
|
R |
|
|
HN |
. . |
|||
|
|
R |
||||
|
.... . ... . . . |
|||||
σ _ |
|
.... |
||||
O |
N |
|
O _ σ |
|||
Присоединение катиона металла может происходить как к атому кислорода, так и к атому азота. В соответствии с теорией Пирсона жесткие кислоты (Na+, K+, Mg2+), являющиеся акцепторами пары электронов, соединяются с жесткими основаниями (ОН−, RO−), а мягкие кислоты (Ag+, Cu2+, Hg2+), являющиеся донорами пары электронов, − c мягкими основаниями ( атом азота в пиридине или в аминогруппе). Поэтому натриевые соли барбитуратов следует писать связанными через атом кислорода, а в солях серебра или меди атомы металла связаны с атомом азота.
Барбитураты, обладая свойствами NH - кислот, вступают в реакции комплексообразования с солями тяжелых металлов (Cо2+, Cu2+, Ag2+). Ре-
495
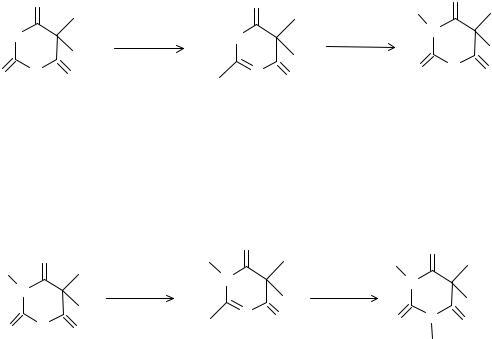
акцию с солями кобальта ГФ использует для установления подлинности всех барбитуратов, кроме тиопентала-натрия. Испытание проводят в спиртовой среде (для предотвращения гидролиза комплексной соли) с добавлением хлорида кальция, способствующего образованию более устойчивого комплекса. Препараты лактамной (кислотной) формы предварительно переводят в лактимную (солевую) форму добавлением эквивалентного количества (без избытка!) 0,1 М раствора натрия гидроксида. Данная реакция является общегрупповой, так как все барбитураты образуют одинаково окрашенные в сине - фиолетовый цвет комплексные соли.
Взаимодействие барбитуратов с сульфатом меди приводит к различно окрашенным комплексным соединениям, что делает испытание более специфичным. ГФ регламентирует коплексообразование с сульфатом меди для определения подлинности всех лекарственных препаратов группы барбитуратов. Успешное проведение реакций (также, как при получении комплексов с солями кобальта) зависит от тщательного соблюдения условий конкретных методик.
С солями серебра барбитураты образуют нерастворимые соли белого цвета. Барбитал, барбитал-натрий, фенобарбитал реагируют с нитратом се-
ребра в две стадии: |
1) образование монозамещенной серебряной соли, |
||||||||
растворимой в избытке карбонaта натрия и |
2) получение нерастворимой |
||||||||
дизамещенной соли при добавлении избытка реактива: |
|
|
|||||||
|
O |
|
|
O |
|
Ag |
O |
|
|
|
R1 |
|
|
|
R1 |
||||
|
|
|
|
R1 |
|
||||
|
HN |
Na2CO3 |
HN |
N |
|
||||
|
R2 |
R 2 |
AgNO3 |
|
R2 |
||||
|
N |
|
N |
O |
N |
||||
O |
|
NaO |
|
O |
|||||
O |
O |
H |
|||||||
H |
|
|
|
||||||
Постепенное прибавление по каплям раствора нитрата серебра приводит к помутнению, исчезающему при встряхивании. Дальнейшее добавление реактива приводит к образованию белого осадка двузамещенной соли:
|
O |
|
|
|
Ag |
O |
R1 |
Ag |
O |
|
|
Ag |
R1 |
|
|
|
R1 |
||||||
|
|
|
|
N |
|||||||
N |
|
Na CO |
3 |
|
R |
AgNO3 |
|
N |
|
||
|
|
|
|
|
|
||||||
|
R2 |
2 |
|
N |
2 |
|
R |
2 |
|||
|
|
|
|
|
NaO |
|
|
|
|
N O |
|
O |
N |
O |
|
|
|
O |
|
O |
|
||
H |
|
|
|
|
|
|
|
Ag |
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Бензонал и гексенал образуют монозамещенные нерастворимые серебряные соли белого цвета.
496
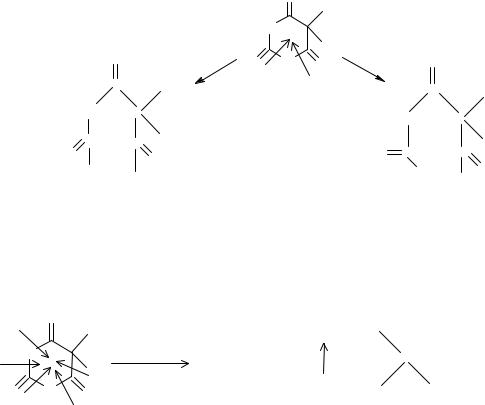
Гидролитическое расщепление
Общим свойством барбитуратов, как циклических уреидов, является также их способность к гидролитическому расщеплению в различных условиях. Так, в относительно мягких условиях (например, при длительном хранении в присутствии влаги и повышенной температуре), возможен разрыв амидных связей в положениях 1-2 и 1-6 с образованием уровых кислот:
O
|
|
HN 3 4 |
5 |
R1 |
|
|
|
|
|
|
R2 |
|
|
|
|||
O |
|
2 |
1 |
6 |
O |
|
|
|
|
O |
N |
|
O |
|
|
||
C |
|
H |
|
|
|
|
||
|
R1 |
|
|
|
C |
|
R1 |
|
|
|
|
|
|
|
|||
N |
C |
|
|
|
|
HN |
|
|
|
|
|
|
C |
|
|||
|
|
R2 |
|
|
|
|
||
C |
C |
|
|
|
O C |
C |
R2 |
|
O |
|
O |
|
|
|
|
||
|
|
|
|
|
|
O |
||
O |
|
|
|
|
N |
|
||
N |
|
|
|
|
O |
|||
|
|
|
|
|
|
|
||
В жестких условиях, например, при сплавлении барбитурата с кристаллической щелочью, происходит более полная деструкция молекулы:
|
O |
|
|
|
|
|
|
R1 |
O |
|
|
|||
|
|
|
R |
|
|
|
|
|
|
|||||
|
HN 3 4 |
|
1 |
5 NaOH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
C |
|
|
|
|
|
|
|||
|
5 |
R2 |
2 Na2CO3 + 2NH3 |
+ |
|
C |
|
ONa |
||||||
|
|
|
||||||||||||
|
2 1 |
6 |
t 0 |
R2 |
|
|
|
|
|
|
||||
O |
N |
|
O |
|
|
|
|
H |
|
|
||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
натриевая соль дизамещенной уксусной кислоты
Добавление к продуктам реакции избытка соляной кислоты приводит к образованию углекислого газа и дизамещенной уксусной кислоты, обладающей характерным запахом.
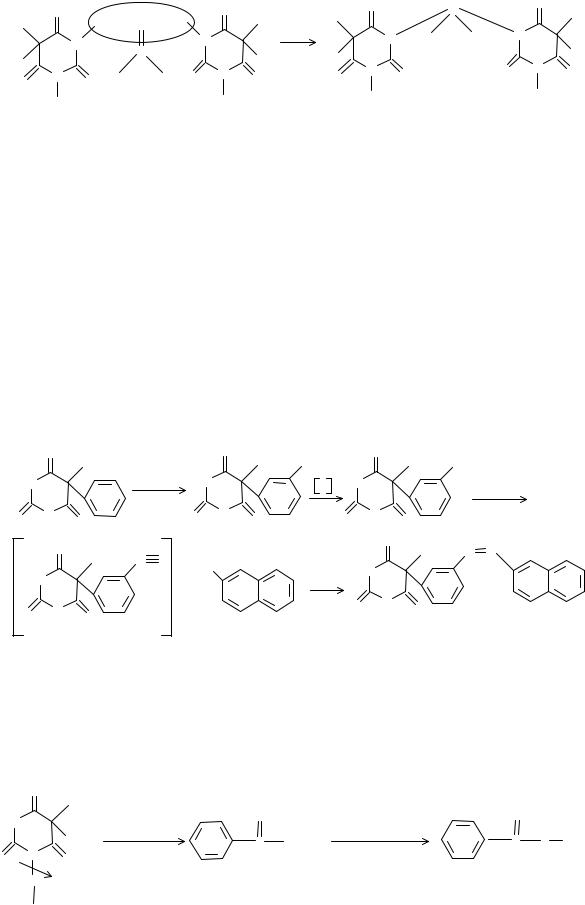
Конденсация с ароматическими альдегидами
Барбитураты способны также к конденсации с альдегидами в присутствии концентрированной серной кислоты как водоотнимающего и окислительного реагента. При выборе соответствующего альдегида и условий можно получить специфически окрашенные продукты, позволяющие идентифицировать отдельные лекарственные вещества:
497
|
O |
|
|
|
O |
|
|
|
O |
|
C |
|
O |
|
|
H |
O |
H |
R1 |
R1 |
|
|
|
R1 |
|||||
R1 |
N |
N |
N |
R |
|
H |
N |
|||||||
|
+ |
C |
+ |
R |
_ H2O |
R |
|
|
R2 |
|||||
R2 |
|
|
|
|
|
|
||||||||
N |
|
R конц.H |
O |
N |
|
2 |
2 |
N |
O |
|
|
O N |
O |
|
O |
O |
O |
|
O |
|
|
||||||||
|
|
H |
|
|
H |
|
||||||||
|
H |
|
H2SO4 |
|
H |
|
|
|
|
|
|
|
||
Фенобарбитал с формальдегидом образует продукт розового цвета, а барбитал − желтого. В качестве реагента используют также различные ароматические альдегиды, например, пара-диметиламинобензальдегид.
Частные реакции
Частные реакции обусловлены особенностями химического строения отдельных лекарственных веществ группы барбитуратов, главным образом, наличием заместителей в положениях 1 и 5.
Фенобарбитал имеет в положении 5 фенильный радикал, по которому возможны реакции SE, например, нитрование с последующим восстановлением нитрогруппы, диазотированием и азосочетанием:
|
O |
|
|
|
|
O |
C2H5 NO2 |
|
O |
C2H5 NH2 |
|
|
C2H5 |
кристал. |
HN |
HN |
|||||
HN |
|
|
NaNO |
H |
NaNO2 |
|||||
|
|
H SO |
3 |
|
|
|
||||
|
|
|
конц. |
|
|
|
|
|
||
|
N |
|
2 |
4 |
O |
N |
|
O |
N |
HCl |
O |
O |
|
|
O |
||||||
H |
|
|
H |
H |
O |
|||||
|
O |
|
+ |
|
|
_ |
|
|
O |
N N |
|
|
|
N |
|
|
|
||||
|
|
C H |
N |
|
|
|
|
C2H5 |
||
|
|
5 |
|
|
O |
|
|
HN |
|
|
HN |
|
2 |
|
_ |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Cl |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
||
|
N |
|
|
|
|
|
|
O |
O |
|
O |
O |
|
|
|
|
|
H |
|||
H |
|
|
|
|
|
|
азокраситель вишнево-красного цвета |
|||
Фрагмент бензойной кислоты в бензонале открывают после гидролиза взаимодействием с солями трехвалентного железа (появляется осадок оранжево-желтого цвета). По амидной группе препарат вступает в реакцию гидроксамовой пробы:
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
HN |
C2H5 |
NH OH . HCl |
O |
FeCl |
|
|
|
O |
|
|
||||
|
|
|
|
|
|||||||||||
|
C6 H5 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
2 |
C N |
|
OH |
+ |
3 |
_ |
|
C N O |
Fe |
||
|
|
|
|
|
|
||||||||||
|
|
|
N |
|
NaOH, pH =10 |
H |
|
|
H |
|
|||||
O |
|
|
O |
H, pH =1,5 |
2,0 |
|
|
||||||||
|
|
|
|
гидроксамовая кислота |
|
|
|
|
|
|
3 |
||||
|
O |
|
C |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
C6H5 |
|
|
|
|
|
|
|
|
|
|
|
|
498

Гидроксаматы железа представляют собой растворы красно-фиоле- тового цвета, а гидроксаматы Cu2+ − осадки бирюзового цвета.
Гексенал, имеющий в молекуле фрагмент циклогексена, способен к реакциям присоединения и, поэтому, обесцвечивает бромную воду:
|
ONa |
CH3 |
ONa |
CH |
|
|
|
|
|
||
|
|
|
|
3 |
Br |
|
N |
|
N |
|
|
|
+ |
|
Br |
||
|
N |
Br2 |
|
|
|
O |
O |
O N |
O |
|
|
|
|
||||
|
CH3 |
|
CH |
|
|
|
|
|
3 |
|
|
В тиопентале-натрии атом сульфидной серы можно обнаружить по черному осадку, образующемуся при взаимодействии препарата с солями тяжелых металлов.
У препаратов лактимной (солевой) формы определяют ионы натрия и температуру плавления кислотных форм после осаждения последних раствором соляной кислоты.
Контроль чистоты
Испытания на чистоту препаратов группы барбитуратов обусловлены их химическими свойствами и способами синтеза. Определение прозрачности проводят как для солевых, так и для кислотных форм барбитуратов. При испытании прозрачности кислотных форм используют их растворимость в карбонате натрия. Некоторые полупродукты синтеза и сопутствующие вещества не растворяются в карбонатах.
Изменение этого показателя для солевых форм обусловлено их возможным взаимодействием с оксидом углерода (IV) и влагой воздуха с образованием при этом нерастворимой кислотной формы:
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
R1 |
|
|
|
R |
1 |
CO2 |
+ H2O |
|
HN |
|
|
HN |
|
|
|
||||
|
R 2 |
|
R2 + NaHCO3 |
|||||
|
N |
|
|
O |
N |
|||
NaO |
O |
|
|
|
O |
|||
|
|
|
H |
|||||
У барбитала и фенобарбитала проверяют наличие моноалкилзамещенных производных барбитуровой кислоты (соответственно, этилбарбитуровой и фенилбарбитуровой). При наличии этих примесей, обладающих более выраженными кислотными свойствами, чем лекарственные вещеста группы барбитуратов, изменяются значения рН.
499
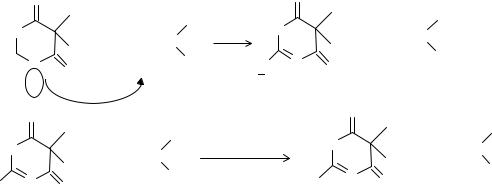
Возможную (допустимую до регламентированного ГФ) примесь свободной щелочи определяют титрованием в определенных условиях у препаратов солевой формы.
В гесенале и тиопентал-натрии определяют допустимую до определенного предела примесь метанола. Метанол попадает в препарат при синтезе на стадии конденсации мочевины с дизамещенной малоновой кислотой, где в качестве катализатора используют метилат натрия. При определении примеси метанол окисляют перманганатом калия до формальдегида, который далее конденсируют с кислотой хромотроповой. Интенсивность окраски образовавшегося продукта сравнивают с окраской эталонного раствора.
Методы количественного определения
Препараты лактамной (кислотной) формы количественно определяют методом кислотно-основного титрования. В качестве протофильного растворителя используют диметилформамид. Титрант − 0,1 М раствор натрия гидроксида в смеси метанола и бензола; индикатор − тимоловый синий:
O
HN
O N H
N H
O
HN
_O N
R1 |
|
|
|
|
|
|
|
|
|
|
CH3 |
HN |
|||
|
|
+ |
H |
|
|
|
|
|
C |
|
N |
|
|||
R |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||||||
2 |
|
|
|
|
|
|
|
|
|
|
CH3 |
O |
|||
O |
|
|
|
|
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|||||||
R1 |
|
|
|
|
|
|
|
|
|
|
CH3 |
+ NaOH; 0,1M |
|||
R |
|
+ H |
|
|
C |
|
|
|
|
N |
|
|
метанол, |
||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
2 |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
бензол |
|
O |
|
|
+ O H |
|
|||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
|
|
CH3 |
|
||||||
|
R |
+ H |
|
|
C |
|
N |
|
|||||||
|
|
|
|
|
|||||||||||
N |
|
2 |
+ |
|
|
|
|
|
CH3 |
|
|||||
O |
|
|
O H |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HN |
|
R1 |
|
|
|
|
|
|
|
CH3 |
||||
|
|
R2+ |
H |
|
|
C |
|
N |
+ H O |
||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
2 |
||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
CH3 |
||
Na O |
|
O |
O |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
По методике ФС на фенобарбитал лекарственное вещество растворяют в ацетоне или спирте, прибавляют необходимое количество воды и титруют 0,1М раствором натрия гидроксида в присутствии индикатора тимолфталеина. Применение данной методики показывает, что фенобарбитал обладает достаточно выраженными кислотными свойствами и может достоверно количественно определяться и в водной среде. Ацетон (или спирт) препятствуют гидролизу образующейся при титровании соли.
Препараты солевой формы количественно определяют ацидиметрически. Навеску препарата растворяют в свежепрокипяченной воде (для удаления следов углекислоты) и титруют 0,1 М раствором хлороводородной кислоты в присутствии индикатора метилового оранжевого до розового окрашивания. При наличии в препарате свободной щелочи (опреде-
500
ляемой при испытании на чистоту) из найденного процентного содержания вычитают процентное содержание свободной щелочи, умноженное на соответствующий для каждого препарата коэффициент.
Другими методами количественного определения барбитуратов являются аргентометрия (в прямом и обратном вариантах), гравиметрия. Гексенал можно определить количественно броматометрически по фрагменту циклогексена.
Для количественного определения индивидуальных препаратов группы барбитуратов и, особенно, для их лекарственных форм применяют фи- зико-химические методы анализа (ВЭЖХ, спектрофотметрия).
2.ПРОИЗВОДНЫЕ ПИРИМИДИН-4,6-ДИОНА
Кданной группе лекарственных веществ относится препарат “Гексамидин (Hexamidinum)”, являющийся 5-этил-5-фенилгексагидро- пиримидиндионом-4,6:
O
C2H5
HN
C6 H5
N
H O
гексамидин
По химической структуре гексамидин близок к фенобарбиталу, но не является барбитуратом, так как в его молекуле отсутствует фрагмент мочевины. Модификация молекулы привела к созданию препарата с выраженным противосудорожным действием и меньшим, по сравнению с фенобарбиталом, снотворным эффектом. Лекарственная форма − таблетки.
Физико-химические свойства
По внешнему виду гексамидин представляет собой белый кристаллический порошок без запаха. Практически не растворим в воде, эфире и бензоле, мало растворим в спирте и ацетоне.
Химические свойства и реакции подлинности
Обладая амидными группами, гексамидин проявляет кислотные свойства. Однако выражены они слабее, чем у фенобарбитала, являющегося имидом. Гексамидин растворяется в щелочах, но образующиеся соли
501
неустойчивы. Из-за слабо выраженных кислотных свойств препарат не образует характерных комплексных соединений с солями тяжелых металлов.
Гидролитическое расщепление
Как и другие амиды гексамидин подвержен гидролитическому расщеплению, которому способствуют повышение температуры и щелочная среда. По ГФ Х испытание подлинности проводят при нагревании порошка препарата с кристаллическим гидроксидом натрия. Выделяющийся при реакции аммиак окрашивает влажную лакмусовую бумагу в синий цвет.
Другим продуктом гидролиза является формальдегид, образующийся из метиленовой группы. При нагревании навески порошка препарата с раствором динатриевой соли хромотроповой кислоты в присутствии серной кислоты появляется сиреневое окрашивание. Аналогично выделяют формальдегид при гидролизе гексаметилентетрамин, стрептоцид растворимый, дихлотиазид.
Количественное определение
Так как кислотные свойства гексамидина выражены в значительно меньшей степени, чем у фенобарбитала, применение кислотно-основного титрования для количественного определения препарата некорректоно. Поэтому гексамидин количественно определяют по содержанию азота методом Кьельдаля.
3. ПРОИЗВОДНЫЕ ПИРИМИДИН-2,4-ДИОНА (УРАЦИЛА)
Урацил и его гомолог тимин являются нуклеиновыми основаниями, входящими в состав нуклеиновых кислот в виде нуклеозидов и нуклеотидов. На основе урацила и тимина путем модификации их структуры синтезирован ряд лекарственных веществ, являющихся метаболитами (метилурацил) и антиметаболитами (фторурацил, фторафур, цитарабин) нуклеиновых оснований. Препараты-антиметаболиты ингибируют синтез ДНК и применяются как противоопухолевые средства.
Физико-химические свойства
Метилурацил, фторафур, цитарабин и азидотимидин − белые порошки; для фторурацила допускается желтоватый оттенок.
Влактамной (кислотной) форме препараты мало растворимы в воде, а
ввиде натриевых солей − легко растворимы.
502
Все указанные препараты имеют четкие интервалы температуры плавления (в лактамной форме), харктерные ИК- и УФспектры поглощения.
Таблица 3. Производные пиримидин-2,4-диона
Химическая структура |
|
Описание |
|
||||||
|
O |
|
|
|
|
Methyluracilum. Метилурацил |
|||
|
|
|
|
|
|||||
HN |
|
|
|
|
|
|
2,4-Диоксо-6-метил-1,2,3,4- |
||
|
|
|
|
|
|
||||
|
|
|
|
|
|
CH3 |
тетрагидропиримидин. |
|
|
O |
|
|
|
|
|
Белый |
кристаллический |
порошок |
|
N |
|||||||||
|
H |
без запаха. Мало растворим в воде. |
|||||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Стимулятор лейкопоэза, ранозажив- |
||
|
|
|
|
|
|
|
ляющее |
и противовоспалительное |
|
|
|
|
|
|
|
|
средство. |
|
|
|
|
|
|
|
|
|
Лекарственная форма: таблетки |
||
|
|
|
|
|
|||||
|
|
O |
|
|
|
Phtoruracilum. Фторурацил |
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
F |
2,4-Диоксо-5-фторпиримидин или 5- |
||
HN |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
фторурацил |
|
|
O |
|
N |
Белый или белый с желтоватым от- |
||||||
|
|
H |
тенком |
кристаллический |
порошок. |
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Мало растворим в воде, очень мало |
||
|
|
|
|
|
|
|
− в спирте. |
|
|
|
|
|
|
|
|
|
Противоопухолевое средство. |
||
|
|
|
|
|
|
|
|||
|
|
|
O |
Phthorafurum. Фторафур |
|
||||
|
|
|
|
|
|
F |
|
||
|
|
|
|
|
|
N’ - (2-фуранидил)-5-фторурацил |
|||
HN |
|
|
|
|
|
|
|||
|
|
|
N |
Белый |
кристаллический |
порошок |
|||
O |
|
|
без запаха. Трудно растворим в воде |
||||||
O |
|
|
|
|
|
|
и спирте. Натриевая соль раствори- |
||
|
|
|
|
|
|
|
ма в воде. |
|
|
|
|
|
|
|
|
|
Лекарственные формы: капсулы и |
||
|
|
|
|
|
|
|
раствор для инъекций. |
|
|
|
|
|
|
|
|
|
Противоопухолевое средство. |
||
|
|
|
|
|
|
|
|
|
|
503
|
|
NH2 |
Cytarabinum. Цитарбин. |
|
|
N |
4-Амино-1-(β -D-арабинофуранозил)- |
|
|
O N |
1,2-дигидропиримидин. |
|
|
Белый кристаллический порошок |
|
HO |
|
CH2 O |
без запаха. Растворим в воде, прак- |
|
|||
|
|
HO |
тически нерастворим в спирте и |
|
|
OH |
хлороформе. |
|
|
Лекарственная форма: лиофилизи- |
|
|
|
|
|
|
|
|
рованный порошок во флаконах. |
|
|
|
Противоопухолевое средство. |
|
|
O |
|
CH3 |
Azidothymidinum. Азидотимидин. |
|
|
|
|
|
|
||
|
|
|
|
|
(Ретровир, Зидовудин, Тимазид) |
|
|
|
HN |
||||
|
|
|
||||
|
|
|
|
|
|
3’- Азидотимидин. |
|
|
O N |
|
Белый кристаллический порошок |
||
|
|
|
|
|
|
без запаха. Растворим в воде, нерас- |
HO H2C O |
|
|||||
|
творим в спирте и хлороформе. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Лекарственные формы: капсулы, |
|
|
N3 |
|
раствор для инфузий, сироп. |
||
|
|
|
Средство для лечения ВИЧ, СПИДа. |
|||
|
|
|
|
|
|
|
Кислотно-основные свойства
Как и другие имиды, лекарственные вещества группы пиримидин-2,4- диона являются NHкислотами. В кислотной форме указанные препараты применяют в пероральных лекарственных формах, а в солевой − в растворах для инъекций и инфузиях.
Подобно другим NHкислотам (например, барбитуратам) лекарственные вещества группы урацила взаимодействуют с солями Cu2+ и Co2+ с образованием окрашенных осадков, а с солями Ag+ − белые.
Однако, по силе кислотных свойств препараты группы урацила уступают угольной. Поэтому соприкосновение растворов натриевых солей препаратов группы урацила с оксидом углерода (IV) может привести к образованию нерастворимых кислотных форм и, следовательно, к нарушению прозрачности растворов.
504

Реакции гидролитического расщепления
Как и барбитураты, препараты группы урацила подвержены разложению с разрывом амидных связей. Процесс ускоряется при повышении температуры и в присутствии щелочей. Нагревание препаратов с концетрированным раствором натрия гидроксида, в результате чего образуется аммиак, обнаруживаемый по посинению влажной лакмусовой бумаги, можно использовать для определения подлинности и количественного определения указанной группы препаратов методом Кьельдаля.
Реакции электрофильного замещения
Препараты группы урацила взаимодействуют с бромом с образованием соответсвующих бромпроизводных. Реакцию применяют для определения подлинности индивидуального метилурацила в порошке и в мази.
|
O |
|
|
O |
|
||||
HN |
|
HN |
|
|
|
Br |
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
+ |
|
|
|
+ HBr |
||
|
|
|
Br2 |
|
|
|
|||
|
|
|
|
N |
CH3 |
||||
|
N |
CH3 |
O |
||||||
O |
H |
||||||||
|
H |
|
|
|
|
|
|
||
Данную реакцию можно использовать и для количественного броматометрического количественного определения метилурацила и других препраратов группы урацила.
К SE реакциям отностится и образование азокрасителей с солями диазония:
|
O |
|
+ |
|
|
|
|
|
|
N N |
|
O |
|
|
|
|
|
|
|
|
N N |
|
|
HN |
|
|
_ |
HN |
|
R |
|
|
+ |
Cl |
|
|
|
||
|
|
|
|
|
|||
O |
N |
CH3 |
|
O |
N |
CH3 |
|
H |
|
|
|||||
|
|
|
R |
|
H |
|
|
|
|
|
|
|
|
|
Данной реакцией определяют подлинность метилурацила в мази.
Частные реакции
У фторурацила и фторафура подтверждают наличие связанного фтора после минерализации. При сухой минерализации навеску препарата прока-
505
ливают со смесью для спекания, содержащую карбонат натрия и нитрат калия (1:1), остаток растворяют в воде и добавляют раствор хлорида кальция. Выпадает белый осадок кальция фторида:
Ca2+ + 2 F − = CaF2 ↓
После сжигания в атмосфере кислорода фторидионы, поглощенные раствором пероксида водорода, обесцвечивают красного цвета раствор железа (III) тиоцианата:
Fe(SCN)3 + 6 F − = [FeF6] 3− + 3 SCN −
Часто фторидионы доказывают с помощью цирконий - ализаринового реактива. При этом красный цвет цирконий - ализаринового комплекса переходит в желтый (ализарин).
Чистота
Примесь урацила и близких по строению веществ определяют с помощью ВЭЖХ и ТСХ.
Примесь свободных фторидов обнаруживают на ион - селективных электродах.
Контролируют также прозрачность и цветность растворов препаратов группы урацила.
Количественное определение
Общими методами количественного определения препаратов группы урацила являются:
1.Кислотно - основное титрование в неводных средах
2.Косвенный метод нейтрализации
3.Аргентометрия
4.Броматометрия
5.Физико-химические методы (спектрофотометрия, фотоэлектроколориметрия, ВЭЖХ и др.).
506
