
- •1. ОБЩИЕ МЕТОДЫ И ПРИЕМЫ АНАЛИЗА КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
- •5. АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ ГРУППЫ АЛИФАТИЧЕСКИХ АЛКАНОВ, ИХ ГАЛОГЕНО- И КИСЛОРОДОСОДЕРЖАЩИХ СОЕДИНЕНИЙ
- •9. АНАЛИЗ ПРОИЗВОДНЫХ ФЕНОЛОВ, ХИНОНОВ, АРОМАТИЧЕСКИХ КИСЛОТ, ФЕНОЛОКИСЛОТ, АРОМАТИЧЕСКИХ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
- •10. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ АРИЛАЛКИЛАМИНОВ
- •11. АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ ГРУППЫ БЕНЗОЛСУЛЬФОНИЛАМИДОВ
- •14. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ ХИНОЛИНА И ИЗОХИНОЛИНА
- •15. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ ПИРИМИДИНА
- •16. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ ПУРИНА
- •18. АНАЛИЗ ЛЕКАРСТВЕННЫХ СМЕСЕЙ В УСЛОВИЯХ АПТЕК
- •19. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ (фармакокинетические исследования лекарственных средств)
- •20. ВАЛИДАЦИЯ ФАРМАКОПЕЙНЫХ МЕТОДОВ
Тема 14. АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ГРУППЫ ХИНОЛИНА И ИЗОХИНОЛИНА
1. ПРОИЗВОДНЫЕ ХИНОЛИНА
Хинолин − бенз[b]пиридин − содержится (наряду с хинуклидином) в молекуле алкалода хинного дерева хинина. В коре хинного дерева кроме хинина содержится еще около 30 алкалоидов.
В 1792 г. А.Ф. Фуркруа (Fourcroy) и в 1809 г. Л.Н. Воклен
(Vauqelin) ввели в медицинскую практику препарат “хина”, являющийся суммой неочищенных алкалоидов коры хинного дерева. В 1842 г. Ш.Ф. Жерар (Gerhardt) получает хинолин при гидролизе хинина. Истинную структуру хинина установили Кениг (Коnig) и З.Х. Скрауп (Skraup) в 1880 г. После установления структуры хинина, был проведен ряд целенаправленных синтезов противомалярийных, антибактериальных и др. лекарственных средств.
Большинство лекарственных веществ производных хинолина можно разделить на следующие группы:
1.Производные цинхонана (соли хинина, хинидин)
2.Производные 8-оксихинолина (хинозол, нитроксолин, хлорхинальдол, энтеросептол)
3.Производные 4-аминохинолина (хингамин, трихомонацид)
4.Производные 4-хинолона (офлоксацин, норфлоксацин, ципрофлоксацин).
ПРОИЗВОДНЫЕ ЦИНХОНАНА
Гетероциклическая система цинхонана лежит в основе химического строения хинина и его оптического изомера хинидина.
|
5 |
|
|
|
|
|
|
4 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
7 |
* |
3 CH |
|
CH2 |
||
N |
|
|
|
|
|
|
8 * |
|
|
|
|
|
|
1 |
|
2 |
|
|
|
|
9 |
|
|
|
|
|
|
H2C
5' |
4' |
|
6' |
|
3' |
7' |
N |
2' |
|
||
8' |
|
|
1' |
|
Цинхонан состоит из хинолинового ядра,связанного через метиленовый мостикс хинуклидиновым ядром, имеющим винильную группу.
Хинуклидиновый фрагмент содержит три асимметрическихуглеродных атома.
цинхонан
466
Хинин (и его правовращающий изомер хинидин) является 9-Окси-6’- метоксицинхонаном. У хинина появляется четвертый асимметричный атом углерода.
Препараты хинина применяются в качестве антималярийных, антипиретических лекарственных средств. Хинин также является стимулятором мускулатуры матки.
Хинидин − антиаритмическое средство.
|
|
|
|
|
5 |
|
|
|
Хинин является двукислотным основанием и, |
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
4 |
|
|
|
поэтому, может образовывать одно- и дву- |
|
|
7 |
|
* |
|
|
|
||
|
HO |
|
N * 3 CH |
CH2 |
замещенные соли. Более выраженным центром |
||||
|
8 |
* |
|||||||
|
1 2 |
|
|
основности является ядро хинуклидина, где |
|||||
|
|
* |
|
|
|
||||
|
H |
|
C 9 |
|
|
|
|
|
неподеленная пара электронов локализована на |
|
|
|
|
|
|
|
|||
CH3O |
5' |
4' |
3' |
|
|
|
|
гетероатоме азота. |
|
6' |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
7' |
|
N |
2' |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
8' |
|
|
|
|
|
|
|
|
|
1' |
хинин |
|
|
|||||
|
|
|
|
|
|
||||
В ГФ включены cледующие |
лекарственные вещества: Хинина гид- |
||||||||
рохлорид(Chinini hydrochloridum), Хинина сульфат (Chinini sulfas) и
Хинина дигидрохлорид (Chinini dihydrochloridum).
HO
H
CH3O 5' 6' 7'
8'
HO
H
CH3O 5' 6' 7'
8'
|
|
5 |
|
|
|
|
|
|
|
4 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
7 |
* |
* |
|
CH |
CH2 |
||
|
3 |
||||||
8 |
N+ |
|
|||||
* 1 H |
2 |
|
|
|
|||
* |
|
|
|
|
|||
C 9 |
|
|
|
|
|
|
|
4' |
3' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
2' |
|
|
|
|
|
|
|
|
|
|
|
|
||
1' |
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
6 |
|
|
||
|
|
|
4 |
|
|
|
|
|
|
7 |
* |
|
|
CH |
|
|
|
* |
3 |
||||
|
|
8 * |
N+ |
|
|||
* |
1H 2 |
|
|||||
|
C 9 |
|
|
|
|
|
|
|
|
|
|
|
|
||
4'
|
3' |
N |
2' |
|
|
1' |
|
Хинина гидрохлорид - Гидрохлорид 9-окси- 6'-метоксицинхонана дигидрат или 6'-метоксихинолил-(4')-[5-винилхинукли-
_ дил-(2)]-карбинола гидрохлорид, дигидрат. Cl . 2H2O Однозамещенная соль хинина. Белый мелкокристаллический порошокбез запаха, очень горького вкуса. Растворим в воде, рНводно-
го раствора 6,0 - 7,0.
|
|
|
|
|
Хинина сульфат - 9-окси-6'- |
CH2 |
|
|
метоксицинхонана сульфат, |
||
|
|
дигидрат или 6'-метокси- |
|||
|
|
|
SO2 |
_ |
(4')-[5-винилхинуклидил-(2)]- |
|
|
|
карбинола сульфат, дигидрат. |
||
|
|
|
. 2 H O |
||
|
|
|
4 |
2 |
Белый мелкокристаллический |
|
|
|
|
|
порошокбез запаха, очень горь- |
|
|
|
|
|
кого вкуса. Мало растворим в |
|
|
|
2 |
|
воде, рН суспензии 5,7 - 6,6. |
|
|
|
|
Однозамещенная соль хинина. |
|
|
|
|
|
|
|
467
HO
H
CH3O 5' 6'
7'
8'
|
|
|
|
5 |
|
|
|
|
6 |
|
|
|
|
4 |
|
|
7 |
|
* |
|
|
|
N+* |
|
|
|
8 |
* |
|
|
* |
1H |
||
|
C 9 |
|
|
|
|
|
|
||
|
|
4' |
3' |
|
|
|
|
|
|
|
+ |
|
2' |
|
1' |
N |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
Хинина дигидрохлорид - 9-окси- |
|
CH |
CH2 |
|
6'-метоксицинхонана дигидрохлорид |
||
3 |
|
или 6'-метокси-(4')-[5-винилхинук- |
||||
2 |
|
|
|
|
_ |
лидил-(2)]-карбинола дигидрохлорид. |
|
|
|
|
|
2Cl |
Белый кристаллический порошокбез |
|
|
|
|
|
|
запаха, очень горького вкуса. Очень |
|
|
|
|
|
|
легко растворим в воде, рНводного |
|
|
|
|
|
|
растовра 4,0 - 6,4. |
|
|
|
|
|
|
Двузамещенная соль хинина. |
Лекарственные формы: порошки и таблетки хинина сульфата и гидрохлорида, раствор хинина дигидрохлорида 50% для инъекций.
Химические свойства и анализ качества
Как соли азотистых оснований препараты хинина взаимодействуют с общеалкалоидными осадительными реактивами.
Общегрупповой реакцией алкалоидов группы 6’-метоксицинхонана является талейохинная проба. Другие алкалоиды хинной корки, не имеющие заместителей в 6’-положении в эту реакцию не вступают. Для проведения реакции к водному раствору соли хинина добавляют хлорную или бромную воду, а затем разбавленный раствор аммиака; появляется зеленое окрашивание.
Механизм реакции заключается в окислении и галогенировании хинолинового фрагмента с образованием 5,5-дибром-6-оксохинолинпроизвод- ного, его дальнейшей гидратации, изомеризации, конденсации с амммиаком, в результате чего получается оксоноловый краситель зеленого цвета:
|
R |
|
|
|
R |
|
|
|
R |
|
C H 3O |
|
|
B r |
|
B r |
|
H O |
O H |
|
|
|
|
O |
|
|
H 2 O |
O |
|
|
|
|
|
|
B r2 |
|
|
|
|
|
|
||
|
N |
H |
2O |
|
N |
|
|
III |
N |
|
R = хинуклидиI новый |
|
- |
|
II |
|
5 ,5 -диокси- 6 - |
|
|||
фрагмент хинина |
|
5 ,5 - дибром- 6 - |
|
|
||||||
|
оксохинолин |
|
оксохинолин |
|
||||||
|
|
|
|
|
||||||
O |
R |
|
H |
O H R |
|
|
O H |
R |
|
|
O |
|
|
|
|
|
|
||||
|
|
O |
|
|
|
H O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
- H 2O |
N |
|
H O |
|
N |
|
H O |
|
N |
|
|
|
|
|
|
|
|||||
IV |
|
V |
|
V I |
|
|||||
R |
O H |
|
H O |
O |
R |
R |
O H |
|
O |
R |
|
O H |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
+ H N |
+ |
|
N -2 H 2O |
|
|
|
|
|
|
N |
O H |
|
H |
|
N |
|
O H |
|
N |
|
V I |
|
|
|
IV |
|
|
|
|
|
|
талейохин
468
Наряду с приведенной структурой талейохина, образуются и другие подобного строения талейохины, в которых возможны связи аммиака с 5,5
и5,6 углеродными атомами. Талейохинная проба принята ГФ в качестве испытания подлинности препаратов хинина.
Также фармакопейным испытанием подлинности является флуоресценция хинина в растворах кислородсодержащих кислот (серная, уксусная
идр.). Это испытание отрицательно для цинхонина и других алкалоидов хинной коры, не имеющих метоксигруппы в 6’-положении.
ГФ регламентирует также определение удельного вращения препаратов хинина в растворе соляной кислоты.
Известными неофицинальными реакциями хинина являются эритрохинная проба и образование герепатита.
Эритрохинная реакция протекает под действием бромной воды и калия гексацианоферрата (III) в щелочной среде на раствор хинина; появляется красное окрашивание. Эта реакция в 10 раз чувствительнее талейохинной, но окрашивание сохраняется короткое время.
Механизм реакции связан с окислением хинина до производного 5,8- хинолинхинона, который далее взаимодействует с не прореагировавшим хинином через 5 и 7 углеродные атомы с образованием эритрохина:
|
|
|
|
|
|
|
O |
R |
|
|
|
|
|
|
R |
CH3O |
|
|
R |
|
|
R |
|
|
|
|
|
CH3O |
O |
CH3O |
|
7 |
|
||
|
|
|
|
N |
||||
CH3O |
5 |
|
|
|
|
|
||
Br2 ; OH |
|
|
|
N |
O |
|
||
|
7 |
|
|
_ |
R |
|||
|
K3[Fe(CN)6] |
|
|
H2 |
|
|||
H |
N |
|
N |
|
||||
|
|
|
||||||
|
|
CH3O |
|
|||||
R = хинуклидиновый |
H |
O |
|
|
|
|
||
фрагмент хинина |
|
|
|
|
5 |
|
||
|
|
|
|
|
|
|
||
N
эритрохин
Герепатит − 4C20H24O2N2.3H2SO4.2HI.I4. 6H2O − кристаллы темно-зеле- ного цвета в форме листочков, образующиеся при взаимодействии серно-
кислого раствора хинина со спиртовым раствором йода.
Количественное определение индивидуальных солей хинина по ГФ проводят гравиметрически по основанию, выделяемому из раствора соли при добавлении раствора натрия гидроксида. Выделяющееся основание экстрагируют хлороформом (который затем отгоняют), высушивают и взвешивают.
Таблетки хинина гидрохлорида и хинина сульфата определяют методом кислотно-основного титрования по остатку минеральных кислот.
Известны неофицинальные методики количественного определения препаратов хинина в неводной среде и броматометрические. Определение
469
хинина гидрохлорида и дигидрохлорида проводят в среде ледяной уксусной кислоты с добавлением ангидрида уксусного и ртути (II) ацетата:
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
_ |
|
|
|
|
|
6 |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
4 |
3 |
|
||
|
|
|
7 |
|
|
* |
|
CH CH2 Cl |
|
|
|
|
7 |
|
* |
CH CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
HO |
* |
8 |
* |
|
N+* |
3 |
|
|
|
HO |
|
8 |
* |
N+* |
2 |
|
2 |
|
|
|
1H |
2 |
|
|
|
|
|
* |
|
1H |
||||
H |
C 9 |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
||
CH3O |
|
|
|
|
|
|
|
|
|
C 9 |
|
|
_ |
||||
5' |
4' |
|
|
|
|
|
+ |
4 HClO |
|
CH3O 5' |
|
4' |
|
|
|
2ClO4 |
|
|
|
|
|
3' |
|
|
|
|
4 |
|
|
|
|
|
|
|
|
6' |
|
|
|
|
|
|
+ Hg(CH COO) |
6' |
|
|
3' |
|
|
+ HgCl2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||
7' |
|
|
|
|
|
|
|
|
3 |
2 |
7' |
|
+ |
|
|
|
|
8' |
N |
2' |
|
|
|
|
|
|
|
2' |
|
|
+ 2CH COOH |
||||
|
|
|
|
|
|
|
|
|
8' |
1' |
N |
|
|
|
|||
|
|
1' |
|
|
|
|
|
|
|
|
H |
|
|
3 |
|||
хинина хлорид
В аналогичных условиях проводят количественное определение хинина сульфата:
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
* |
* |
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
HO |
|
8 * |
N+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
* |
1H |
|
2 |
|
|
2_ |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
C 9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH3O |
5' |
4' |
|
|
|
|
|
|
|
SO4 |
+ 3 HClO4 |
уксусная кислота, |
|
|
|||||||||
|
|
3' |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
6' |
|
|
|
|
|
|
|
|
|
|
|
|
|
уксусный ангидрид |
|
|
|||||||
7' |
|
N |
2' |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
8' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
1' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
||
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
||
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
* |
|
|
CH CH2 |
|||
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|||
|
|
|
7 |
|
|
|
|
CH |
CH |
|
|
|
|
|
|
|
* |
|
3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
* 3 |
|
2 |
|
|
HO |
|
|
8 |
* |
1 |
N+ |
|
|
||||
|
HO |
|
|
8 * |
1 |
N+ |
|
|
|
|
|
* |
H |
2 |
_ |
||||||||
|
|
* |
H 2 |
_ |
|
|
|
|
|
9 |
|
|
|||||||||||
|
H |
|
|
|
|
|
|
H |
|
C |
|
|
|
|
|
ClO4 |
|||||||
|
|
C 9 |
|
|
|
|
HSO4 |
|
+ |
|
|
|
|
|
|
|
|
|
|||||
CH3O |
5' |
|
4' |
|
|
|
|
|
CH3O |
5' |
|
|
4' |
3' |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
6' |
|
|
3' |
|
|
|
|
|
|
|
|
6' |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
7' |
|
|
+ |
|
|
|
|
|
|
|
|
|
7' |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
2' |
|
|
|
|
|
||
|
|
2' |
|
_ |
|
|
|
|
|
|
|
1' |
N |
|
|
_ |
|
|
|
||||
|
|
|
N |
|
|
|
|
|
|
|
8' |
|
|
|
|
|
|
||||||
|
8' |
1' |
H |
ClO |
|
|
|
|
|
|
H |
|
ClO |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
||||||
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Броматометрическое количественное определение хинина основано на бромировании винильного радикала в хинуклидиновом фрагменте алкалоида.
Международная Фармакопея регламентирует одновременное определение препаратов хинина двумя методиками: кислотно-основным титрованием в неводной среде и броматометрически. Первой методикой определяется хинин в сумме с возможной примесью − дигидрохинином (имеет в хинуклидиновом фрагменте предельный этильный радикал), а второй − только хинин. Разница в результатах, полученных по двум методикам, показывает содержание примеси дигидрохинина в препарате.
470
ПРОИЗВОДНЫЕ 8-ОКСИХИНОЛИНА
К производным 8-оксихинолина относится довольно многочисленная группа лекарственных веществ, представителями которой являются хинозол, энтеросептол, нитроксолин, хлорхинальдол.
Таблица 1. Производные 8-оксихинолина
Химическая структура |
Описание |
|
|||||||
|
|
|
|
|
|
|
|
Chinosolum. Хинозол. |
|
|
|
|
|
|
|
|
|
8-оксихинолина сульфат. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
2_ |
Мелкокристаллический |
порошок |
|
|
|
|
|
|
SO4 |
лимонно-желтого цвета. Легко рас- |
||
|
|
|
|
|
N |
||||
|
|
|
|
|
|||||
|
|
|
|
|
H |
|
творим в воде. |
|
|
|
|
|
OH |
2 |
|
||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
Лекарственные формы: растворы, |
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
присыпки, мази, суппозитории. |
|
|
|
|
|
|
|
|
|
Антисептик. |
|
|
|
|
Nitroxolinum. Нитроксолин. |
|
|
|
NO2 |
5-нитро-8-оксихинолин. |
|
|
|
|||
|
|
|
Мелкокристаллический |
порошок |
|
|
|
||
|
|
|
желто-зеленого цвета. Практически |
|
|
|
N |
нерастворим в воде. |
|
|
|
|
||
|
|
|
Лекарственная форма: таблетки по- |
|
OH |
||||
|
|
|
крытые оболочкой. |
|
|
|
|
Антибактериальное средство. |
|
Общие химические свойства и реакции подлинности
Приведенные лекарственные вещества по кислотно-основным свойствам относятся к амфолитам. Однако их кислотные свойства выражены сильнее, чем у простых фенолов из-за влияния на подвижность атома водорода фенольного гидроксила гетероатома азота. Поэтому 8-оксихинолин растворяется в карбонатах. Наличие электроноакцепторных атомов в молекулах нитроксолина и хлорхинальдола приводит к еще большему усилению кислотных свойств.
Одним из испытаний подлинности хинозола является взаимодействие раствора препарата с водным раствором натрия карбоната. Выпадает осадок (8-оксихинолин), растворяющийся при добавлении избытка реактива.
471
Амфотерные свойства лекарственных веществ группы 8-оксихино- лина обуславливают их различную диссоциацию, а также специфику спектров поглощения в УФ-области в растворах кислот и щелочей. Так ФС на хлорхинальдол предусматривает определение УФ-спектров поглощения препарата в 0,5 М растворе соляной кислоты (максимумы поглощения при 330 нм и 357 нм) и в 0,5 М растворе натрия гидроксида (максимум поглощения при 263 нм).
Другая особенность указанных лекарственных веществ, как производных 8-оксихинолина, − образование хелатных комплексных соединений с ионами металлов (Мg2+, Fe3+, Cu2+ и др.). При этом прочность некоторых комплексов такова, что они не разрушаются разбавленными минеральными кислотами. Реакции комплексообразования приводятся в качестве испытания подлинности на хинозол, хлорхинальдол и нитроксолин.
Частные химические свойства и реакции подлинности
Ароматическую нитрогруппу в нитроксолине восстанавливают до первичной ароматической аминогруппы и далее проводят диазотирование (добавлением раствора нитрита натрия с образованием соли диазония) и азосочетание со щелочным раствором β -нафтола с образованием азокрасителя красно-оранжевого цвета.
Хинозол и нитроксолин способны также вступать в реакции Марки и индофенольную, галогенирования.
Методики количественного определения
Общегрупповыми методиками количественного определения препаратов рассматриваемой группы являются:
1.кислотно-основное титрование в водной и неводной средах;
2.комплексонометрия;
3.гравиметрия (при образовании нерастворимых комплексных соединений).
Хинозол количественно определяют по остатку серной кислоты алкалиметрически (титрант − 0,1 М раствор натрия гидроксида).
Нитроксолин определяют в среде протофильного растворителя − диметилформамида. При этом усиливаются кислотные свойства препарата. Титрант − 0,1 М раствор натрия метилата.
Хлорхинальдол по ФС количественно определяют в среде уксусного ангидрида (титрант − 0.1 М раствор кислоты хлорной).
472
ПРОИЗВОДНЫЕ 4-АМИНОХИНОЛИНА
Представителями этой группы являются хлорохин и гидроксихлорохина сульфат. Хингамин применяется, главным образом, для лечения малярии, а трихомонацид − для лечения трихомонадоза и других протозойных инфекций.
Таблица 2. Производные 4-аминохинолина
|
Химическая структура |
|
Описание |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Chlorochinum. Хлорохина фосфат. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4-(1’-метил-4’-диэтиламинобутила- |
|||
|
|
|
CH3 |
|
|
|
|
|
|
|
|
C2H5 |
мино)-7-хлорхинолина дифосфат. |
||||||
|
HN |
CH |
|
CH2 |
|
|
CH2 |
CH2 N |
|
Белый или белый с легким кремова- |
|||||||||
|
|
|
|
|
тым отттенком кристаллический по- |
||||||||||||||
|
|
|
|
|
|
|
. 2 H PO |
|
|
|
|
C H |
|||||||
|
|
|
|
|
|
|
|
|
|
|
2 5 |
рошок горького |
вкуса. |
Легко |
рас- |
||||
|
|
|
|
|
|
|
3 |
4 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Cl |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
творим в воде, очень мало − в спир- |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
те. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лекарственные формы: порошок, |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
таблетки, раствор для инъекций. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Противомалярийное средство. |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hydroxychlorochinum. |
Гидрокси- |
||
|
|
|
|
H |
|
(CH2)2 |
|
|
|
|
CH2 |
CH2OH |
хлорохина сульфат. |
|
|
||||
|
HN |
|
|
C |
|
|
|
|
CH2 |
|
N |
|
4-(1-метил-4-этил-4оксиэтиламино- |
||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
CH3 |
|
|
|
|
|
C2H5 |
|||||||||
|
|
|
|
|
|
|
|
|
бутиламино)-7-хлорхинолина |
суль- |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. H SO |
|
||||
Cl |
N |
|
|
|
|
|
|
|
|
|
|
|
|
фат. |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
2 |
4 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Белый или почти белый кристалли- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ческий порошок. Без запаха. Легко |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
растворим в воде; практически не- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
растворим в хлороформе, этаноле и |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эфире. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лекарственная форма: таблетки |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Антипротозойное |
и противомаля- |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рийное средство. |
|
|
|
Подлинность хлорохина и гидроксихлорохина сульфата определяют по общегрупповым реакциям, характерным для солей азотистых оснований и с помощью физико-химических методов. У хлорохина определяют температуру плавления его пикрата и регистрируют спектр поглощения солянокислого раствора в УФ-области, имеющий максимумы при 257, 329
и 343 нм.
473
Количественное определение хлорохина фосфата и гидроксихлорохина сульфата проводят методом кислотно-основного титрования в среде ледяной уксусной кислоты (титрант − 0,1 М раствор кислоты хлорной). Фосфаты при этом титруются только по первой ступени:
|
|
CH3 |
|
|
|
|
|
|
|
|
|
C2H5 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HN |
CH |
|
|
CH2 |
|
CH2 |
CH2 |
N |
+ 2 HClO4 |
||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3COOH |
|
|
. 2 |
H |
3 |
PO |
4 |
|
|
|
|
|
C2H5 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Cl |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
C2H5 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HN |
CH |
|
|
|
CH2 |
CH2 |
CH2 |
|
N |
+ 2 H3PO4 |
|||
|
|
|
|
|
||||||||||
|
|
|
|
|
. 2 HClO |
4 |
|
|
|
|
C2H5 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
ПРОИЗВОДНЫЕ 4-ХИНОЛОНА
Лекарственные средства этой группы являются синтетическими химическими веществами, обладающими широким антибактериальным спектром и применяющимися для лечения инфекционных заболеваний различной природы и локализации. К препаратам первого поколения относятся кислота налидиксовая (относится к нафтиридинам) и кислота оксолиниевая (относится к хинолонам):
|
|
O |
|
O |
|
|
COOH |
O |
COOH |
|
|
|
CH2 |
|
H3C |
N |
N |
O |
N |
|
|
C2H5 |
|
C2H5 |
Кислота налидиксовая |
Кислота оксолиниевая |
|||
В настоящее время широкое применение в медицине нашли препараты третьего поколения, такие как офлоксацин, норфлоксацин, ципрофлоксацин (ципробай) и др., называемые фторхинолонами, отвечающие общей структурной формуле:
474
фармакофорнаягруппа хинолонов I,II и III поколений, обеспечивающаяингибирование вирусной ДНК-гиразы.
|
O |
R1 = |
C2H5 |
R2 |
= |
N |
|
F |
CO O H |
|
C2H4F |
||||
|
|
|
|
|
|||
|
|
|
C6H4F |
|
|
N |
|
|
|
|
NHCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
N |
|
|
|
H |
||
|
|
|
|
||||
|
|
|
|
пиперазин |
|||
|
R1 |
|
|
|
|
||
|
|
|
|
|
|
|
|
повышение
активности
N
или
N
N-метил- пиперазин
В настоящее время установлена взаимосвязь структуры хинолонов с фармакологическим действием, заключающаяся в следующем:
¾наличие фармакофорной группы, отвечающей за ингибирование вирусной ДНК-гиразы;
¾введение атома F расширяет антибактериальный спектр;
¾пиперазиновый или N-метилпиперазиновый циклы повышают антибактериальную активность в отношении грамположительных микроорганизмов и облигатных анаэробов, придают соединению липофильные свойства;
¾оксазиновое кольцо повышает устойчивость к метаболизму, уменьшает токсичность, придает соединению гидрофильные свойства;
¾сочетание оксазина с N-метилпиперазином обусловливает амфотерность, улучшает всасывание и распределение в тканях и различных очагах инфекции.
|
O |
|
O |
|
F |
|
|
F |
|
COOH |
|
|
COOH |
|
|
N |
N |
N |
N |
|
|
||
|
O |
|
|
N |
CH3 |
N |
|
|
|
Ciprofloxacinum |
|
CH3 |
Ofloxacinum |
H |
|
|
Ципрофлоксацин |
||
|
|
||
|
Офлоксацин |
|
|
Офлоксацин − белый с желтым оттенком кристаллический порошок, без запаха. Очень мало растворим в воде, метаноле; трудно растворим в хлороформе; легко растворим в ледяной уксусной кислоте. Обладает амфотерными свойствами.
Ципрофлоксацин (выпускается в виде гидрохлорида или лактата) − белый кристаллический порошок без запаха, растворим в воде, мало растворим в спирте, нерастворим в хлороформе.
475

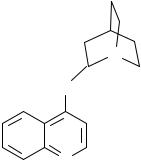
Кроме офлоксацина и ципрофлоксацина к хинолонам третьего поколения относятся еще около десяти лекарственных средств. Среди них ломефлоксацин (содержит два атома фтора) и эноксацин (производный нафтиридина):
|
|
O |
|
|
O |
F |
|
|
COOH |
F |
COOH |
N |
|
N |
|
N |
N N |
|
F |
C2H5 |
|
N |
C2H5 |
N |
CH3 |
|
|
Enoxacinum |
|
H |
|
|
|
H |
Lomefloxacinum |
Эноксацин |
|
Ломефлоксацин |
||
|
Подлинность лекарственных веществ группы 4-хинолона подтверждают с помощью физико-химических методов (ИК- и УФ-спектроскопия, ВЭЖХ).
Органически связанный фтор определяют после минерализации в виде фторида по реакции с раствором хлорида кальция (появляется белый осадок фторида кальция):
Ca2+ + 2 F = CaF2 ↓
Препараты группы 4-хинолона образуют хелатные комплексы с ионами Fe 3+ темно-красного цвета:
|
O |
|
F |
|
Fe3 + |
|
|
|
|
|
COO |
R |
N |
|
|
R |
3 |
|
|
Количественное определение индивидуальных препаратов группы 4- хинолона, а также их лекарственных форм проводят с помощью физикохимических методов и методом кислотно-основного титрования в неводных средах.
476
2. ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА
Широкое применение в медицине лекарственных веществ производных изохинолина связано с изучением алкалоидов мака снотворного. В млечном соке зеленых коробочек мака содержится около 25 алкалоидов. Важнейшие из них: морфин, кодеин, тебаин, наркотин, папаверин. Алкалоиды группы изохинолина (и лекарственные вещества, созданные на их основе) относятся, главным образом, к производным бензилизохинолина, морфинана и апорфина. Морфинан и апорфин относятся к группе фенантренизохинолина:
|
|
2 |
|
|
|
4 |
|
|
|
|
5 |
4 |
|
|
|
|
|
|
|
||
3 |
|
|
1 |
|
5 |
3 |
|
|
||
|
3 |
|
|
|
|
|
||||
6 |
|
|
|
|
|
|
|
|||
A |
|
|
|
6 |
|
|
|
|||
|
4 |
|
|
|
|
|
|
|||
7 |
N 2 |
|
|
|
|
2 |
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
11 |
10 |
|
|
|
|||
12 |
|
|
|
|
||||||
8 |
1 |
13 |
B |
9 |
|
1 |
|
|
||
|
1' |
14 |
|
|
|
|||||
|
5 |
|
|
|
D N |
7 |
N |
|
CH3 |
|
|
|
|
||||||||
2' |
6' |
C 15 |
|
|
|
|
|
|||
|
17 |
8 |
|
|
|
|||||
3' |
5' |
6 |
|
|
8 |
16 |
9 |
|
|
|
|
|
|
|
10 |
|
|
||||
7 |
|
|
|
|
|
|||||
|
|
|
|
|
апорфин |
|||||
|
4' |
морфинан |
||||||||
бензилизохинолин |
|
|
|
|
|
|
|
|
|
|
Производные бензилизохинолина
К данной группе относятся папаверина гидрохлорид и дротаверина гидрохлорид (являющийся производным 1,2,3,4-тетрагидроизохинолина).
Таблица 3. Производные бензилизохинолина
|
|
Химическая структура |
Описание |
|||||
|
|
CH3O |
6 |
5 |
4 |
|
|
Papaverini hydrochloridum. Папа- |
|
|
|
3 |
|
|
верина гидрохлорид. |
||
|
|
|
|
|
|
|
||
|
|
|
|
|
+ N H |
|
||
|
|
CH3O |
7 8 |
|
6,7-Диметокси-1-(3’,4’-диметокси- |
|||
|
|
1 2 |
|
|
||||
|
|
|
|
|
CH2 |
_ |
бензил)- изохинолина гидрохлорид. |
|
|
|
|
|
|
Cl |
Белый кристаллический порошок |
||
|
|
|
|
|
1' |
|
||
|
|
|
|
2' |
|
|
||
|
|
|
|
6' |
|
|
без запаха. Растворим в хлоро- |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3O 3' |
5' |
|
|
форме, умеренно растворим в воде, |
|
|
|
|
|
|
|
|||
|
|
|
4' |
|
|
мало растворим в спирте. |
||
|
|
|
|
|
OCH3 |
|
|
|
|
|
|
|
|
|
|
Лекарственные формы: порошок, |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
таблетки,раствор для инъекций. |
|
|
|
|
|
|
|
|
Cпазмолитик. Список Б. |
|
|
|
|
|
|
|
|
|
477
C2H5O |
5 |
4 |
|
6 |
3 |
|
|
C2H5O |
7 |
+NH2 |
|
8 |
1 |
_ |
|
|
|
|
|
|
|
C H |
Cl |
|
2' |
1' |
|
|
6' |
|
|
|
3' |
5' |
|
|
C2H5O |
|
|
|
4' |
|
OC2H5
Drotaverini hydrochloridum (Nospanum). Дротаверина гидрохлорид (Но-шпа).
1-(3’,4’-Диэтоксибензилиден)-6,7- диэтокси-1,2,3,4-тетрагидроизихи- нолина гидрохлорид.
Зеленовато-желтый кристаллический порошок со слабым запахом. Лекарственные формы: таблетки, раствор для инъекций. Спазмолитик. Список Б.
Папаверина гидрохлорид − соль слабого азотистого основания, не растворимого в уксусной кислоте. Поэтому при добавлении к раствору препарата раствора ацетата натрия выделяется осадок основания. Это испытание позволяет отличить папаверина гидрохлорид от солей более сильных оснований.
Папаверин взаимодействует с общеалкалоидными осадительными реактивами.
Восстановительные свойства папаверина гидрохлорида объясняются наличием в структуре двух ароматических фрагментов, связанных метиленовой группой, а также четырех метоксидных групп. Лекарственное вещество легко окислятся на свету и в присутствии примеси ионов тяжелых металлов. Первыми продуктами окисления являются спирт папаверинол и кетон папаверальдин (окисление происходит по метиленовому фрагменту).
При добавлении к папаверину гидрохлориду сильных окислителей и последующем нагревании образуются различно окрашенные продукты. Так, взаимодействие с концентрированной азотной кислотой приводит к появлению желтого окрашивания, переходящего в оранжево-красное при нагревании. Нагревание с концентрированной серной кислой приводит к образованию продукта окрашенного в фиолетовый цвет:
CH3O |
6 |
5 |
4 |
|
|
CH3O |
|
|
|
|
3 |
|
|
|
|
|
|||
CH3O |
7 |
|
+ N H |
|
|
CH3O |
N |
|
окрашенные |
8 |
1 |
|
|
|
|
||||
|
|
|
|
|
|||||
|
|
|
CH2 |
Cl |
_ |
t |
CH2 |
|
в фиолетовый |
|
|
|
|
_ |
цвет продукты |
||||
|
|
|
1 ' |
конц. H 2SO4 |
|
||||
|
|
2' |
6 ' |
|
S O 3 |
окисления |
|||
|
|
|
|
|
|
|
|
|
|
|
CH3O 3 ' |
5' |
|
|
|
|
|
|
|
|
4 ' |
|
|
|
CH3O |
|
|
||
|
|
|
|
|
|
|
|
|
|
O CH3 |
O CH3 |
|
478
Известны и другие реакции окисления папаверина. При взаимодействии с реактивом Марки возникает желтое окрашивание, переходящее в оранжевое. Дальнейшее добавление бромной воды и раствора аммиака приводит к образованию грязно-фиолетового осадка, растворяющегося в этаноле с образованием раствора окрашенного в фиолетовый или краснофиолетовый цвет (реакция О.Н.Соболевой).
Одной из наиболее известных реакций на папаверин, включенной в некоторые национальные фармакопеи, является каролиновая проба. При проведении пробы к порошку папаверина гидрохлорида добавляют концентрированную серную кислоту, уксусный ангидрид и нагревают. Возникает яркожелтое окрашивание с зеленой флуоресценцией:
CH3O |
|
|
|
O |
|
|
|
|
|
|
CH3 |
C |
CH3O |
|
|
|
|||
|
N |
|
O |
|
|
|
|
CH3 |
|
CH3O |
CH3 |
C |
CH3O |
N |
|
||||
|
|
|
|||||||
|
H C H |
|
O |
C |
O |
|
|||
|
|
|
|
|
|
||||
|
|
H2SO4 |
|
|
|
H C H |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
OCH3 |
|
|
|
|
OCH3 |
|
CH3O |
|
OCH3 |
|
|
|
|
|
||
|
|
|
|
|
OCH3 |
|
|||
CH3O |
N H |
CH3 |
|
|
|
|
|
|
|
|
C |
O |
CH |
3 |
O |
|
|
H+ |
|
|
|
|
|
||||||
|
C H |
|
|
|
|
N |
CH3 |
||
|
|
|
|
CH |
3O |
H2S O4 |
|||
|
|
|
|
C |
OH |
||||
|
|
|
|
|
|
|
|
||
OCH3 C H
OCH3
OCH3
OCH3
CH3O |
|
|
|
CH3O |
N + |
CH3 |
_ |
|
|
||
|
|
|
HSO4 |
краситель ярко-желтого цвета с зеленой
OCH3 флуоресценцией
OCH3
Количественное определение папаверина гидрохлорида (по ФС) проводят в среде уксусного ангидрида и муравьиной кислоты, титрант − 0,1 М раствор кислоты хлорной.
Дротаверина гидрохлорид является синтетическим спазмолитиком, близким по химическому строению к папаверину. Но спазмолитические свойства дротаверина выражены сильнее, чем у предшественника. Моле479
кулу дротаверина можно рассматривать как продукт конденсации 6,7-ди- этокситетрагидроизохинолина и 3,4-диэтоксибенз-альдегида. Препарат имеет характерный спектр поглощения в УФ-области.
Дротаверин проявляет более выраженные основные свойства, чем папаверин, поэтому для выделения основания из раствора препарата следует добавить раствор щелочи.
Как и папаверин, дротаверин обладает выраженными восстановительными свойствами. При добавлении к навеске препарата концентрированно серной кислоты с дальнейшим добавлением капли разведенной азотной кислоты возникает темно-коричневое окрашивание.
Количественное определение дротаверина гидрохлорида проводят также, как у папаверина гидрохлорида.
Производные фенантренизохинолина
Большинство лекарственных веществ этой группы относятся к подгруппе морфинана. К подгруппе апорфина относится апоморфина гидрохлорид.
Производные морфинана
Таблица 4. Производные морфинана
|
Химичекая структура |
|
|
|
Описание |
|
||||||
HO 3 |
2 |
|
|
|
|
|
|
|
Morphini hydrochloridum. Мор- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
фина гидрохлорид. |
|
|
|
|
A |
|
|
|
|
|
|
|
|
||
|
4 |
|
|
|
|
|
|
|
7,8-Дидегидро-4,5α -эпокси-17-ме- |
|||
|
|
11 |
10 |
|
_ |
|
|
|||||
|
|
12 |
|
|
|
|||||||
O |
|
|
. |
|
тилмор- |
|
||||||
|
|
B |
9 |
|
Cl |
3 H2O |
|
|||||
|
* |
13 |
|
14 * |
17 |
|
финан-3,6α -диола |
гидрохлорид, |
||||
|
* |
|
* D + N |
|
CH |
|
|
|||||
|
5 C |
|
|
|
|
|||||||
|
15 |
|
H |
3 |
|
|
тригидрат |
|
||||
HO |
* |
|
|
8 |
16 |
|
|
|
|
|
||
6 |
7 |
|
|
|
|
|
|
Белые |
игольчатые |
кристаллы или |
||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
белый |
кристаллический порошок, |
|
|
|
|
|
|
|
|
|
|
|
желтеющий при хранении. Мед- |
||
|
|
|
|
|
|
|
|
|
|
ленно растворим в воде, трудно рас- |
||
|
|
|
|
|
|
|
|
|
|
творим в спирте. |
|
|
|
|
|
|
|
|
|
|
|
|
Лекарственные формы: таблетки, |
||
|
|
|
|
|
|
|
|
|
|
раствор для инъекций. |
||
|
|
|
|
|
|
|
|
|
|
Наркотический анальгетик. |
||
|
|
|
|
|
|
|
|
|
|
Список А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
480
|
|
Codeinum. Кодеин. |
|
CH3O |
|
7,8-Дидегидро-4,5-эпокси-3-ме- |
|
|
|
токси-17-метилморфинан-6-ола гид- |
|
.H O |
рат. |
||
O |
2 |
Белый кристаллический порошок |
|
N |
CH3 |
||
без запаха. Медленно и мало рас- |
|||
|
|
||
HO |
|
творим в воде, растворим в горячей |
|
|
|
воде, легко растворим в спирте. |
|
|
|
Лекарственные формы: порошок, |
|
|
|
таблетки |
|
|
|
Наркотический анальгетик. |
|
|
|
Список Б. |
|
CH3O |
|
|
|
Codeini phosphas. Кодеина фосфат. |
|
|
|
|
|
7,8-Дидегидро-4,5-эпокси-3-ме- |
|
. H PO |
.1,5 H O |
токси-17- |
метилморфинан-6-ола |
||
O |
3 4 |
2 |
фосфат, 1,5-гидрат |
||
N |
|
CH3 |
|
||
|
|
Белый кристаллический порошок |
|||
|
|
|
|
||
HO |
|
|
|
без запаха. Легко растворим в воде, |
|
|
|
|
|
мало − в спирте. |
|
|
|
|
|
Лекарственные формы: порошок. |
|
|
|
|
|
Наркотический анальгетик. |
|
|
|
|
|
Список Б. |
|
|
|
C2H5O |
|
|
|
|
|
|
Aethylmorphini |
hydrochloridum. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
_ |
|
|
Этилморфина гидрохлорид. |
|
|
|
|
|
|
|
. 2 |
|
7,8-Дидегидро-4,5-эпокси-3-этокси- |
||
|
|
O |
|
|
|
Cl |
H O |
|||
|
|
+ |
|
|
|
|
2 |
17-метилморфинан-6-ола гидрохло- |
||
|
|
|
N |
CH3 |
|
|
|
|||
|
|
|
|
|
|
рид, дигидрат. |
|
|||
|
|
HO |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Белый кристаллический порошок |
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
без запаха. Растворим в воде и спир- |
|
|
|
|
|
|
|
|
|
|
те, мало растволрим в хлороформе, |
|
|
|
|
|
|
|
|
|
|
очень мало − в эфире. |
|
|
|
|
|
|
|
|
|
|
Лекарственные формы: порошок, |
|
|
|
|
|
|
|
|
|
|
таблетки. |
|
|
|
|
|
|
|
|
|
|
Наркотический анальгетик. |
|
|
|
|
|
|
|
|
|
|
Список А. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
481 |
Морфинан является частично гидрированным октагидрофенантренизохинолином. Сочетание циклов А,В,С образуют частично гидрированный фенантрен; С,D − гидрированный изохинолин; цикл D − пиперидин.
Уморфина появляется еще один цикл, образованный эпокси-группой
исоседними атомами углерода. Наличие пяти асимметрических атомов углерода (5,6,9,13,14) придает соединению оптическую активность.
Кислотно-основные свойства морфина объясняются наличием третичного атома азота (центр основности) и фенольного гидроксила (центр кислотности). Основные свойства морфина выражены слабее, чем у ам-
миака, а кислотные − не на много сильнее, чем у фенола.
ГФ регламентирует, как одно из испытаний подлинности морфина гидрохлорида, взаимодействие его раствора с раствором аммиака (выпадает белый осадок основания). Дальнейшее прибавление раствора натрия гидроксида приводит к растворению осадка (образование фенолята).
Как и соли других оснований, морфина гидрохлорид взаимодействует с общеалкалоидными осадительными реактивами.
Выраженные восстановительные свойства обусловлены принадлежностью морфина к частично гидрированной системе фенантрена, а также наличием фенольного гидроксила и вторичной спиртовой группы.
Растворы морфина гидрохлорида очень легко окисляются, особенно на свету и в щелочной среде. Наибольшая устойчивость растворов препарата наблюдается при значении рН =2,5.
При свободном окислении морфина гидрохлорида образуются дегидродиморфин (псевдоморфин) и N-оксид морфина в соотношении 9 : 1
|
|
O |
|
O |
O |
|
|
O |
O |
+ O |
|
|
|||
N |
CH3 |
N CH3 |
|
N CH3 |
|||
O |
O |
O |
|
O |
|||
|
|
||
дегидродиморфин (90%) |
N-оксид морфина (10%) |
||
Взаимодействие морфина гидрохлорида и других препаратов группы морфинана с сильными окислителями приводит к образованию различно окрашенных продуктов окислния.
ГФ в качестве испытаний подлинности морфина гидрохлорида приводит реакции препарата с реактивом Марки и с раствором молибдата аммония в кислоте серной концентрированной (реактив Фреде). При взаи-
482
модействии морфина с реактивом Марки образуется пурпурное окрашивание, переходящее в фиолетовое:
|
|
OH |
|
H |
C |
H |
|
OH |
|
OH H |
H OH |
|
|
|
|
|
|
|
3 |
|
|||
|
4 |
3 |
|
H |
O |
H |
2 |
4 |
|
C |
|
O |
|
|
A |
O |
|||||||
|
A |
2 |
+ |
|
+ |
|
O |
O |
|||
|
|
1 |
|
H |
O |
H |
1 |
|
|
_2 H O |
C |
|
|
|
|
|
|
2 |
|||||
|
|
|
|
H |
C |
H |
|
|
|
H |
H |
|
|
|
|
OH |
|
H |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[O] |
|
|
|
|
C |
|
|
|
|
|
_ |
O |
|
|
|
|
|
|
O |
|
|
|
H |
|
|
|
|
|
|
|
|
|||
|
2 |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В результате взаимодействия препарата с реактивом Фреде появляется фиолетовое окрашивание, переходящее в синее и (при стоянии) в зеленое.
Известны и другие (неофицинальные) реакции морфина гидрохлорида с различными окислителями. Так, при взаимодействии с реактивом Эрдмана (смесь концентрированных серной и азотной кислот) образуется продукт красного цвета:
|
|
HO |
5 |
4 |
|
|
O |
NO |
HO |
|
|
3 |
|
||||
|
|
|
|
|
|
2 |
||
|
+ |
HO |
6 |
|
2 |
|
O |
|
|
[O],H |
|
HNO3 |
|
||||
O |
6 cтадий |
|
|
|
1 |
|
|
|
|
N CH3 |
|
7 |
|
N |
CH3 |
|
N CH |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
HO |
|
|
|
9 |
10 |
|
|
|
|
|
|
|
апоморфин |
|
|
|
|
Окисление морфина реактивом Манделина (раствор ванадата аммония в кислоте серной концентрированной) приводит к образованию продукта фиолетового цвета.
Окисление морфина растворм йода (реакция Пеллагри) проходит в две стадии. На первой − морфин переводят в апоморфин нагреванием с кислотой серной концентрированной. Затем кислоту нейтрализуют и добавляют раствор йода и натрия гидрокарбонат. В результате образуется мезомерно стабилизированный красного цвета о-хинон:
483
|
|
HO |
|
O |
O |
|
|
|
|
||
|
|
|
I2 |
O |
O |
|
H+ |
HO |
NaHCO3 |
||
Морфин |
|
||||
t 0 |
|
|
N CH |
+ |
|
|
N |
CH |
N CH3 |
||
|
|
3 |
|||
|
|
|
3 |
|
|
Реакция морфина с кислотой азотной концентрированной приводит к образованию оранжево-красного внутримолекулярного хелата:
|
O |
|
|
O |
|
|
|
|
|
|
HO |
N |
H |
N |
HO |
|
|
O |
|
|
|
|
||
HNO3 |
|
|
|
|
O |
O |
N |
CH3 |
O |
N |
CH |
N CH |
||
|
|
3 |
||
|
3 |
|
|
|
HO |
HO |
|
|
HO |
|
|
|
|
|
При добавлении к раствору препарата раствора калия гексацианоферрата (III) образуются псевдоморфин и калия гексацианоферрат (II):
4Морфин+4K3[Fe(CN)6] 2псевдоморфин +3K4[Fe (CN)6]+H4[Fe (CN)6]
Дальнейшее прибавление раствора железа (III) хлорида приводит к образованию берлинской лазури синего цвета:
3 K4[Fe (CN)6] + 4 FeCl3 → Fe4[Fe (CN)6 + 12 KCl
Известны реакции морфина гидрохлорида и с другими окислителями. Наличием в молекуле морфина фенольного и вторичного спиртового гидроксилов обусловлены характерные для этих функциональных групп реакции. Так, при взаимодействии раствора препарата с раствором железа (III) хлорида появляется сине-фиолетовое окрашивание (образование комплексного соединения по фенольному гидроксилу), быстро исчезающее из-
за окисления морфина реактивом.
Как и другие фенолы, морфин вступает в SE реакции (галогенирование, азосочетание с солями диазония и др.).
Возможно окисление вторичного спиртового гидроксила до кетона с последующим образованием оксимов, гидразонов, семикарбазонов.
Морфин легко этерифицируется и по фенольному, и по вторичному спиртовому гидроксилам.
484
ГФ регламентирует также определение величины удельного вращения морфина гидрохлорида.
Количественное опредление морфина гидрохлорида по проводят методом кислотно-основного титрования в среде ледяной уксусной кислоты с добавлением ртути (II) ацетата.
Содержание кодеина в опии невелико, поэтому препарат получают полусинтетически метилированием морфина. Особенностью кодеина, отличающей его от других алакалоидов и синтетических оснований является растворимость в воде, с чем связаны и выраженные основные свойства препарата.
Структурным сходством кодеина с морфином можно объяснить взаимодействие препаратов с одинаковыми окислителями. Но различие в окрашивании получающихся продуктов реакций позволяет отличать препараты друг от друга.
Реакция кодеина с реактивом Марки приводит к образованию синефиолетового окрашивания, усиливающегося при стоянии.
Сконцентрированной серной кислотой в присутствии железа (III) хлорида, как катализатора получается продукт синего цвета, переходящий после добавления небольшого количества разведенной азотной кислоты в красный.
При реакции кодеина с концентрированной азотной кислотой возникает оранжевое окрашивание, переходящее в желтое.
Среактивом Фреде кодеин реагирует с образованием фиолетового ок-
рашивания, а с реактивом Эрдмана − красного.
Как и морфин, кодеин легко этерифицируется по вторичному спиртовому гидроксилу.
Специфической примесью в кодеине, допустимой по ГФ до 0,0001%, является морфин. Примесь морфина определяется в определенной навеске кодеина по реакции с раствором натрия нитрита в кислой среде и последующем добавлении раствора аммиака. Интенсивность возникшего при реакции окрашивания сравнивают с окрашиванием эталонного раствора морфина после взаимодействия с теми же реактивами:
|
|
O |
HO |
NH4O |
|
|
|
N |
|
||
HO |
|
N |
N |
||
A |
NaNO2 |
HO |
O |
O |
|
|
A |
A |
A |
||
O |
HCl |
|
|||
|
|
NH3 |
|
||
N |
CH3 |
|
|
|
|
|
|
окрашенная |
|||
|
|
|
|
||
HO |
|
|
|
аммонийная |
|
|
|
|
|
соль |
|
485
Кодеин, являющийся метиловым эфиром морфина по фенольному гидроксилу, в реакцию с натрия нитритом не вступает.
Количественное определение кодеина − ацидиметрия. Кодеин отличается от многих алкалоидов и синтетических оснований не только растворимостью в воде, но и силой основности. Значение рН водного раствора препарата находится в пределах 9,0. Это позволяет определять количественно кодеин методом кислотно-основного титрования в водной среде. Титрант − 0,1 М раствор кислоты хлороводородной, индикатор − метиловый красный.
Кодеина фосфат количественно определяют методом кислотно-основ- ного титрования в неводной среде (растворитель − кислота уксусная ледяная; титрант − 0,1 М кислоты хлорной).
Этилморфина гидрохлорид по ГФ анализируется в тех же условиях, что и морфина гидрохлорид и кодеин. При взаимодействии препарата с концентрированной серной кислотой в присутствии железа (III) хлорида как катализатора возникает зеленое окрашивание, переходящее в фио- летово-синее, а при добавлении 1 капли кислоты азотной разведенной − в красное.
Синтетические аналоги морфина по фармакологическому действию
Учитывая степень социального зла, связанного с наркотическими анальгетиками, содержащимися в опии, во многих лабораториях мира проводится большая работа по созданию синтетических аналогов морфина по фармакологическому действию. Одним из первых в ряду был синтезирован промедол, а сравнительно недавно − трамал:
|
|
O |
HO |
O |
OH |
|
||
|
O |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C C2H5 |
|
|
CH3O |
OH .HCl |
|||
H3C |
|
|
|
|
|
H |
||
|
|
. HCl |
|
|
.HCl |
CH3 |
||
N |
CH |
|
N |
H2C N |
||||
|
|
3 |
|
|
CH3 |
CH3 |
||
|
|
|
||||||
CH3 |
|
|
|
|
||||
|
|
|
|
|
||||
Promedolum |
Morphini hydrochloridum |
Tramalum |
||||||
1,2,5-Триметил-4- |
|
|
|
(±)-транс-2-[(диметил- |
||||
пропионилокси- |
|
|
|
амино)-метил]-1- |
||||
4-фенилпиперидина |
|
|
|
(м-метоксифенил)- |
||||
гидрохлорид |
|
|
|
циклогексанола |
||||
|
|
|
|
|
|
|
|
гидрохлорид. |
486
Сравнение приведенных структур показывает преемственность химического строения промедола и трамала от предшественника − морфина. Хотя трамал не является даже гетероциклическим соединением. Следует, однако, отметить, что промедол и трамал действуют, по-видимому, на те же центры коры головного мозга, что и морфин. Поэтому их длительное применение также вызывает привыкание.
Производные апорфина
Таблица 5. Общие свойства производных апорфина
|
|
|
Химическая структура |
Описание |
|
||||||
|
|
HO |
4 |
|
|
|
|
|
|
Apomorphini |
hydrochloridum. |
|
|
|
|
|
|
|
|
||||
|
|
5 |
3 |
|
|
|
|
|
Апоморфина гидрохлорид. |
||
|
|
|
|
|
|
|
|
|
|||
|
|
HO |
6 |
2 |
|
|
_ |
. 0,75 H O |
5,6-Диоксиапорфина гидрохлорид. |
||
|
|
|
|
|
Cl |
Белый, слегка сероватый или слегка |
|||||
|
|
|
|
1 |
|
|
|
|
2 |
||
|
|
|
|
|
|
|
|
|
желтоватый кристаллический поро- |
||
|
|
|
7 |
+N |
|
CH3 |
|
|
|||
|
|
|
|
|
|||||||
|
|
|
8 |
|
H |
|
|
шок. На воздухе и на свету зеленет. |
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
9 |
10 |
|
|
|
|
|
Трудно растворим в воде. |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Лекарственные формы: порошок, |
|
|
|
|
|
|
|
|
|
|
|
раствор для инъекций. |
|
|
|
|
|
|
|
|
|
|
|
Рвотное средство. |
|
|
|
|
|
|
|
|
|
|
|
Список А |
|
Апоморфин следует рассматривать, как продукт промежуточного окисления морфина. Это обстоятельство сказывается на внешнем виде и химических свойствах препарата. Апоморфина гидрохлорид неусточив при хранении, особенно на свету, и легко окисляется как в нейтральной, так и в кислой и щелочной среде.
Окисление в кислой и нейтральной среде (рН 2 - 7) приводит к образованию дикетона (реакция Пеллагри, см. выше), а в щелочной − к ортохинону (10%) и хиноидному аниону (70%):
HO |
O |
|
O |
O |
|
|
|
||
pH 10 - 14 O |
+ |
O |
|
|
HO |
|
|
||
N |
CH3 |
|
||
N |
|
N CH3 |
||
CH3 |
|
|
|
|
|
о-хинон |
|
хиноидный анион |
|
487
Подлинность апоморфина гидрохлорида определяют взаимодействием препарата с азотной кислотой (см. химизм нитрования морфина) и реакцией Пеллагри.
Другие реакции апоморфина связаны с его амфотерным характером и наличием в его молекуле двух фенольных гидроксилов.
Количественное определение апоморфина гидрохлорида − кислотноосновное титрование в неводной среде.
488
