
- •Кафедра химии
- •Содержание
- •Общие правила работы в лаборатории
- •Правила техники безопасности
- •Оказание первой помощи
- •Порядок оформления работ
- •Тема 1. Растворы
- •Работа 1. Приготовление рабочего 0,1n раствора hCl
- •Плотность растворов соляной кислоты
- •Работа 2. Определение нормальности рабочего раствора hCl по 0,1n раствору NaOh
- •Работа 3. Древовидные образования
- •Работа 4. Рост искусственной «клетки» Траубе
- •Тема 2. Гетерогенные равновесия и процессы
- •Работа 5. Определение хлоридов мочи по Мору
- •Тема 3. Комплексонометрия
- •Работа 6. Определение общей жесткости воды трилонометрическим методом.
- •Тема 4. Протолитические равновесия и процессы
- •Работа 7. Приготовление буферных растворов
- •Тема 5. Электрохимия
- •Работа 10. Потенциометрический метод определения рН растворов при помощи стеклянного электрода
- •Тема 6. Поверхностные явления. Хроматография
- •Работа 11. Разделение минеральных солей на колонках с твердым адсорбентом
- •Работа 12. Радиальная распределительная хроматография
- •Тема 7. Дисперсные системы
- •Работа 13. Метод замены растворителя
- •Работа 14. Получение золя гидроксида железа (III)
- •Работа 15. Получение золя гексацианоферрата (II) меди
- •Работа 16. Изучение процесса коагуляции коллоидных растворов
- •Тема 8. Растворы вмс
- •Работа 17. Изучение процесса денатурации белка
- •Работа 18. Изучение процесса высаливания белка
- •Литература
Работа 2. Определение нормальности рабочего раствора hCl по 0,1n раствору NaOh
Задача работы: ознакомление с методикой титриметрического анализа, т.е. определением концентрации рабочего раствора по титрованному раствору.
Оборудование, реактивы: рабочий раствор HCl, титрованный раствор NaOH, фенолфталеин, коническая колба на 250 мл (или иного объема на усмотрение преподавателя), мерные пипетки, бюретка, груша.
Выполнение работы:
1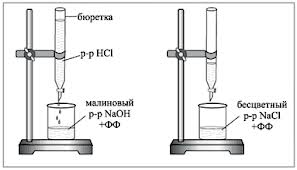 .
Бюретку заполняют исследуемым рабочим
растворомHCl.
В титровальную колбу отбирают пипеткой
5 мл 0,1N
раствора NaOH,
добавляют 1-2 капли фенолфталеина и
титруют по каплям раствором кислоты до
исчезновения малиновой окраски. При
титровании содержимое колбы перемешивают
вращательными движениями или магнитной
мешалкой.
.
Бюретку заполняют исследуемым рабочим
растворомHCl.
В титровальную колбу отбирают пипеткой
5 мл 0,1N
раствора NaOH,
добавляют 1-2 капли фенолфталеина и
титруют по каплям раствором кислоты до
исчезновения малиновой окраски. При
титровании содержимое колбы перемешивают
вращательными движениями или магнитной
мешалкой.
2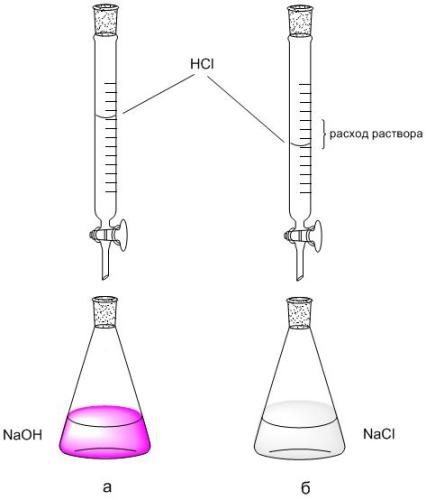 .
По шкале бюретки фиксируют расход
раствораHCl
(VHCl,
мл) пошедший на титрование 5 мл NaOH.
Титрование повторяют 2-3 раза, каждое
повторное титрование начинают с нулевого
отсчета бюретки.
.
По шкале бюретки фиксируют расход
раствораHCl
(VHCl,
мл) пошедший на титрование 5 мл NaOH.
Титрование повторяют 2-3 раза, каждое
повторное титрование начинают с нулевого
отсчета бюретки.
По среднему объему кислоты, пошедшему на титрование щелочи рассчитывают ее нормальность по формуле:
![]()
3. Оформляют работу. Формулируют выводы.
Работа 3. Древовидные образования
Задача работы: ознакомление с понятием осмоса и осмотического давления. Изучить сущность явления гемолиза.
О борудование,
реактивы:
штатив с пробирками, раствор силикатного
клея, Кристаллы солей: железа, меди,
марганца, никеля, кобальта и др. (хлориды,
бромиды, нитраты).
борудование,
реактивы:
штатив с пробирками, раствор силикатного
клея, Кристаллы солей: железа, меди,
марганца, никеля, кобальта и др. (хлориды,
бромиды, нитраты).
Выполнение работы:
Ряд пробирок наполняют раствором силикатного клея и опускают в пробирки кристаллики солей. Через некоторое время из кристаллов вырастают древовидные образования.
Дают объяснение наблюдаемому явлению.
Работа 4. Рост искусственной «клетки» Траубе
Задача работы: получить искусственную полупроницаемую оболочку (пленка коллоида). Изучить сущность процессов плазмолиза, гемолиза и роль гипертонических, гипотонических и изотонических растворов в наблюдаемых явлениях.
О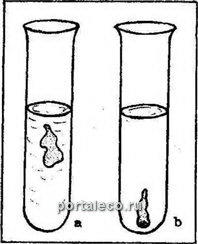 борудование,
реактивы:0,5н.
раствор сульфата меди, кристаллы и 1н.,
0,5н., 0,25н., 0,125н. растворы гексацианоферрата
(II)
калия, пробирки, пипетки.
борудование,
реактивы:0,5н.
раствор сульфата меди, кристаллы и 1н.,
0,5н., 0,25н., 0,125н. растворы гексацианоферрата
(II)
калия, пробирки, пипетки.
Выполнение работы: пробирку наполняют 5 мл 0,5н. раствора CuSO4 и осторожно по стенке опускают 1 каплю 1н. K4[Fe(CN)6]. В результате реакции образуется полупроницаемая пленка:
K4[Fe(CN)6] + 2CuSO4 = Cu2[Fe(CN)6] + 2К2SO4.
В воде эта пленка свертывается в капельку, представляющую собой искусственную «клетку».
Повторить опыт по той же схеме с 0,5н., 0,25н., 0,125н. растворами K4[Fe(CN)6]. Проследить за изменением размеров и формы «клетки».
Если концентрация раствора CuSO4 снаружи меньше, чем концентрация раствора внутри «клетки», вода входит внутрь «клетки» и она быстро увеличивается в объеме, а от ее наружных стенок пойдут вниз струйки более концентрированного раствора CuSO4. Если концентрация раствора CuSO4 снаружи больше, чем концентрация раствора K4[Fe(CN)6] внутри «клетки», то вода будет выходить из нее и она сморщится.
Найти изотоническую концентрацию раствора K4[Fe(CN)6], т.е. такую, когда осмотическое давление этого раствора будет равно осмотическому давлению 0,5н. раствора CuSO4.
В пробирку налить 5 мл 0,5н. раствора CuSO4 и опустить несколько кристалликов соли K4[Fe(CN)6]. Так как концентрация раствора внутри «клетки» очень велика по сравнению с наружным раствором, вода в нее будет поступать очень быстро и образовавшийся на ее поверхности вырост, как парашют, будет поднимать ее на поверхность раствора. Оформляют работу. Формулируют выводы.
