
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.4.2 Перенапряжение
Суммарная поляризационная кривая показывает, что скорость электродной реакции зависит от сдвига потенциала.
Смещение потенциала от равновесного, необходимое, чтобы вызвать электродную реакцию, протекающую с некоторой заданной скоростью (i), называется перенапряжением этой реакции, или поляризацией (η ).
Перенапряжение, и катодное и анодное, всегда величина положительная
ηк = φравн. - φ ηа = φ - φравн.
Перенапряжение для данной реакции зависит от плотности тока (скорость реакции), поэтому сравнение перенапряжений двух реакций возможно при одной и той же величине i .
Катодное и анодное перенапряжения не равны друг другу.
На рисунке 2.7 изображены две суммарные поляризационные кривые, отвечающие реакциям с малым (а) и большим (б) перенапряжением.
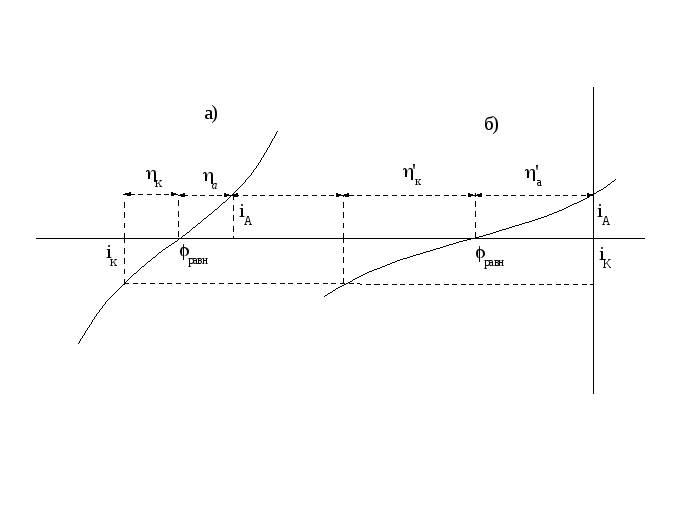
Рисунок 2.7 - Поляризационные кривые, отвечающие малому перенапряжению (а) и большому перенапряжению (б) электродной реакции
Скорость обеих
реакций взята одинаковой: iА=
iК.=
i.
Чтобы реакция шла со скоростью, равной
iК,
в случае (а) перенапряжение равно ηк
и
ηа,
а в случае (б)
![]() и
и![]()
Перенапряжение зависит от величины тока обмена, iо. Реакции, проходящие с большим перенапряжением (малой скоростью), имеют малый ток обмена. Это реакции окисления-восстановления с участием ионов Н3О+, ОН-, Fe 2+, Ni2+. Токи обмена этих реакций на много порядков меньше, чем у большинства других металлов (Ag+, Cu2+, Cd2+, Zn2+, Pb2+, Sn2+), для которых перенапряжение мало.
Особый интерес представляет реакция катодного восстановления водорода, протекающая на поверхности некоторых металлов с очень большим перенапряжением.
Существование перенапряжения связано с малой скоростью электрохимического процесса, который является сложным многостадийным процессом. Было найдено, что в зависимости от природы металла лимитирующими стадиями могут быть стадии разряда – ионизации:
Н3О+ + e → H + Н2О или рекомбинации:
2H → H2.
Величина перенапряжения водорода зависит от природы металла. Высокое перенапряжение наблюдается на Hg, Ag, Cu, Cd, Zn, Bi, Pb, Au. Исключение составляет платина, на которой перенапряжение близко к нулю.
Перенапряжение водорода зависит от плотности тока по уравнению И. Таффеля
![]() ,
,
где а – величина, зависящая от материала катода; b - величина, зависящая от типа электродной реакции.
Зная, как протекают процессы на отдельных электродах, то есть располагая данными, позволяющими построить анодную и катодную ветви суммарных поляризационных кривых для каждого из электродов, можно рассмотреть протекание электролиза и определить продукты электролиза.
2.4.3 Электролиз
Электролиз – это процессы, протекающие на электродах при пропускании электрического тока через растворы или расплавы электролитов.
При электролизе важным является выбор анода. Аноды бывают растворимые, то есть участвующие в электродной реакции, и нерастворимые, инертные, не участвующие в электродной реакции.
К растворимым относятся: цветные металлы (Hg, Cu, Al, Zn, Pb, Sn), углеродистая сталь, некоторые сплавы.
К нерастворимым относятся: Pt, Ni, графит, нержавеющая сталь, PbO2, MnO2, Fe3O4 .
Рассмотрим некоторые типичные случаи электролиза, пользуясь поляризационными кривыми.
