
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
2.1.2 Удельная электрическая проводимость
Электрическая проводимость – это способность веществ проводить электрический ток под действием внешнего электрического поля. Электрическая проводимость – величина, обратная электрическому сопротивлению L = 1/R.
![]() [См],
[См],
где ρ
– удельное
сопротивление, Ом·м;
![]() - удельная электрическая проводимость,
См/м (сименс/метр);S
– поперечное сечение, м2;
l
– длина
проводника, м) (в электрохимии
удельная электрическая проводимость
(
- удельная электрическая проводимость,
См/м (сименс/метр);S
– поперечное сечение, м2;
l
– длина
проводника, м) (в электрохимии
удельная электрическая проводимость
(![]() )
читается - каппа).
)
читается - каппа).
Единица измерения L – сименс (См), 1 См = 1 Ом-1.
Удельная электрическая проводимость раствора характеризует проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга. Единица измерения в системе СИ - См·м-1.
Удельная проводимость раствора электролита определяется количеством ионов, переносящих электричество и скоростью их миграции:
![]() ,
(2.5)
,
(2.5)
где α
– степень диссоциации электролита; С
– молярная концентрация эквивалента,
моль/м3;
F
– число
Фарадея, 96485 Кл/моль;
![]() - абсолютные скорости движения катиона
и аниона (скорости при градиенте
потенциала поля, равном 1 В/м); единица
измерения скорости - м2В-1с-1.
- абсолютные скорости движения катиона
и аниона (скорости при градиенте
потенциала поля, равном 1 В/м); единица
измерения скорости - м2В-1с-1.
Из уравнения (2.5)
следует, что
![]() зависит от концентрации как для сильных
так и для слабых электролитов (рисунок
2.1):
зависит от концентрации как для сильных
так и для слабых электролитов (рисунок
2.1):
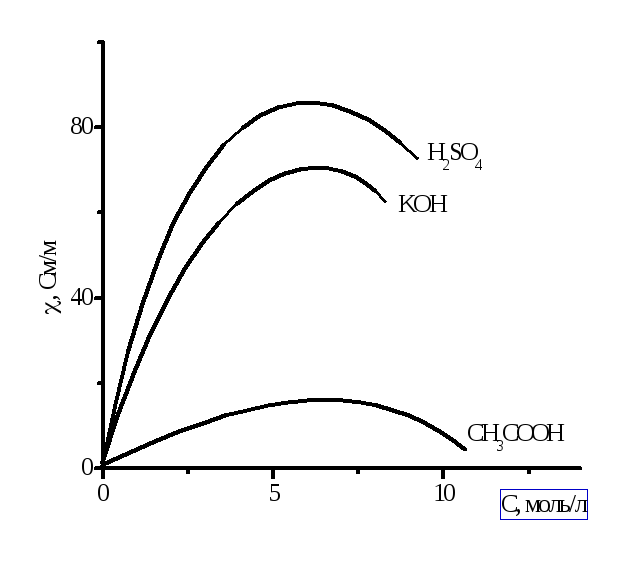
Рисунок 2.1 – Зависимость удельной электрической проводимости от концентрации электролитов в водных растворах
В разбавленных
растворах при С → 0
![]() стремится к удельной электропроводности
воды, которая составляет около 10-6
См/м и обусловлена присутствием ионов
Н3О+
и
ОН-.
С ростом концентрации электролита,
стремится к удельной электропроводности
воды, которая составляет около 10-6
См/м и обусловлена присутствием ионов
Н3О+
и
ОН-.
С ростом концентрации электролита,
![]() вначале увеличивается, что отвечает
увеличению числа ионов в растворе.
Однако, чем больше ионов в растворе
сильных электролитов, тем сильнее
проявляется ионное взаимодействие,
приводящее к уменьшению скорости
движения ионов. У слабых электролитов
в концентрированных растворах заметно
снижается степень диссоциации и,
следовательно, количество ионов,
переносящих электричество. Поэтому,
почти всегда, зависимость удельной
электрической проводимости от концентрации
электролита проходит через максимум.
вначале увеличивается, что отвечает
увеличению числа ионов в растворе.
Однако, чем больше ионов в растворе
сильных электролитов, тем сильнее
проявляется ионное взаимодействие,
приводящее к уменьшению скорости
движения ионов. У слабых электролитов
в концентрированных растворах заметно
снижается степень диссоциации и,
следовательно, количество ионов,
переносящих электричество. Поэтому,
почти всегда, зависимость удельной
электрической проводимости от концентрации
электролита проходит через максимум.
2.1.3 Молярная и эквивалентная электрические проводимости
Чтобы выделить
эффекты ионного взаимодействия, удельную
электрическую проводимость
![]() делят на молярную концентрацию
(С, моль/м3),
и получают молярную
электрическую проводимость
делят на молярную концентрацию
(С, моль/м3),
и получают молярную
электрическую проводимость
![]() ;
или делят на молярную концентрацию
эквивалента и получаютэквивалентную
проводимость.
;
или делят на молярную концентрацию
эквивалента и получаютэквивалентную
проводимость.
![]() .
(2.6)
.
(2.6)
Единицей измерения
![]() является м2См/моль.
Физический смысл эквивалентной
проводимости состоит в следующем:
эквивалентная проводимость численно
равна электрической проводимости
раствора, заключенного между двумя
параллельными электродами, расположенными
на расстоянии 1 м и имеющими такую
площадь, что объем раствора между
электродами содержит один моль эквивалента
растворенного вещества (в случае молярной
электрической проводимости – один моль
растворенного вещества). Таким образом,
в случае эквивалентной электрической
проводимости в этом объеме будет NА
положительных и NА
отрицательных зарядов для раствора
любого электролита при условии его
полной диссоциации (NА
– число Авогадро). Поэтому, если бы ионы
не взаимодействовали друг с другом, то
является м2См/моль.
Физический смысл эквивалентной
проводимости состоит в следующем:
эквивалентная проводимость численно
равна электрической проводимости
раствора, заключенного между двумя
параллельными электродами, расположенными
на расстоянии 1 м и имеющими такую
площадь, что объем раствора между
электродами содержит один моль эквивалента
растворенного вещества (в случае молярной
электрической проводимости – один моль
растворенного вещества). Таким образом,
в случае эквивалентной электрической
проводимости в этом объеме будет NА
положительных и NА
отрицательных зарядов для раствора
любого электролита при условии его
полной диссоциации (NА
– число Авогадро). Поэтому, если бы ионы
не взаимодействовали друг с другом, то
![]() сохранялась бы постоянной при всех
концентрациях. В реальных системах
сохранялась бы постоянной при всех
концентрациях. В реальных системах![]() зависит от концентрации (рисунок 2.2).
При С → 0,
зависит от концентрации (рисунок 2.2).
При С → 0,![]() → 1, величина
→ 1, величина![]() стремится к
стремится к![]() ,
отвечающей отсутствию ионного
взаимодействия. Из уравнений (2.5 и 2.6)
следует:
,
отвечающей отсутствию ионного
взаимодействия. Из уравнений (2.5 и 2.6)
следует:
Произведение
![]() называютпредельной
эквивалентной электрической проводимостью
ионов, или
предельной
подвижностью
ионов:
называютпредельной
эквивалентной электрической проводимостью
ионов, или
предельной
подвижностью
ионов:
![]() .
(2.9)
.
(2.9)
Соотношение (2.9) установлено Кольраушем и называется законом независимого движения ионов. Предельная подвижность является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры. Уравнение для молярной электрической проводимости принимает вид (2.10):
![]() ,
(2.10)
,
(2.10)
где
![]() - число эквивалентов катионов и анионов,
необходимых для образования 1 моль соли.
- число эквивалентов катионов и анионов,
необходимых для образования 1 моль соли.
Пример:
![]()
В случае одновалентного
электролита, например, HCl,
![]() ,
то есть молярная и эквивалентная
электрические проводимости совпадают.
,
то есть молярная и эквивалентная
электрические проводимости совпадают.
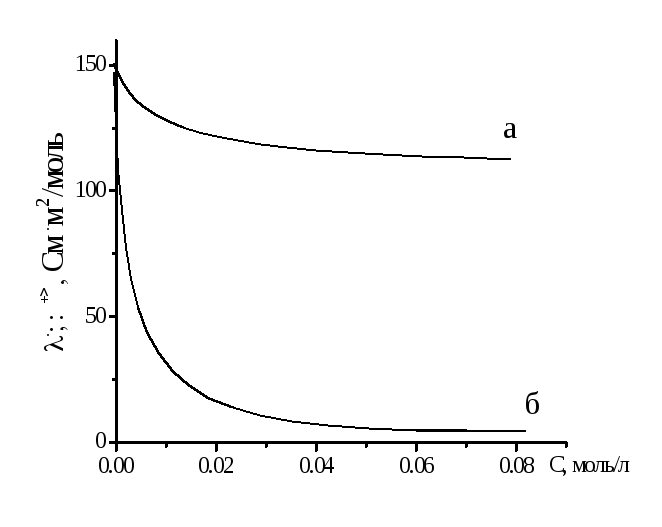
Рисунок 2.2 – Зависимость эквивалентной электропроводности от концентрации для сильных (а) и слабых (б) электролитов
Для растворов
слабых электролитов эквивалентная
электрическая проводимость остается
небольшой вплоть до очень низких
концентраций, по достижении которых
она резко поднимается до значений,
сравнимых с
![]() сильных электролитов. Это происходит
за счет увеличения степени диссоциации,
которая, согласно классической теории
электролитической диссоциации, растет
с разбавлением и, в пределе, стремится
к единице.
сильных электролитов. Это происходит
за счет увеличения степени диссоциации,
которая, согласно классической теории
электролитической диссоциации, растет
с разбавлением и, в пределе, стремится
к единице.
Степень диссоциации можно выразить, разделив уравнение (2.7) на (2.8):
![]() .
.
С увеличением
концентрации
![]() растворов сильных электролитов
уменьшается, но незначительно. Кольрауш
показал, что
растворов сильных электролитов
уменьшается, но незначительно. Кольрауш
показал, что![]() таких растворов при невысоких концентрациях
подчиняется уравнению:
таких растворов при невысоких концентрациях
подчиняется уравнению:
![]() ,
(2.11)
,
(2.11)
где А – постоянная, зависящая от природы растворителя, температуры и валентного типа электролита.
По теории Дебая – Онзагера снижение эквивалентной электрической проводимости растворов сильных электролитов связано с уменьшением скоростей движения ионов за счет двух эффектов торможения движения ионов, возникающих из-за электростатистического взаимодействия между ионом и его ионной атмосферой. Каждый ион стремится окружить себя ионами противоположного заряда. Облако заряда называют ионной атмосферой, в среднем оно сферически симметрично.
Первый эффект – эффект электрофоретического торможения. При наложении электрического поля ион движется в одну сторону, а его ионная атмосфера – в противоположную. Но с ионной атмосферой за счет гидратации ионов атмосферы увлекается часть растворителя, и центральный ион при движении встречает поток растворителя, движущегося в противоположном направлении, что создает дополнительное вязкостное торможение иона.
Второй эффект – релаксационного торможения. При движении иона во внешнем поле атмосфера должна исчезать позади иона и образовываться впереди него. Оба эти процесса происходят не мгновенно. Поэтому впереди иона количество ионов противоположного знака меньше, чем позади, то есть облако становится несимметричным, центр заряда атмосферы смещается назад, и поскольку заряды иона и атмосферы противоположны, движение иона замедляется. Силы релаксационного и электрофоретического торможения определяются ионной силой раствора, природой растворителя и температурой. Для одного и того же электролита, при прочих постоянных условиях, эти силы возрастают с увеличением концентрации раствора.
