
- •Министерство образования и науки
- •1 Растворы
- •1.1 Основные понятия и определения
- •1.2 Способы выражения состава раствора
- •1.3 Закон Рауля. Идеальные растворы
- •1.4 Следствия из закона Рауля
- •1.4.1 Повышение температуры кипения идеального раствора
- •1.4.2 Понижение температуры замерзания раствора
- •1.5 Осмотическое давление
- •1.6 Реальные растворы
- •1.6.1 Отклонения от закона Рауля
- •1.6.2 Активность. Коэффициент активности
- •1.7 Растворимость
- •1.7.1 Растворимость твердых веществ в жидкости
- •1.7.2 Растворимость газов в жидкости
- •1.7.3 Взаимная растворимость жидкостей
- •1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
- •1.8.1 Неограниченно смешивающиеся жидкости
- •1.8.1.1 Состав пара и жидкости. Законы Коновалова
- •1.8.1.2 Разделение бинарных смесей путем перегонки
- •1.8.2 Равновесие жидкость - пар для практически несмеши-вающихся жидкостей
- •1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся жидкостей
- •1.9 Закон распределения Нернста. Экстракция
- •1.10 Примеры решения задач
- •1.11 Вопросы для самоконтроля
- •2 Электрохимия
- •2.1 Электрическая проводимость растворов электролитов
- •2.1.1 Сильные и слабые электролиты
- •2.1.2 Удельная электрическая проводимость
- •2.1.3 Молярная и эквивалентная электрические проводимости
- •2.1.4 Числа переноса
- •2.2 Кондуктометрия
- •2.2.1 Определение растворимости труднорастворимой соли
- •2.2.2 Определение предельной эквивалентной электрической проводимости растворов сильных электролитов
- •2.2.3 Кондуктометрическое титрование
- •2.3 Электродные процессы
- •2.3.1 Основные понятия и определения
- •2.3.2 Классификация электродов
- •2.3.3 Типы гальванических элементов
- •2.3.4 Диффузионный потенциал
- •2.3.5 Потенциометрическое титрование
- •2.4 Скорость электрохимической реакции
- •2.4.1 Поляризационные кривые
- •2.4.2 Перенапряжение
- •2.4.3 Электролиз
- •2.4.3.1 Электролиз водного раствора CuCl2
- •2.4.3.2 Электролиз водного раствора к2sо4 с использованием инертных анодов
- •2.4.3.3 Законы Фарадея
- •2.5 Примеры решения задач
- •2.6 Вопросы для самоконтроля
- •Кинетика
- •3.1 Скорость химической реакции
- •3.2 Кинетическая классификация химических реакций
- •3.2.1 Молекулярность реакции
- •3.2.2 Порядок реакции
- •3.3 Влияние температуры на скорость реакции. Энергия активации
- •3.4 Методы определения порядка реакции
- •3.5 Сложные реакции
- •3.5.1 Параллельные реакции
- •3.5.2 Обратимые реакции
- •3.5.3 Последовательные реакции
- •3.5.4 Сопряженные реакции
- •3.5.5 Метод стационарных концентраций
- •3.6 Примеры решения задач
- •3.7 Вопросы для самоконтроля
- •Литература
1.11 Вопросы для самоконтроля
1. Смешение двух жидкостей сопровождается выделением теплоты и уменьшением объема. Какой тип отклонения от закона Рауля в данной системе?
2. Растворимость твердого вещества в жидкости является идеальной. Как изменится растворимость при понижении температуры?
3. Одинаковы ли величины осмотического давления КСl и сахара в воде, если их моляльности равны?
4. Изобразить
диаграмму двух жидкостей в координатах
(Ткип.-
состав) для системы с положительным
отклонением от закона Рауля, имеющей
азеотроп состава хА
= 0,5; причем
![]() >
>![]() .
.
5. Система, состоящая из жидкостей А и В, имеет максимум на диаграмме (Ткип.- состав). Провести перегонку растворов с хА = 0,8 и хВ = 0,8. Что отгоняется и что остается в кубе?
6. В какой воде – дистиллированной или морской – больше растворяется кислорода?
7. Какие из перечисленных веществ можно перегонять с водяным паром: С6Н6, NaCl,С2Н5ОН, СН3СООН, С6Н5NН2, С10Н8?
8. Коэффициент распределения иода между:
водой и четыреххлористым углеродом - 0,0117;
водой и сероуглеродом - 0,0017;
водой и хлороформом - 0,0074.
Каким из перечисленных экстрагентов наиболее эффективно извлекать иод из водного раствора?
9. Что называется термодинамической активностью?
2 Электрохимия
2.1 Электрическая проводимость растворов электролитов
2.1.1 Сильные и слабые электролиты
Различают проводники первого и второго рода. В проводниках первого рода перенос заряда осуществляется либо при помощи электронов, либо при помощи электронов и дырок. К таким проводникам относятся металлы и полупроводники. В проводниках второго рода электрическая проводимость обусловливается положительными и отрицательными ионами. Это – растворы солей, кислот, щелочей, солевые расплавы, некоторые кристаллы солей.
Вещества, в которых перенос электричества в электрическом поле осуществляется с помощью заряженных частиц – ионов, называются электролитами
Процесс распада растворенного вещества на ионы называют электролитической диссоциацией. Распад на ионы происходит независимо от того, подвергается или не подвергается вещество действию электрического тока. Образование растворов электролитов происходит по двум основным механизмам.
1. Взаимодействие ионов кристалла с диполями растворителя, приводящее к разрушению кристаллической решетки и появлению в растворе сольватированных ионов.
2. Взаимодействие с растворителем вещества, состоящего из нейтральных молекул. Так, при растворении в воде газообразного хлористого водорода получается раствор сильного электролита:
HCl + H2O → H3O+ + Cl-
Образовавшиеся ионы H3O+ и Cl- вступают во взаимодействие с молекулами растворителя, образуя сольватированные ионы.
Электролиты подразделяются на сильные и слабые. К сильным относят вещества, полностью распадающиеся на ионы при растворении. Обычно это соединения, решетка которых построена из ионов (NaCl, CaCl2, CuSО4 и другие). Слабые электролиты распадаются на ионы лишь частично, например, водные растворы аммиака, многих органических кислот. Доля распавшихся молекул на ионы называется степенью диссоциации (α).
Электролитическая диссоциация слабых электролитов носит динамический характер, в растворе непрерывно происходят процессы диссоциации электролита на ионы и соединение ионов в молекулы. К процессу электролитической диссоциации слабых электролитов применим закон действующих масс.
Так, если в результате диссоциации молекул бинарного электролита получается один катион и один анион, то константа диссоциации может быть выражена уравнением (2.1):
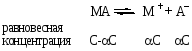 ,
,
где С – начальная концентрация МА; α – степень диссоциации МА.
![]() ,
(2.1)
,
(2.1)
где V=1/C – разведение, объем, в котором содержится 1 моль электролита.
Уравнение (2.1) называется законом разведения Оствальда. По теории Аррениуса константа диссоциации является постоянной для данного электролита и не зависит от концентрации. Из уравнения (2.1) можно рассчитать степень диссоциации в зависимости от концентрации электролита. Решая квадратное уравнение, получаем:
![]() .
(2.2)
.
(2.2)
При малых константах диссоциации и при не очень низких концентрациях К2<<4КС. Поэтому из уравнения (2.2) следует
![]() (2.3)
(2.3)
Уравнения (2.1 - 2.3) применимы только для бинарных электролитов. Для других типов электролитов математические соотношения усложняются. Константа диссоциации (а значит и степень диссоциации) зависит от температуры. Зависимость К = f(Т) определяется по уравнению изобары Вант-Гоффа:
![]() ,
(2.4)
,
(2.4)
где ∆Ндисс - теплота диссоциации, складывающаяся из двух эффектов: теплоты, поглощаемой при распаде молекул на ионы и теплоты гидратации (сольватации) ионов молекулами растворителя. ∆Ндисс может быть больше и меньше нуля.
Из уравнения (2.4) следует, что Кдисс может как расти (при ∆Ндисс > 0), так и убывать (при ∆Ндисс < 0) с ростом температуры.
