
Obschaya_khimia_-_lektsii
.pdf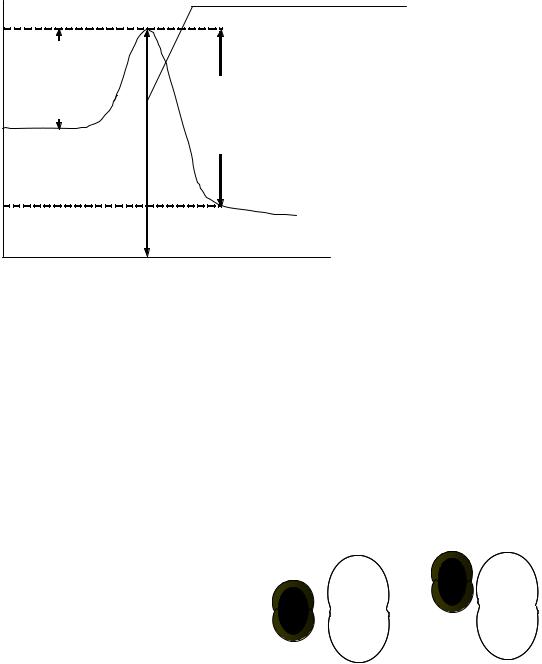
лекулами исходных веществ было активным, называется энергией активации (Еа). Чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры.
энергетическийбарьерреакции
Потенциальная энергия
Еа |
|
|
|
|
прямой |
Еа |
|
|
|
реакции |
Е1 |
– энергиясистемывисходном |
||
А+ В |
обратной |
|||
|
состоянии |
|||
Е1 |
реакции |
Е2 |
||
– энергиясистемывконечном |
||||
|
С+ Д |
|
состоянии |
|
|
|
|
Е2
координатареакции
Рис. 1. Энергетическая диаграмма реакции А + В = С + Д
Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса: k=A е–Ea/RT, где А — предэкспоненциальный множитель; Еа — энергия активации, R — универсальная газовая постоянная, равная 8,31 дж/моль–1К–1; Т — абсолютная температура; е — основание натуральных логарифмов. Предэкспоненциальный множитель А характеризует общее число двойных соударений, а также учитывает число соударений с благоприятной ориентацией. Во многих случаях, особенно при реакциях между сложными молекулами, необходимость ориентации может заметно тормозить скорость реакции. Например, чтобы при простом соударении молекулы йода и молекулы водорода образовались две молекулы йодистого водорода надо, чтобы ориен-
тация молекулы была сходна с той, ко- |
|
|
торая изображена на рис 2a. |
|
|
Экспоненциальный множитель |
|
|
е–Ea/RT характеризует долю активных |
|
|
соударений от общего числа двойных |
|
|
соударений. Так как k –это произведе- |
|
|
ние двух сомножителей А и е–Ea/RT, то k |
а |
б |
(константа скорости) имеет смысл чис- |
Рис. 2а. Ориентация молекул водорода |
|
ла активных соударений. |
и йода при их столкновении: |
|
Температура влияет на оба со- |
а — благоприятная для реакции; |
|
множителя. При увеличении темпера- |
б — неблагоприятная для реакции |
|
туры на 100 ºС предэкспоненциальный множитель увеличивается в 1,2 раза: экспоненциальный множитель увеличивается в 20 тысяч раз. Следова-
71

тельно, увеличение скорости реакции при повышении температуры обусловлено главным образом резким увеличением доли активных соударений. Кроме того, повышение температуры ведет к уменьшению степени е, что является математическим подтверждением увеличения экспоненциального множителя.
(Чем выше температура, тем < RTЕа и тем > А eEa1/ RT )
Зная энергию активации, теория активных соударений позволяет рассчитать общее число эффективных соударений, а отсюда — скорость реакции. Но эта теория не объясняет механизм самого соударения, что является ее недостатком.
Теория активного (переходного) комплекса или теория переход-
ного состояния. Была разработана Э. Вигнером, М. Поляни, Г. Эйрингом, М. Эвансом в 30-х годах XX в.
В ее основу также положено представление о столкновении молекул как непременном условии реакции, но при этом рассматривается механизм столкновения молекул. Согласно этой теории химическая реакция А + В = С
протекает так: А + В Х≠ → С, где А и В — исходные вещества, Х≠ - переходный комплекс, С — продукт реакции. Переходный комплекс — это такое состояние взаимодействующих молекул, когда старые связи еще не разорвались, а новые еще не образовались, но перераспределение связей уже началось. Например, согласно теории активированного комплекса, реакцию взаимодействия молекул водорода и йода можно схематически изобразить так:
+ Н – Н → |
Н…Н →2HI |
I – I |
I … I |
переходный
комплекс
Переходный комплекс надо отличать от промежуточных соединений. Промежуточное соединение — это стабильная молекула и характеризуется определенной длиной химических связей. Переходный комплекс — это неустойчивое состояние реакционной системы, где межатомные расстояния постоянно меняются. Исходные вещества, согласно теории, всегда
находятся в равновесии с переходными комплексами: А + В Х≠ → С. Тогда константа химического равновесия образования переходного комплек-
са равна: K≠x.p. = |
[X≠ ] |
отсюда X≠ = K≠x.p. [A] [B]. |
|
[A] [B] |
|||
|
|
Скорость реакции зависит от концентрации переходного комплекса [X≠ ] : чем больше [X≠ ], тем больше скорость реакции. Но переходные
72

комплексы распадаются, поэтому скорость зависит и от частоты распада переходных комплексов с образованием продуктов реакции.
V = р · [X≠ ] = р · К≠х.р. [А] · [В], где р — частота распада переходного
комплекса. К обычной реакции взаимодействия А + В С +Д применим
закон действующих масс V = k · [А] · [В].Приравняем правые части уравнений: р · К≠х.р. [А] · [В] = k · [А] · [В] и получаем, что k = р · К≠х.р Из последнего уравнения видно, что при данной температуре константа скоро-
сти реакции k зависит от химического равновесия образования переходного комплекса и от частоты распада переходных комплексов. Уравнение k = р · К≠х.р называется основным уравнением теории переходного комплекса.
Понятие о кинетике сложных реакций
Большинство реакций сложные. Сложные реакции протекают через простые реакции, т. е. через несколько стадий. Рассмотрим несколько типов сложных реакций.
1. Последовательные реакции. При последовательных реакциях продукты одной стадии являются исходными для последующей
А→В→С→Д
Если одна из стадий протекает значительно медленнее других, то эта стадия будет определять скорость всего процесса и ее называют лимитирующей стадией. По такому механизму идет гидролиз АТФ и крахмала, окисление питательных веществ до СО2 и Н2О в организме.
2. Параллельные реакции. Реакции, в ходе которых из одних и тех же исходных веществ одновременно образуется несколько продуктов реакции.
А + В
 Д
Д
 Е
Е
Например, реакция разложения гидразина может идти по двум па-
раллельным путям: |
N2Н4 → N2 + 2Н2 |
|
3N2Н4→4NН3 + N2 |
3. Сопряженные реакции. С одним и тем же реагентом могут реагировать одновременно два или более веществ и такие реакции называют-
ся сопряженными. Например: А + В → АВ; А + Д → АД.
В некоторых случаях одна реакция ускоряет своим течением другую. Одна идет самостоятельно, вторая — только в присутствии первой. Синтез пептидов и белков идет только в присутствии реакции гидролиза АТФ. Многие биохимические реакции в организме протекают по механизму сопряженных химических реакций.
73
4. Обратимые реакции протекают в двух противоположных направлениях до установления состояния равновесия, когда скорость обрат-
ной реакции равна скорости прямой: А + В С + Д 5. Цепные реакции протекают с участием свободных радикалов че-
рез ряд регулярно повторяющихся элементарных реакций. Каждая реакция состоит из трех стадий: инициирование цепи — образование свободных радикалов под влиянием облучения, теплового воздействия; рост цепи, обрыв цепи, в результате которого образуются нейтральные молекулы.
По цепному механизму протекают фотохимические реакции, рост опухолей. Например, реакция взаимодействия хлора с водородом может начинаться в результате воздействия света на молекулы хлора с образова-
нием свободных атомов хлора: |
hν |
Cl2 → 2Cl· |
В следующей стадии цепной реакции происходит рост цепи: Cl· + Н2 → НCl + Н·;
Н· + Сl2 → НCl + Cl·.
Третьей стадией цепной реакции является обрыв цепи.
Н· + Н· → Н2; Cl· + Н· → НCl.
6. Фотохимические реакции протекают под действием света. Под действием квантов света hν (h — постоянная Планка, ν — частота излучения) молекулы становятся возбужденными, т. е. активными и вступают в химическое взаимодействие. Фотохимические реакции характеризуются квантовым выходом. Под квантовым выходом понимается число молекул, которые прореагировали при поглощении одного кванта света. Фотохимические реакции лежат в основе механизма зрения, процесса фотосинтеза.
6СО + 6 Н О hν С Н О + 6О .
2 2 → 6 12 6 2
Катализ и катализаторы
Катализ — изменение скорости реакции под действием веществ, которые сами не изменяются ни качественно, ни количественно в конце реакции. Эти вещества называются катализаторами.
Катализатор не влияет на константу химического равновесия. Он только ускоряет или замедляет достижение химического равновесия, но одинаково влияет на константу скорости прямой реакции и на константу скорости обратной реакции.
Катализатор ведет реакцию по пути с меньшей или с большей энергией активации ЕА. Положительный катализатор увеличивает скорость реакции, т. к. уменьшается ЕА; отрицательный катализатор уменьшает скорость реакции и увеличивает ЕА.
Катализатор практически не влияет на общее число соударений, но влияет на энергию активации ЕА.
74
Катализатор может способствовать достижению ориентации, необходимой для взаимодействия молекул.
Различают гомогенный и гетерогенный катализ. Катализаторы, которые находятся в системе в том же фазовом состоянии, что и реагенты, называются гомогенными. Механизм гомогенного катализа можно объяснить на основе теории промежуточных соединений. Согласно этой теории, катализатор образует с реагентами промежуточные соединения, которые уменьшают энергию активации реакции. Например, реакция
2SO2 + О2 → 2SО3 в присутствии оксида азота (II) NО может происходить по схеме:
2NO + О2 → 2NO2 (промежуточное соединение)
NO2 + SO2 → SO3 + NO
Как видно из системы, в суммарное уравнение реакции катализатор NO не входит, т. е. в результате реакции он не изменяется.
Вслучае гетерогенного катализа катализатор и реагенты находятся
вразных фазах и имеют границу раздела. На поверхности твердого катализатора (а точнее на поверхности раздела фаз) реагируют газообразные или жидкие вещества.
Механизм каталитических гетерогенных реакций очень сложен и зависит от природы реакции. Вначале на активных центрах поверхности гетерогенного катализатора происходит процесс хемосорбции молекул исходных веществ, в результате чего происходит: a) локальное увеличение концентрации молекул исходных веществ на активных центрах; б) ослабление химических связей в молекулах исходных веществ, что заставляет их распадаться до атомов, которые реагируют друг с другом и образуют молекулу нового вещества, которое покидает поверхность катализатора. К каталитическим гетерогенным реакциям относятся известные реакции получения аммиака и оксида серы (IV).
N + 3H Fe, 500 oC 2NH
2 2 → 3
2SO + O pt 2SO
2 2 → 3
Биологические катализаторы — ферменты
Химические процессы в живых организмах осуществляются при помощи биологических катализаторов — ферментов. Все известные в настоящее время ферменты являются белками, многие из которых содержат ионы металлов.
Особенности действия ферментов. 1. Высокая каталитическая активность. Ферменты резко снижают ЕА биохимических реакций.
2Н2О2 |
Fe2+ |
|
каталаза→2Н2О + О2; |
ЕА = 42 кДж/моль. |
|
2Н2О2 |
→2Н2О + О2; |
ЕА = 7,1 кДж/моль. |
75
Гидролиз мочевины: кислотой – ЕА = 103 кДж/моль; уреазой ЕА =
28кДж/моль.
2.Высокая специфичность и направленность действия. Напри-
мер, амилаза, которая содержится в слюне, легко и быстро расщепляет крахмал, но не расщепляет сахарозу. Фермент уреаза расщепляет только мочевину.
3.Мягкие условия действия ферментов. Каталитические действие ферментов происходит при температуре 37–40 ºС, невысоком давлении и определенном значении рН.
4.Отсутствие побочных эффектов в биохимических реакциях с участием ферментов.
Общая схема действия ферментов не отличается от обычных ка-
тализаторов.
k1 |
k3 |
Е + S ← [ES] ← P + E |
|
→ |
→ |
k2 |
k4 |
где Е — энзим (фермент); S — субстрат [ES] — фермент-субстратный комплекс; Р — продукт реакции; k1, k2, k3, k4 — константы скорости реакций.
Вследствие изменений активности ферментов возникают болезни. Например, в результате снижения активности фермента тирозиназы, катализирующей реакцию превращения тирозина пигментных клеток в меланин, возникает болезнь альбинизм.
Одним из современных методов лечения болезней, вызванных недостаточностью тех или иных ферментов в организме, является метод введения в организм недостающих или снижающих свою активность ферментов. Однако введение в организм чистых, немодифицированных ферментов приводит к их быстрому разрушению, поэтому необходимы значительные количества этих дорогостоящих препаратов. Один из путей решения этого вопроса состоит в создании иммобилизованных форм ферментов, т. е. связанных различными типами химических связей с органическими или неорганическими носителями.
Лекция 13 Теория возникновения электродных и окислительно-
восстановительных потенциалов. Определение направления редокс-процессов. Окислительно-восстановительное равновесие и процессы в жизнедеятельности организмов
Сила окислителя и восстановителя зависит от его способности принимать и соответственно отдавать электроны. Эта способность характери-
76
зуется величиной стандартного электродного или стандартного ОВ-потен- циала.
Механизм возникновения электродного потенциала.
При погружении металлической пластинки в раствор собственной соли имеют место два основных процесса. Первый процесс — это ионизация металла пластинки, где в узлах кристаллической решетки находятся ионы — атомы:
Ме Меn+ + ne–.
Ионизация происходит под действием полярных молекул растворителя (воды). Образующиеся при этом электроны концентрируются на пластинке, заряжая ее отрицательно, а образующиеся катионы металла переходят с пластинки в раствор и концентрируются возле пластин-
ки (рис. 1).
Второй процесс — это взаимодействие молекул растворителя с ионами металла, т. е. сольвата-
ция образующихся ионов:
Меn+ + mH2O Меn+ · mH2O.
При погружении пластинки металла в раствор вначале преобладает процесс ионизации металла: Ме → Меn+ + nē ,но со временем скорость прямой реакции
уменьшается, а растет скорость обратной реакции:
Меn+ + nē → Ме, пока между этими процессами не установится динамическое равновесие: Ме + mH2O Меn+ · mH2O + nē или упрощенно:
Ме Меn+ + nē.
При этом на границе металл-раствор (твердая фаза — жидкость) устанавливается равновесный двойной электрический слой (ДЭС), состоящий из положительных ионов и электронов. Между положительными ионами и электронами возникает скачок потенциала, который называется электродным потенциалом. Потенциал, возникающий в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. Условное обозначение системы металл-раствор Ме/Ме, где вертикальной чертой отмечена граница раздела твердая фаза-раствор. Система, в которой металл погружен в раствор собственной соли, называется электродом или полуэлементом. Значение электродного потенциала, возникающего на границе металл-раствор, зависит от природы металла, активности ионов этого металла и от температуры.
77
Значения электродных потенциалов рассчитывают по уравнению
Нернста: ϕ |
Men + / Me = ϕ |
0 |
|
+ |
RT |
ln aMen + , где ϕ |
0 |
n+ |
— стандартный |
|
Men + / Me |
|
Ме |
/Ме |
|||||
|
nF |
||||||||
|
|
|
|
|
|
|
|
|
электродный потенциал, измеренный при стандартных условиях (25 ºС
или 298К; аМеn+ = 1 моль/л; R = 8,314 Дж/моль·К, универсальная газовая постоянная; Т — температура по шкале Кельвина; F — число Фарадея, равное 96500 Кл/моль; n — число электронов, теряемых атомом металла при образовании катиона.
Если ввести численные значения постоянных величин и перейти от натуральных логарифмов к десятичным, уравнение Нернста при стандарт-
ной температуре 298 К примет вид: ϕ |
|
n+ |
|
= ϕ0 |
n + |
|
+ |
0,059 |
ln a |
|
n+ . |
Me |
/ Me |
/ Me |
|
Me |
|||||||
|
|
Me |
|
|
n |
|
|||||
|
|
|
|
|
|
|
|
|
|
||
Значение электродного потенциала также зависит от величины заряда иона в растворе. Например, потенциал железного электрода в растворе хлорида железа (III) FeCl3 будет больше потенциала этого же электрода в растворе хлорида железа (II) FeCl2.
Гальванические элементы
Гальванический элемент (химический источник тока) — это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из двух электродов (полуэлементов). Между растворами отдельных электродов устанавливается контакт с помощью электролитического мостика, заполненного насыщенным раствором KCl (солевой мостик) или с помощью мембраны. Они обеспечивают электрическую проводимость между растворами, но препятствуют их взаимной диффузии и являются вместе с электродами внутренней цепью гальванического элемента. Внешняя цепь гальванического элемента — это выводы электродов. По внешней цепи осуществляется переход электронов от одного металла к другому.
Различают гальванические элементы химические (биметаллические) и концентрационные.
Химические гальванические элементы состоят из двух металлов,
опущенных в растворы своих солей.
Примером химического гальванического элемента может служить элемент Якоби-Даниэля (рис. 2).
Он состоит из медного электрода (т. е. медной пластинки, погруженной в раствор CuSO4) и цинкового электрода (цинковой пластинки, погруженной в раствор ZnSO4). На поверхности цинковой пластинки возни-
кает ДЭС и устанавливается равновесие Zn Zn2+ + 2ē. При этом возникает электродный потенциал цинка. Схема электрода будет иметь вид Zn|ZnSO4 или Zn|Zn2+. Аналогично на медной пластинке также возникает
ДЭС и устанавливается равновесие Cu Cu2+ + 2ē. Поэтому возникает
78
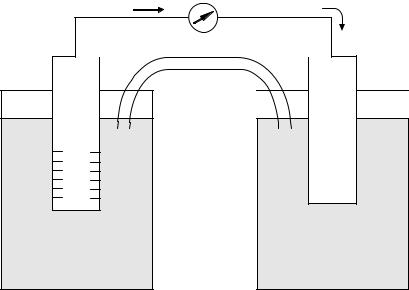
электродный потенциал меди. А схема электрода будет Cu|CuSO4 или Cu|Cu2+. Соединенные солевым мостиком (мембраной), но разомкнутые во внешней цепи оба электрода (гальванический элемент) могут находится сколько угодно времени не изменяясь. Но при замыкании внешней цепи начинают протекать термодинамически необратимые процессы. На Znэлектроде (как электрохимически более активном), протекает процесс окисления: Zn – 2ē →Zn2+.
ē |
ē |
|
Zn |
Cu |
|
Cu |
|
|
анод |
катод |
|
(–) |
(+) |
|
↑ |
|
|
ē |
– |
– |
|
||
|
– |
– |
|
– |
– |
Zn-2ē → Zn2+ |
Cu2+ + 2ē → Cu |
|
р-р ZnSO4 |
р-р CuSO4 |
|
Рис. 2. Гальванический элемент Якоби-Даниэля
Процессы окисления в электрохимии называются анодными процессами, а электроды, на которых идут процессы окисления, называются анодами.
На Cu-электроде (электрохимически менее активном) протекает процесс восстановления: Cu2+ + 2ē → Cu.
Процессы восстановления в электрохимии называются катодными процессами, а электроды, на которых идут процессы восстановления, называются катодами.
При этом электроны, образующиеся на аноде, по внешней цепи двигаются к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммарное уравнение электрохимической реакции: Zn + Cu2+ →Zn2+ + Cu
или Zn + CuSO4 → ZnSO4 + Cu.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов по внутренней цепи элемента, т. е. возникает электрический ток.
79

Схема химического гальванического элемента записывается по правилу «правого плюса». То есть электрод, являющийся катодом (+), пишется справа и его роль играет менее активный металл. Поэтому схема элемента Якоби–Даниэля будет иметь вид:
Zn Zn2+ ║Cu2+ Cu
анод катод Двойная черта в схеме обозначает электролитический контакт меж-
ду электродами, осуществляемый обычно посредством солевого мостика. Он препятствует смешиванию электролитов и обеспечивает протекание электрического тока по внутренней цепи элемента.
В гальваническом элементе между двумя электродами возникает электродвижущая сила (ЭДС), равная разности двух электродных потенциалов. Электродвижущая сила гальванического элемента — величина всегда положительная и рассчитывается по формуле:
Е = ϕ катода – ϕ анода , где ϕкатода > ϕанода.
Отсюда ЭДС медно-цинкового гальванического элемента равна:
Е = ϕCu2+/Cu – ϕZn2+/Zn = ϕ0Cu2+/Cu + RTnF ln a cu2+ – (ϕ0 Zn2+/Zn + RTnF
или Е = ϕCu2+/Cu – ϕZn2+/Zn = ϕ0Cu2+/Cu + 0,059n lg acu 2 + – (ϕ0 Zn2+/Zn + 0,059n lg azn2 + )
Если в это уравнение подставить значение стандартного электродно-
го потенциала цинка (ϕ0 Zn2+/Zn = –0,76 В) и меди (ϕ0Cu2+/Cu = +0,34 В), то мы получим уравнение, которое позволяет рассчитать ЭДС медно–цинкового
гальванического элемента в растворе их солей: Е = 1,1 + 0,059 lg aCu2+
n aZn2+
Гальванический элемент служит источником тока до тех пор, пока весь цинковый электрод (анод) не растворится или не израсходуются из раствора катионы Сu2+, которые разряжаются на катоде.
Концентрационные гальванические элементы состоят из двух одинаковых электродов (например, серебряных), опущенных в растворы одного и того же электролита (например, AgNO3), но разных концентраций. Источником электрического тока в таком элементе служит работа переноса электролита из более концентрированного раствора в более разбавленный. Элемент работает до тех пор, пока сравняются концентрации катионов у анода и катода. Концентрационный гальванический элемент изображают схематически следующим образом:
Ag AgNO3(C1) ║AgNO3(C2) Ag , где С2 > C1
анод катод Уравнение для вычисления ЭДС концентрационных гальванических
элементов имеет вид:
80
