
- •3. Химическая связь и строение молекул
- •3.1. Типы химической связи
- •3.2. Донорно-акцепторный механизм образования связи
- •3.3. Основные характеристики химической связи
- •3.4. Квантово-химическое описание ковалентной связи
- •Основные положения метода валентных связей сводятся к следующему.
- •3.5. Геометрия молекул
- •3.5.1. Гибридные представления
- •3.4.2. Метод Гиллеспи
- •3.6. Метод наложения валентных схем
- •Задачи и упражнения
- •4. Химическая связь в комплексных соединениях
- •4.1. Метод валентных связей
- •4.2. Теория кристаллического поля
3.4.2. Метод Гиллеспи
Простым и удобным методом предсказания геометрии молекул является модель отталкивания локализованных электронных пар или метод Гиллеспи, имеющий в своей основе метод ВС. Исходными данными для указанного метода являются число связанных с центральным атомом других атомов, валентные возможности всех связанных атомов, количество электронов на внешнем слое центрального атома. Основные положения метода Гиллеспи сводятся к следующему.
1. Каждая электронная пара, как образующая связь, так и неподеленная, занимает определённое место в пространстве (локализованная электронная пара). Облако двойной и тройной связи рассматривается как единое. Разумеется, электронные пары (электронные облака) отталкиваются.
2. В зависимости от числа локализованных электронных пар (электронных облаков) они располагаются в пространстве следующим образом:
2 – линейная конфигурация,
3 – правильный треугольник,
4 – тетраэдр,
5 – правильная тригональная бипирамида,
6 – октаэдр,
7 – октаэдр с искажением или правильная пентагональная пирамида.
Процедура работы по методу Гиллеспи примерно следующая. Обозначим центральный атом буквой А, любой связанный с ним другой атом – буквой В, неподелённую электронную пару – буквой Е. Пусть общее число партнёров центрального атома по химической связи – n, а число неподелённых электронных пар у него –m. Тогда рассматриваемая молекула в своеобразном свёрнутом виде относительно центрального атома запишетсяABnEm. Разумеется, в качестве центрального атома выбирается самый многовалентный атом. Сложные, громоздкие молекулы в рамках метода Гиллеспи рассматриваются по частям. В результате суммированияnиmпо предложенному выше методу определяется исходная модель геометрии молекулы или иона, а затем после своеобразного отбрасывания неподелённых электронных пар – собственно геометрия частицы.
Возможные дополнения к методу Гиллеспи:
а) облако двойной связи занимает в пространстве бóльшее место, чем облако однократной связи;
б) облако тройной связи занимает в пространстве бóльшее место, чем облако двойной связи и тем более, чем облако однократной связи;
в) в случае полярной ковалентной связи электронное облако сконцентрировано в большей степени возле более электроотрицательного атома;
г) облако неподелённой электронной пары занимает в пространстве бóльшее место, чем облако однократной связи.
Эти дополнения позволяют производить уточнения к геометрии молекул, отклонения от валентных углов, предсказываемых основной процедурой.
Продемонстрируем возможности метода Гиллеспи на примере нескольких молекул. Начнём с разобранных выше молекул воды и аммиака.
Н2О; АВ2Е2;![]() ;
исходная модель – тетраэдр; молекула
– уголковая, угол Н–О–Н 109о28'.
;
исходная модель – тетраэдр; молекула
– уголковая, угол Н–О–Н 109о28'.
NH3; АВ3Е1;![]() ;
исходная модель – тетраэдр; молекула
– тригональная пирамида, угол Н–N–Н
109о28'. Обратим внимание, что
тетраэдр, являющийся правильной
тригональной пирамидой, более старшая
фигура (центральный атом и четыре
партнёра по химической связи), чем
собственно тригональная пирамида
(центральный атом и три партнёра по
химической связи).
;
исходная модель – тетраэдр; молекула
– тригональная пирамида, угол Н–N–Н
109о28'. Обратим внимание, что
тетраэдр, являющийся правильной
тригональной пирамидой, более старшая
фигура (центральный атом и четыре
партнёра по химической связи), чем
собственно тригональная пирамида
(центральный атом и три партнёра по
химической связи).
Еще несколько примеров.
SnCl2;
АВ2Е1;![]() ;
исходная модель – правильный треугольник;
молекула – уголковая, уголCl–Sn–Clравен 120оили меньше в силу того,
что свободная электронная пара занимает
бóльшее место в пространстве, чем
связывающая пара.
;
исходная модель – правильный треугольник;
молекула – уголковая, уголCl–Sn–Clравен 120оили меньше в силу того,
что свободная электронная пара занимает
бóльшее место в пространстве, чем
связывающая пара.
СО2; АВ2Е0;![]() ;
линейная молекула.
;
линейная молекула.
Анионы кислот проще всего рассматривать также, как и молекулы самих кислот: H2SO4иSO42–AB4E0;H3PO4иPO43–AB4E0;H2СO3и СO32–AB3E0и т.д.
В ряде случаев возможны несколько моделей строения частиц в рамках метода Гиллеспи, выбирается энергетически более выгодная. Например, XeF2;AB2E3; исходная модель – тригональная пирамида, возможны варианты:
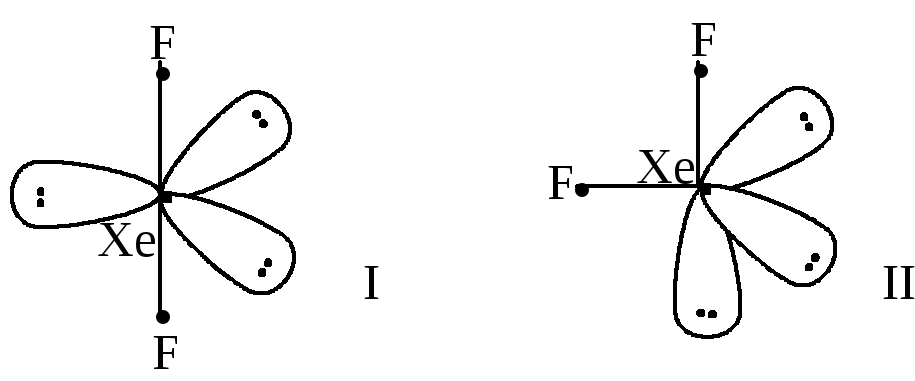
Первый вариант энергетически более выгоден: электронные пары максимально разведены, максимально удалены и атомы фтора, имеющие одинаковые эффективные заряды. Вывод: молекула XeF2– прямолинейна.
