
- •3. Химическая связь и строение молекул
- •3.1. Типы химической связи
- •3.2. Донорно-акцепторный механизм образования связи
- •3.3. Основные характеристики химической связи
- •3.4. Квантово-химическое описание ковалентной связи
- •Основные положения метода валентных связей сводятся к следующему.
- •3.5. Геометрия молекул
- •3.5.1. Гибридные представления
- •3.4.2. Метод Гиллеспи
- •3.6. Метод наложения валентных схем
- •Задачи и упражнения
- •4. Химическая связь в комплексных соединениях
- •4.1. Метод валентных связей
- •4.2. Теория кристаллического поля
4.2. Теория кристаллического поля
Поскольку комплексообразователем является в большинстве случаев катион металла, а лигандами – анионы или сильно полярные молекулы, то электростатическое взаимодействие вносит существенный вклад в энергетику комплексообразования. Именно на этом акцентирует внимание теория кристаллического поля (ТКП). Её название отражает тот факт, что электростатическое взаимодействие характерно в первую очередь для кристаллов ионных соединений.
Основные положения теории.
1. Связь между комплексообразователем и лигандами рассматривается как электростатическая.
2. Лиганды считаются точечными ионами или точечными диполями, их электронное строение игнорируется.
3. Лиганды и комплексообразователь считаются жестко закрепленными.
4. Подробно рассматривается электронное строение комплексообразователя.
Рассмотрим наиболее распространённые октаэдрические комплексы (рис. 4.1), проанализируем взаимодействие лигандов с электронными орбиталями центрального иона (рис. 4.2 и 4.3).
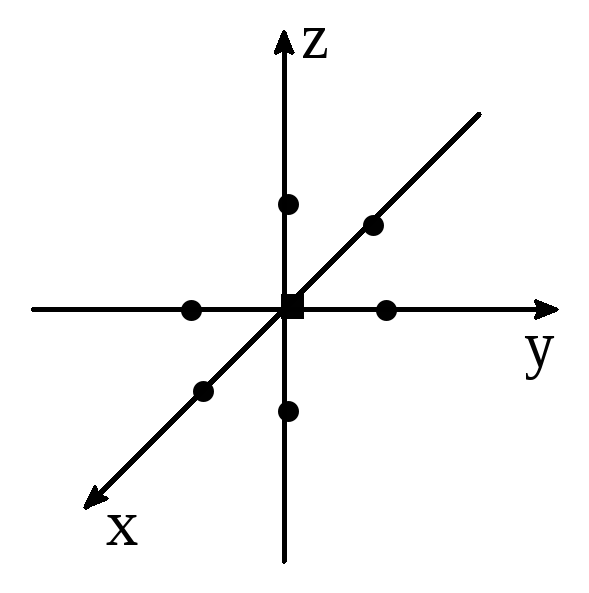
Рис. 4.1. Ион-комплексообразователь в октаэдрическом поле лигандов

Рис. 4.2. Взаимодействие лигандов с s- иp-орбиталями
в октаэдрическом поле

Рис. 4.3. Взаимодействие лигандов с d-орбиталями
в октаэдрическом поле
Как видно из рис.
4.2 s- иp-орбитали
одинаково взаимодействуют с лигандами.
В случаеd-орбиталей две
из пяти “смотрят” прямо на лиганды, а
три другие – мимо них (на рис. 4.3 приведено
только сечение плоскостьюzyдля орбиталиdzy;
для орбиталейdzxиdxyаналогично). Иными словами, орбитали![]() взаимодействуют с лигандами сильнее,
чем орбиталиdzy,dzx,dxy.
Следовательно, в октаэдрическом поле
лигандов пять изначально одинаковых
по энергии орбиталей (говорят “пятикратно
вырожденный уровень”) расщепляются на
две группы: орбитали
взаимодействуют с лигандами сильнее,
чем орбиталиdzy,dzx,dxy.
Следовательно, в октаэдрическом поле
лигандов пять изначально одинаковых
по энергии орбиталей (говорят “пятикратно
вырожденный уровень”) расщепляются на
две группы: орбитали![]() будут иметь энергию выше, чем орбиталиdzy,dzxиdxy(рис. 4.4). Величина Δоктназывается
энергией расщепления и является в рамках
ТКП тем самым выигрышем в энергии,
обуславливающим образование пар
электронов или сохранение электронного
состояния центрального иона в комплексе.
будут иметь энергию выше, чем орбиталиdzy,dzxиdxy(рис. 4.4). Величина Δоктназывается
энергией расщепления и является в рамках
ТКП тем самым выигрышем в энергии,
обуславливающим образование пар
электронов или сохранение электронного
состояния центрального иона в комплексе.

Рис. 4.4. Расщепление d-уровня в октаэдрическом поле лигандов
