
CHEm_zao_s
.pdfНАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
МВ · νВ + МР-ЛЯ · νР-ЛЯ = mР-РА или МВ · nВ + МР-ЛЯ · nР-ЛЯ = mР-РА.
Из полученного соотношения легко вывести формулу любой другой концентрации.
ПРИМЕР: С% = mВ 100 / mР-РА = МВ · nВ 100 / (МВ · nВ + МР-ЛЯ · nР-ЛЯ).
Задания к разделу 3
1. |
Какой объем оксида углерода |
6. |
К раствору, содержащему |
|||||
|
(IV) необходим для взаимо- |
|
хлорид бария, добавили 200 |
|||||
|
действия с 5 л раствора гид- |
|
мл раствора Н2SO4 с концен- |
|||||
|
роксида натрия с концентра- |
|
трацией 2 моль/л. Какая соль |
|||||
|
|
|
ρ |
3 |
|
при |
этом образовалась и в |
|
|
цией 1,2 % ( |
= 1,1 г/см ) при |
|
каком количестве (г)? |
||||
|
образовании кислой соли? |
|
||||||
2. |
Вычислить молярность рас- |
7. |
К раствору, содержащему 20 |
|||||
|
твора |
КОН, |
полученного |
|
г нитрата серебра прибавили |
|||
|
при сливании 100 мл 10 %- |
|
80 мл раствора хлорида на- |
|||||
|
го раствора (ρ = 1,12 г/см3) |
|
трия (ρ = 1,1 г/см3), С% = 30 |
|||||
|
|
|
|
ρ |
|
%. Какое вещество и в каком |
||
|
и 200 мл 20 %-го раствора ( |
|
|
|
|
|||
|
= 1,2 г/см3). V полученного |
|
количестве (г) осталось в |
|||||
|
раствора принять равным |
|
растворе после реакции? |
|||||
|
300 мл. |
|
|
|
|
|
|
|
3. |
К 1 л 10 %-го раствора КОН |
8. |
При |
добавлении |
избытка |
|||
|
ρ |
|
3 |
|
нитрата серебра к |
раствору |
||
|
( |
= 1,23 г/см ) прилили 0,5 л |
|
СаСI2 образовалось 60 г |
||||
|
5 |
%-го |
раствора (ρ = 1,09 |
|
||||
|
г/см3). Смесь разбавили во- |
|
осадка. Сколько моль СаСI2 |
|||||
|
дой до 5 л. Вычислить СМ. |
|
было в растворе? |
|
||||
4. |
В 600 мл раствора содержит- |
9. |
В 1 л воды растворили 666 г |
|||||
|
ся 11,76 г H3PO4. Определить |
|
КОН, ρ = 1,395 г/см3. Опре- |
|||||
|
СМ. |
|
|
|
делить СМ. |
|
||
5. |
К 4 л 16 %-го раствора HNO3 (ρ |
10. |
К 3 л 10 %-го раствора HNO3 (ρ = |
|||||
|
= 1,6 г/см3) прибавили 5 л 2 %-го |
|
1,54 г/см3) прибавили 5 л 2 %-го |
|||||
|
раствора той же кислоты (ρ = |
|
раствора той же кислоты (ρ = |
|||||
|
1,009 г/см3). Определить С% и |
|
1,009 г/см3). Определить С% и |
|||||
|
СМ, если считать, что объем по- |
|
СМ, если считать, что объем по- |
|||||
|
лученного раствора равен 9 л. |
|
лученного раствора равен 8 л. |
|||||
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Продолжение задания к разд. 3
11. |
Сколько моль гидроксида |
18. |
Сколько (г) воды необхо- |
||
|
калия |
необходимо доба- |
|
димо прибавить к 200 г 68 |
|
|
вить к 40 г гидроксида |
|
%-го раствора азотной ки- |
||
|
алюминия для его полного |
|
слоты, чтобы получить 10 |
||
|
растворения? |
|
%-й раствор? |
|
|
12. |
Из 900 г 60 %-го раствора |
19. |
Из 700 г 60 %-го раствора |
||
|
H2SO4 выпарили 100 г во- |
|
H2SO4 выпарили 200 г во- |
||
|
ды. Чему равна С% полу- |
|
ды. Чему равна С% полу- |
||
|
ченного раствора? |
|
ченного раствора? |
||
13. |
К 3 л 1 %-го раствора HNO3 (ρ |
20. |
Насыщенный при 15 °С рас- |
||
|
= 1,004 г/см3) прибавили 3 л 2 |
|
твор К2СО3 содержит 51,3 % |
||
|
%-го раствора той же кислоты |
|
растворенного |
вещества. |
|
|
(ρ = 1,009 г/ г/см3). Опреде- |
|
Плотность раствора 1,563 г/мл. |
||
|
лить С% и СМ, если считать, |
|
Вычислить, сколько содержит- |
||
|
что объем полученного рас- |
|
ся в 1 л раствора: а) граммов |
||
|
твора равен 6 л. |
|
К2СО3; б) молей К2СО3. |
||
14. |
Сколько мл 96 %-го рас- |
21. |
Сколько мл 96 %-го рас- |
||
|
твора серной кислоты (ρ = |
|
твора серной кислоты (ρ = |
||
|
1,84 г/см3) необходимо |
|
1,84 г/ см3) |
необходимо |
|
|
взять для приготовления 1 |
|
взять для приготовления 2 |
||
|
л 0,5 М раствора кислоты? |
|
л 0,5 М раствора кислоты? |
||
15. |
|
ρ |
22. |
Смешали 100 мл 50 %-го |
|
|
Смешали 100 мл 10 %-го ( |
|
|
|
|
|
= 1,22 г/см3) и 200 мл 20 %- |
|
раствора H2SO4 (ρ = 1,4 г/ |
||
|
го раствора гидроксида на- |
|
см3) и 100 мл 10 %-го рас- |
||
|
трия (ρ = 1,34 г/см3). Вы- |
|
твора H2SO4 (ρ = 1,08 г/ |
||
|
числить СМ в полученном |
|
см3). Смесь разбавили во- |
||
|
растворе. |
|
дой до 3 л. Определить СМ. |
||
16. |
Какие V 60 %-й H2SO4 (ρ = |
23. |
Определить С% раствора, |
||
|
1,5 г/см3) и 14 %-й H2SO4 (ρ |
|
полученного |
испарением |
|
|
= 1,1 г/см3) нужно смешать, |
|
500 мл воды из 1 л 5 %-го |
||
|
чтобыполучить10 л27 %-го |
|
раствора NaCl |
(ρ = 1,02 |
|
|
раствора(ρ= 1,2 г/ см3)? |
|
г/см3). |
|
|
17. |
Сколько (г) воды надо |
24. |
Сколько мл 30 %-го рас- |
||
|
взять |
для приготовления |
|
твора HNO3 (ρ = 1,21 г/см3) |
|
|
1,5 % |
раствора хлорида |
|
нужно взять для приготов- |
|
|
натрия из 10 г NaCl? |
|
ления 0,5 л 1 М раствора? |
||
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
|
|
|
|
|
Продолжение задания к разд. 3 |
||
25. |
Какой объем 96 %-го раствора |
32. |
В составе фосфорита содер- |
|
|||
|
H2SO4 (ρ = 1,84 г/см3) необхо- |
|
жится 25% фосфата кальция. |
|
|||
|
димо взять для приготовления |
|
Сколько г фосфорита нужно |
|
|||
|
100 г 0,2 М раствора? |
|
|
|
взять, чтобы в нем содержа- |
|
|
|
|
|
|
|
|
лось 5 кг Р. |
|
26. |
Какой |
объем 2 М |
раствора |
33. |
В 250 г 98 %-го раствора |
|
|
|
азотной кислоты можно при- |
|
Н3РО4 растворили 14,2 г окси- |
|
|||
|
готовить из 50 мл 100 %-й |
|
да фосфора (V). Определить |
|
|||
|
азотной кислоты (ρ = 1,34 г/ |
|
С% полученного раствора. |
|
|||
|
см3) ? |
|
|
|
|
|
|
27. |
Из 700 г 60 %-ого раствора |
34. |
Какие объемы 36,5 %-й соля- |
|
|||
|
серной кислоты выпаривани- |
|
ной кислоты (ρ = 1,18 г/см3) и |
|
|||
|
ем удалили 200 г воды. Чему |
|
воды необходимо взять для |
|
|||
|
равна С% полученного рас- |
|
приготовления 500 г М раство- |
|
|||
|
твора. |
|
|
|
|
ра? |
|
28. |
К 0,1 л 96 %-го раствора |
35. |
500 мл насыщенного рас- |
|
|||
|
H2SO4 (ρ = 1,84 г/см3) при- |
|
твора хлорида магния, со- |
|
|||
|
бавили 0,4 л воды |
(ρ = |
|
держащего 100,3 г MgCl2 в |
|
||
|
1г/см3). Получился рас- |
|
100 мл раствора, разбавили |
|
|||
|
твор |
плотностью |
|
1,225 |
|
до 1000 мл. Определить СМ |
|
|
г/см3. Определить С%,СМ. |
|
полученного раствора. |
|
|||
29. |
Цинковый сплав массой 25 г |
36. |
Какой объем водорода при н.у. |
|
|||
|
обработали избытком раствора |
|
выделится при взаимодействии |
|
|||
|
H2SO4. Выделился водород |
|
1 г алюминия с 50 мл раствора |
|
|||
|
объемом 4 л. Определить мас- |
|
соляной кислоты с массовой |
|
|||
|
совую долю Zn в составе спла- |
|
долей 0,3 (ρ = 1,4 г/см3)? |
|
|||
|
ва. |
|
|
|
|
|
|
30. |
Человек должен |
потреб- |
37. |
Смешали 100 г глюкозы, 1 |
|
||
|
лять 300 мг Mg в сутки. |
|
л воды (ρ = 1 г/см3) и 1 л |
|
|||
|
Сколько (л) воды нужно |
|
этанола (ρ = 0,8 г/мл). Оп- |
|
|||
|
выпить, при содержании в |
|
ределить С% этанола и са- |
|
|||
|
ней 0,6 г/л MgCl2? |
|
|
|
харозы в составе смеси. |
|
|
31. |
Вычислить С% и СМ рас- |
38. |
Какие объемы 20 %-го (ρ = |
|
|||
|
твора, |
полученного |
при |
|
1,14 г/см3) и 6 %-го (ρ = 1,04 |
|
|
|
добавлении к 70 мл 4 %-го |
|
г/см3) растворов серной ки- |
|
|||
|
раствора бромида |
натрия |
|
слоты необходимо смешать, |
|
||
|
(ρ4% = 1,11 г/см3 и ρразб = |
|
чтобы приготовить 5 л 10 %- |
|
|||
|
1,5 г/см3 ) 10,5 г кристал- |
|
го раствора (ρ = 1,07 г/см3)? |
|
|||
|
лического NaBr. |
|
|
|
|
|
|
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Продолжение задания к разд. 3
39. |
Сколько л аммиака (н.у.) |
45. |
Сколько литров газообраз- |
||||||
|
необходимо растворить в |
|
ного хлороводорода (н.у.) |
||||||
|
200 мл воды для получе- |
|
надо |
растворить, чтобы |
|||||
|
ния 10 %-го |
раствора |
|
получить 10 л 0,1М рас- |
|||||
|
NH4OH? |
|
|
|
твора? |
|
|
||
40. |
Из |
400 г 20 % раствора |
46. |
В составе фосфорита со- |
|||||
|
при |
охлаждении |
|
выдели- |
|
держится |
25 % |
фосфата |
|
|
лось 50 г вещества. Оп- |
|
кальция. Сколько г фосфо- |
||||||
|
ределить CМ оставшегося |
|
рита нужно взять, чтобы в |
||||||
|
раствора, если |
ρ = 1,1 |
|
нем содержалось 5 кг Р. |
|||||
|
г/см³? |
|
|
|
|
|
|
|
|
41. |
В 2 л 96 % этилового |
47. |
Какой объем воды надо |
||||||
|
спирта (ρ = 0,84 г/см3) |
|
прибавить к 100мл 20 %-го |
||||||
|
растворили 400 г С6Н12О6. |
|
раствора |
серной |
кислоты |
||||
|
Определить С% глюкозы и |
|
(ρ=1,14 г/мл), чтобы полу- |
||||||
|
спирта в полученной сме- |
|
чить 5 %-й раствор. |
||||||
|
си. |
|
|
|
|
|
|
|
|
42. |
Каковы С% и СМ раствора |
48. |
При |
неполном |
сгорании |
||||
|
хромата калия, получен- |
|
углерода, образуется угар- |
||||||
|
ного сливанием 150 мл 40 |
|
ный газ, концентрация ко- |
||||||
|
|
ρ |
= 1,39 |
|
торого в помещении V = |
||||
|
%-го раствора ( |
|
|
60 m3 cоставит 0,2 мг/л. |
|||||
|
г/см3) и 350 мл 10 %-го |
|
|||||||
|
раствора (ρ = 1,08 г/см3)? |
|
Определить массу сгорев- |
||||||
|
Изменением объема пре- |
|
шего угля. |
|
|||||
|
небречь. |
|
|
|
|
|
|
|
|
43. |
Смешали 1кг цемента, 3 л |
49. |
Сколько мл 96% Н2SО4 (ρ |
||||||
|
воды (ρ = 1 г/см3) и 4кг |
|
= 1,84 г/мл) нужно взять |
||||||
|
речного песка. Опреде- |
|
для приготовления 1л 40% |
||||||
|
лить С% всех компонентов |
|
раствора |
аккумуляторной |
|||||
|
в составе смеси. |
|
|
|
кислоты (ρ = 1,62 г/мл). |
||||
44. |
К 1 л 60 %-го раствора |
50. |
Сколько л SO3 при н.у. на- |
||||||
|
HPO3 (ρ = 1,7 г/см3) доба- |
|
до растворить в 600 г во- |
||||||
|
вили 2 л воды. Опреде- |
|
ды, чтобы получить 25 %- |
||||||
|
лить С% полученного рас- |
|
й раствор серной кислоты? |
||||||
|
твора. |
|
|
|
|
|
|
|
|
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Окончание задания к разд. 3
51. |
В |
замкнутом |
пространстве |
55. |
Если |
в закрытом |
помещении |
|
(V=150 м3) разбита бутылка с |
|
без вентиляции (объемом 150 |
||||
|
H2SO4 (V=1л, с=96%, ρ = 1,84 |
|
м3) разбита бутылка с серной |
||||
|
г/мл), которая находилась в |
|
кислотой (V=1л, ρ = 1,84 г/мл), |
||||
|
цинковом ведре. Опасна ли |
|
которая находилась в оцинко- |
||||
|
эта ситуация, если выделяется |
|
ванном ведре, то может выде- |
||||
|
Н2S. Порог чувствительности |
|
литься 0,82 мг/л Н2S. Опреде- |
||||
|
составляет 0,002 мг/л, а от- |
|
лить |
процентную |
концентра- |
||
|
равление наступает при 0,2 |
|
цию исходной кислоты. |
||||
|
мг/л. |
|
|
|
|
|
|
52. |
До какого объема нужно |
56. |
Если готовить 300 мл 5% |
||||
|
разбавить 500 мл 20% рас- |
|
|
|
ρ |
||
|
твора NaCl (ρ= 1,152 г/см³), |
|
раствора сульфата меди ( = |
||||
|
|
1,05 г/мл) из медного купо- |
|||||
|
|
|
ρ |
|
роса, |
сколько г |
этого реа- |
|
чтобы получить 4,5% р-р ( |
|
гента потребуется? |
||||
|
= 1,029г/см³)? |
|
|
||||
53. |
Природный газ состава: метан |
57. |
Если из 600 г раствора сер- |
||||
|
(CH4) – 96 %, этан (C2H6) – 2 |
|
ной кислоты, содержащейся |
||||
|
%, оксид углерода (CO) – 1% |
|
в аккумуляторе, в процессе |
||||
|
и диоксид углерода (CO2) – |
|
работы выпарилось 50 г во- |
||||
|
1%, сжигается в бытовой га- |
|
ды, а |
исходная концентра- |
|||
|
зовой плите. Сколько л возду- |
|
|||||
|
|
ция кислоты составила 40 %, |
|||||
|
ха |
расходуется |
на сжигание |
|
|||
|
|
какова концентрация остав- |
|||||
|
каждого кубометра газа? |
|
|||||
|
|
шегося раствора? |
|
||||
|
|
|
|
|
|
||
54. |
При сгорании смеси газов: |
58. |
Сколько м3 воздуха потребу- |
||||
|
C3H8 (пропан) – 40% (об.), |
|
ется для сжигания в бытовой |
||||
|
C4H10 (бутан) – 55% (об.), |
|
газовой плите 10 м3 природ- |
||||
|
негорючие примеси – 5% |
|
ного газа, имеющего в своем |
||||
|
(об.), образуется СО2 и вода. |
|
составе метан (CH4) – 93%, |
||||
|
Сколько л воздуха потребу- |
|
этан (C2H6) – 4% и 3% него- |
||||
|
ется для сгорания 500 л та- |
|
рючих примесей? |
|
|||
|
кой смеси? |
|
|
|
|
|
|
4. Строение атомов. Периодическая система элементов.
Атом состоит из положительно заряженного ядра, вокруг которого на определенных энергетических уровнях, пребывают

ПОЛИМЕРОВ |
электроны. Количество электронов в атоме определяется зарядом |
||||||
ядра. В периодической системе элементов, порядковый номер |
|||||||
РАСТИТЕЛЬНЫХ |
|||||||
элемента – это заряд ядра атома. |
|
|
|||||
Состояние электрона в атоме водорода описывается волно- |
|||||||
вым уравнением, |
в результате решения которого появились три |
||||||
УНИВЕРСИТЕТА |
|||||||
постоянные величины, определяющие энергию электрона и его |
|||||||
положение вблизи ядра (n, l, m L). Эти величины названы кван- |
|||||||
товыми числами. Четвертая величина (m S) характеризует соб- |
|||||||
ТЕХНОЛОГИЧЕСКОГО |
|||||||
ственный момент вращения электрона и может быть положи- |
|||||||
тельным или отрицательным. Полученные величины обозначают |
|||||||
латинскими буквами n, l, m L и m S: |
|
|
|||||
|
|
n1 |
n- главное квантовое число; l- побоч- |
||||
ГОСУДАРСТВЕННОГО |
Ядро атома |
||||||
|
|
n2 |
ное или орбитальное квантовое число; |
||||
|
|
|
m L - магнитное квантовое число; m S - |
||||
|
|
n3 |
спиновое квантовое число или спино- |
||||
|
|
|
вый момент. |
|
|
||
ПЕТЕРБУРГСКОГО |
|
|
|
|
|
||
|
|
|
Главное квантовое число (n) – |
||||
может принимать любые целочисленные значения от 1, 2, 3… до |
|||||||
… ∞ и характеризует уровень энергии электрона, а также услов- |
|||||||
САНКТ- |
|||||||
ный радиус атомной орбитали (АО), на которой он пребывает. |
|||||||
ЦЕНТР |
В |
периодической |
системе элементов, главное |
квантовое |
|||
число означает номер периода. Часто, электронные уровни обо- |
|||||||
ИНФОРМАЦИОННЫЙ |
|||||||
значают соответствующими буквами: K, L, M, N, O и т.д. На ри- |
|||||||
сунке |
концентрические |
окружности |
показывают |
положение |
|||
атомных орбиталей с определенным уровнем энергий, соответст- |
|||||||
НАУЧНО- |
|
|
|
|
|
|
|
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
вующих главным квантовым числам, при условии, что АО имеют сферическую форму.
Орбитальное квантовое число (l) – характеризует форму атомных орбиталей. Изменение форм орбиталей связано с необходимостью поддерживать в атоме минимальную потенциальную энергию собственных электронов, поскольку это соответствует устойчивому равновесному состоянию. Когда электронов один или два, минимальная потенциальная энергия сохраняется за счет движения электрона в области, имеющей сферическую форму. Это обеспечивает ему кратчайшее расстояние до ядра. На одном энергетическом уровне, например, при n = 1, могут находиться 2 электрона с противоположными спиновыми моментами.
Количество электронов 3 или 4 вынуждает их перейти на более высокий уровень n = 2 с сохранением аналогичной формы орбитали. Однако, существенное отличие одноэлектронного атома от много-электронного заключается в том, что в последнем (в результате взаимодействия электронов, их взаимного отталкивания и эффекта экранирования) происходит расщепление энергетического уровня на подуровни. В связи с этим, на 2-м, 3-м, 4-м и т.д. энергетических уровнях появляются новые формы существования электронов, то есть новые формы АО с минимумом потенциальной энергии. Новые формы АО, предположительно, полусферы, расположенные в пространстве различным способом. Их энергия может быть близка энергии соответствующих уровней, но в больших периодах происходят значительные смещения.
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
На каждом энергетическом уровне существует свой набор форм орбиталей. Значения l соответствуют этим формам и могут быть равными 0, 1, 2, 3, …∞. Количество этих значений строго определяется числом энергетических уровней. Так при n = 1, l
принимает одно значение 0; при n = 2 → l принимает два значе-
ния 0 и 1; при n = 3 → l принимает три значения 0, 1, 2 и т.д. Формы орбиталей имеют свои обозначения:
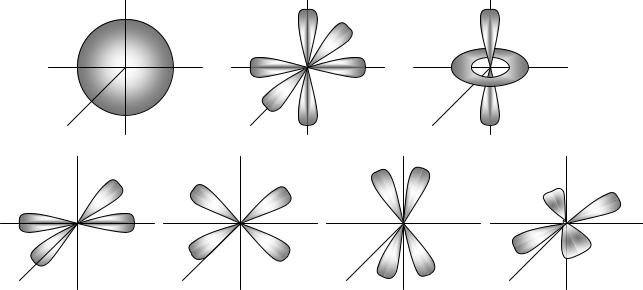
0 - s (сферическая); 1 - p (две полусферы, на рисунке обозначены в виде объемных восьмерок); 2 - d (четыре полусферы или две полусферы и тор); 3 - f и т. п.
|
|
z s -форма |
|
z |
z |
dz2 -форма |
|
|
|
|
|
РZ-форма |
|
|
|
x |
|
|
x |
|
|
|
|
|
x |
||
|
|
PY - форма |
РX |
-форма |
|
|
|
|
|
y |
|
||
y |
|
|
|
y |
|
|
|
|
|
|
|
|
|
z |
2 |
2 |
z |
|
z |
z |
d(х |
-y )форма |
dхz -форма |
dyz -форма |
dxy -форма |
||
|
|
x |
|
x |
x |
x |
y |
|
y |
|
y |
y |
|
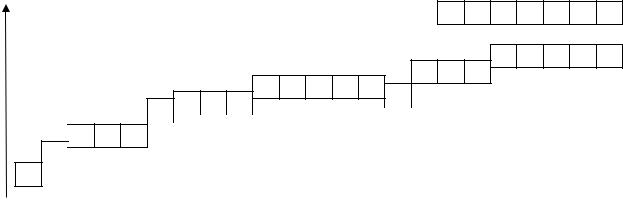
Если энергетический уровень (n) обозначить в виде ячейки, то s- подуровню будет соответствовать 1 ячейка, р - подуровню 3 ячейки, d- подуровню 5 ячеек, f-подуровню 7 ячеек и т.д. При этом номер n записывается в виде цифры слева. АО располагаются в соответствии с рос-
томэнергиивследующемряду: 1s < 2s < 2p < 3s < 3p < 4s ≤3d < 4p < 5s
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
≤4d < 5p < 6s ≤4f ≤5d < 6p < 7s.
Е |
4f |
|
4d
4р
|
|
|
3d |
4s |
|
|
|
3p |
|||
3s |
|||||
|
|||||
|
|
||||
 2р 2s
2р 2s
1s
Магнитное квантовое число (m L) – указывает на способы расположения АО в пространстве. Так, сферическая форма может быть расположена единственным способом относительно начала системы координат, поэтому для нее mL принимает одно значение равное 0. Для р – форм орбиталей m L примет три значения: – 1, 0, +1, так как они располагаются относительно начала координат по осям х, у и z. Для d – формы орбиталей m L примет пять значений: –2, –1, 0, +1, +2 и т.д. Количество m L значений можно рассчитать по формуле 2l +1.
Спиновое квантовое число (mS) – объясняет возможность существования двух электронов на одной атомной орбитали. Оно характеризует собственный момент количества движения электрона. Условно, это можно представить, как «вращение» электрона вокруг собственной оси. «Вращение» по часовой стрелке принято называть положительным спином, при котором m S = +1/2, - против часовой стрелки – отрицательным спином, при этом m S = –1/2. Два электрона с противоположными спинами не будут отталкиваться друг от друга, и, следовательно, могут суще-

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
ствовать на одной АО.
Таким образом, каждый электрон в атоме имеет свою полную строго индивидуальную характеристику, определяемую квантовыми числами. Последовательный перечень квантовых чисел в виде цифр, форм атомных орбиталей и числа содержащихся на них электронов называется электронной формулой.
Электроны заполняют атомные орбитали в соответствии с тремя основными положениями.
1) На одной орбитали одновременно может находиться только два электрона с противоположными спинами. Это утверждение называется принципом Паули.
Если электрон с положительным спином обозначить стрелкой направленной вверх, а с отрицательным спином – вниз, то в одной ячейке окажется два электрона.
2) Суммарный спиновый момент электронов должен быть максимален (правило Хунда).
Возможный вари- |
|
|
|
-верное заполнение АО, т.к. |
||
ант |
нахождения |
|
|
|
∑ mS = 0+1/2+1/2 =1 |
|
двух электронов на |
|
|
|
-неверное |
расположение |
|
одной АО |
|
|
|
электронов, так как ∑mS = 0 |
||
|
|
|
|
|
|
|
3) Электроны стремятся заполнить атомные орбитали с минимальным значением энергии. Данное правило называется правилом минимума энергии и полностью соответствует правилу Клечковского, которое определяет минимальный уровень энергии АО по сумме n + l.
Изображение квантового состояния электронов в атоме называ-
