
zlobin
.pdf
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Чем больше объем газа, тем дальше находится изохора от оси ординат.
7.3. Изобарный процесс
Процесс, протекающий при постоянном давлении, называют изобар-
ным (dp 0 или p const). Кривая процесса называется изобарой. На рис. 7.3 изображен график процесса.
Из уравнения состояния идеального газа для изобарного процесса находим:
v / T R/ p p const .
Это соотношение называется законом Гей-Люссака. Для процесса 1-2:
v1 / v2 T1 / T2 2 / 1. |
(7.4) |
p
1  2
2
p1v1T1 p2v2T2 v
Рис.7.3. Изобарный процесс на р-v диаграмме
В изобарном процессе объемы одного и того же количества газа изменяются прямо пропорционально абсолютным температурам.
При расширении газа его температура возрастает, при сжатии — уменьшается.
Удельная работа изменения объема при этом выражается следующим уравнением:
v2
l p dv p v2 v1 , |
(7.5) |
v1 |
|
или
l R T2 T1 R t2 t1 . |
(7.6) |
Удельная располагаемая (полезная) внешняя работа:
2
l' vdp 0.
1
Изменение удельной внутренней энергии:
81
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
u u2 u1 cv t2 t1 .
Основное уравнение первого закона термодинамики при p const (dp 0) имеет вид:
qp cpdt dh.
Следовательно, удельное количество теплоты, сообщенное телу в изобарном процессе, при постоянной теплоемкости:
t2 |
|
t2 |
|
|
|
|
|
|
|
|
|
|||
qp,1 2 h / t p dt cpdt cp t2 t1 h2 h1; |
(7.7) |
|||||||||||||
t1 |
|
t1 |
|
|
|
|
|
|
|
|
|
|||
или при переменной теплоемкости: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t2 |
|
|
|
t2 |
|
|
|
|
|
t1 |
|
|
|
qp,1 2 |
cpdt cp |
|
t2 |
cp |
|
t1 |
h2 h1. |
(7.8) |
||||||
|
0 |
|
0 |
|||||||||||
|
|
|
|
|
|
|
||||||||
|
t1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Часть сообщенного удельного количества теплоты qp,1-2 , равное p v2 v1 , переходит в работу расширения, а другая часть идет на увеличение удельной внутренней энергии тела.
Для обратимого изобарного процесса при постоянной теплоемкости
изменение удельной энтропии находится по уравнению (6.44): |
|
|
|
|
|||||||||||||||||
|
|
|
|
s2 s1 cp lnT2 /T1 |
Rln p2 / p1, |
|
|
|
|
|
|
|
|||||||||
но при p const → ln p2 |
/ p1 0 , поэтому |
|
|
|
|
|
|
|
|
|
|
||||||||||
s |
2 |
s |
T2 |
s / T |
|
p |
dT T2 |
c |
p |
/T |
dT c |
p |
lnT |
/ T |
c |
p |
lnv |
2 |
/ v |
1 |
. (7.9) |
|
1 |
|
|
|
|
|
p |
|
2 |
1 |
|
|
|
|
|||||||
|
|
|
T1 |
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изобара на T-s диаграмме изображается кривой 7-5 (см. рис. 7.2) и, подобно изохоре, обращена выпуклостью вниз. Подкасательная кривой 7-5 в любой ее точке дает значение истинной теплоемкости ср. Для точки 5 подкасательная
8 6 T ds/ dT qp / dT cp .
82
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Пл. 87568 под изобарой в некотором масштабе изображает удельное количество теплоты qp, сообщаемое газу, и равное изменению удельной энтальпии h2 h1.
Все изобары являются эквидистантными кривыми, имеющими при одной и той же температуре одинаковые угловые коэффициенты. Горизонтальное расстояние между изобарами различных давлений определяется по урав-
нению (6.44) при T const (см. рис. 7.2):
s s0 s5 Rln p5 / p0 .
Из последнего уравнения следует, что расстояние между изобарами зависит от давлений и природы газа. Чем больше давление газа, тем изобара ближе к оси ординат.
Из сопоставления уравнений (7.3) и (7.9) следует, что в случае осуществления изохорного и изобарного процессов в одном интервале температур возрастание удельной энтропии будет больше в изобарном процессе, так как
ср всегда больше cv. Изобары являются более пологими кривыми, чем изохоры
(см. рис. 7.2).
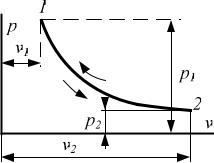
7.4. Изотермический процесс
Процесс, протекающий при постоянной температуре, называют изо-
термическим (T const, или dT 0). Кривая процесса называется изотер-
мой (рис. 7.4).
Для изотермического процесса идеального газа:
pv RT T const
или
p1v1 p2v2 |
и p1 / p2 v2 / v1 . |
(7.10 |
Рис.7.4. Изотермический процесс на р-v диаграмме
При постоянной температуре объем газа изменяется обратно пропорционально его давлению (закон Бойля — Мариотта).
На р-v диаграмме изотермный процесс представляет собой равнобокую гиперболу.
Основное уравнение первого закона термодинамики при T const получает простой вид:
q l и q1 2 l1 2 .
83
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Количество подведенной к рабочему телу теплоты численно равно работе изменения объема.
Зная уравнение изотермического процесса для идеального газа, можно подсчитать работу процесса. Удельная работа изменения объема:
v2
l pdv,
v1
но из уравнения изотермы имеем pv p1v1 , или p p1v1 / v, поэтому
v2
l p1v1 dv / v.
v1
Интегрируя последнее уравнение, получаем
l p1v1 lnv2 / v1 q. |
(7.11) |
Уравнение (7.11) определяет удельную работу и внешнее удельное количество теплоты идеального газа. При переходе к десятичным логарифмам имеем:
q l 2,3p1v1 lgv2 / v1 2,3p1v1 lg p1 / p2 |
. |
(7.12) |
2,3RT lgv2 / v1 2,3RT lg p1 / p2 |
|
|
Удельная располагаемая внешняя работа l' определяется по формуле:
p2 p2
l' vdp p1v1 |
dp / p p1v1 lg p1 / p2, |
(7.13) |
p1 |
p1 |
|
т. е. в изотермическом процессе идеального газа l' l q, или удельная работа изменения объема, располагаемая (полезная) работа и удельное количество теплоты, полученное телом, равны между собой.
Теплоемкость в изотермическом процессе:
cT q/dT q/0 .
Энтальпия и внутренняя энергия идеального газа не меняются, т. е. dh 0 и du 0.
Изотермический процесс на T-s диаграмме изображается прямой, параллельной оси абсцисс (см. рис. 7.2). Для определения изменения удельной энтропии следует воспользоваться уравнением (6.43):
84
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
s2 s1 cvT2 / T1 Rlnv2 / v1 ,
откуда
s2 s1 Rlnv2 / v1 |
и s2 s1 Rln p1 / p2 . |
(7.14) |
Удельное количество теплоты, участвующее в изотермическом процессе, равно произведению изменения удельной энтропии (s2 s1) на абсолютную температуру T: q T s2 s1 .
7.5. Адиабатный процесс
Процесс, протекающий без подвода и отвода теплоты, т. е. при отсутствии теплообмена рабочего тела с окружающей средой, называют адиабатным, а кривая этого процесса называется адиабатой. Для получе-
ния адиабатного процесса необходимым и обязательным условием являетсяq 0 и, следовательно, q 0.
Обратимый адиабатный процесс можно осуществить в цилиндре с абсолютно нетеплопроводными стенками при бесконечно медленном перемещении поршня.
Выведем уравнение адиабаты. Из уравнений первого закона термодинамики при q 0 имеем:
cpdT vdp 0 и cvdT pdv 0.
Разделив первое уравнение на второе, получим:
cpdT / cvdT vdp/ pdv или kdv / v dp / p.
Интегрируя последнее уравнение при условии, что k const (cp const и cv const), находим:
v2 p2
k dv/v dp / p и klnv2 / v1 ln p1 / p2 .
v1 p1
После потенцирования имеем:
v2 / v1 k p1 / p2 или p1v1k p2v2k ,
откуда уравнение адиабаты
85

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
pvk const. |
(7.15) |
При адиабатном процессе произведение давления на объем газа в сте-
пени k есть величина постоянная. Величину k называют показателем адиабаты. Рассмотрим зависимость между основными параметрами в адиабатном процессе.
Из уравнения адиабаты следует, что p1/p2 v2/v1 k и v2 / v1 p1 / p2 1/ k .
Если эти соотношения параметров тела подставить в уравнение состояния для крайних точек процесса p1/p2 v2/v1 T2 / T1 , то после соответствующих преобразований найдем:
T1 / T2 v2 / v1 k 1 p1 / p2 k 1 / k .
v2
Удельная работа изменения объема l pdv, совершаемая телом над
v1
окружающей средой при равновесном адиабатном процессе, может быть вычислена по уравнению адиабаты:
p p vk / vk |
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
1 |
|
v2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l p1v1k dv / vk p1v1k / 1 k v21 k v11 k |
|||||||||||||||||||||
|
|
|
v1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
vk |
|
1 |
|
|
1 |
|
|
1 |
|
p |
vk |
p |
2 |
vk |
|||||
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1 |
|
|
2 |
|
|
|
|
|
|
k 1 |
|
|
|
|
|
|
k 1 |
|
|
|
||||||||
|
|
k 1 |
|
k 1 |
k 1 |
|
|
k 1 , |
||||||||||||||
откуда |
|
v1 |
|
v |
2 |
|
|
v1 |
|
|
v2 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l 1/ k 1 p1v1 |
p2v2 . |
(7.16) |
|||||||||||||
Из выражения (7.16) могут быть получены следующие формулы:
l p1v1 / k 1 1 T2  T1 ; l R / k 1 T1 T2 .
T1 ; l R / k 1 T1 T2 .
Отношение температур заменяем отношением объемов и давлений:
l p1v1 |
/ k 1 |
1 p2 |
p1 |
k 1 |
|
RT1 / k 1 1 v1 v2 k 1 . |
|
k |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Все зависимости между р, v, T и уравнения работы получены при условии, что k const. При переменной k обычно при расчетах берут среднее значение k, соответствующее изменению температуры в процессе по уравнению:
86

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
cp |
|
t2 |
|
|
|
|
|
|
|
||
k |
|
t1 |
cv |
|
t2 h / u. |
|
|
|
|||
|
|
|
|
t1 |
|
|
|
|
|
Уравнения первого закона термодинамики (6.47) и (6.48) для адиабатного процесса ( q 0) имеют следующий вид:
du pdv и dh vdp,
откуда
u / v s p и dh / dp s v.
Из этих соотношений можно получить:
h / u s v / p p / v s.
Полученное выражение и есть дифференциальное уравнение изоэнтропного процесса.
В этом уравнении h / u s k .
Согласно первому закону термодинамики, удельная работа изменения объема в адиабатном процессе получается за счет убыли удельной внутренней энергии тела:
при cv const |
→l u1 u2 cv t1 |
t2 ; |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
при c |
|
const |
→ l |
|
|
|
|
t1 t |
|
|
|
|
t2 t |
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
v |
c |
|
c |
|
2 |
|||||||||||
|
|
|
|
|
|
v |
|
0 1 |
|
v |
|
0 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
Если газ расширяется, то его внут- |
||||||||||||||||
|
|
ренняя энергия и температура убывают; ес- |
||||||||||||||||
|
|
ли газ сжимается, то его внутренняя энер- |
||||||||||||||||
|
|
гия и температура возрастают. |
|
|
|
|
|
|
||||||||||
|
|
Удельная теплоемкость в адиабатном |
||||||||||||||||
Рис.7.5. Располагаемая |
||||||||||||||||||
процессе из выражения c q / dT |
при |
|
||||||||||||||||
внешняя работа политропно- |
|
|||||||||||||||||
q 0 также равна нулю. |
|
|
|
|
|
|
|
|
|
|
|
|||||||
го процесса на р-v диаграмме |
|
|
|
|
|
|
|
|
|
|
|
|||||||
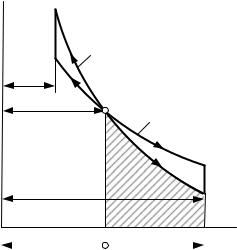
Вычислим располагаемую (полезную) внешнюю работу в адиабатном процессе:
p2
l' vdp.
p1
87
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
При обратимом адиабатном процессе идеального газа располагаемая внешняя работа будет в k раз больше удельной работы изменения объема и обратна ей по знаку.
Действительно, из уравнения адиабаты (7.15) следует, что kdv/v -dp/p или vdp kpdv , т.е. l' k l. Следовательно,
l' k / k 1 p1v1 p2v2 и |
(7.17) |
l' k l.
Графически располагаемая внешняя работа изображается на pv- диаграмме пл. ABCD (рис. 7.5) или площадью, ограниченной линией процесса, крайними абсциссами и осью ординат.
Из рис. 7.6 видно, что, поскольку в уравнении адиабаты k 1, она на р- v диаграмме идет круче, чем изотерма.
Для обратимого адиабатного процесса q 0, поэтому:
ds q/T 0 |
и s2 s1 const , |
(7.18) |
p
Адиабата
v2
v1 A
Изотерма
v2 B
т. е. обратимый адиабатный процесс является одновременно изоэнтропным (или при постоянной энтропии).
Протекание необратимого адиабатного процесса можно наглядно изобразить, на T-s диаграмме. Применяя уравнение первого закона термодинамики для необратимых процессов (5.32) и считая, что всегда gтр 0 и T 0, получаем,
|
|
D |
|
|
C v |
что необратимый адиабатный процесс не |
|
|
Сжатие |
Расширение |
|
||
|
|
|
является изоэнтропным (изменение |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
за- Рис.7.6. Сравнение адиабаты |
удельной энтропии не равно нулю) и |
|||||
висимо от его направления как при рас- |
||||||
|
|
и изотермы на р-v диаграм- |
ширении, так и при сжатии |
|||
ет- |
|
|
|
ся увеличением удельной энтропии. На |
||
рис. 7.2 обратимый адиабатный процесс изображается прямыми 0-b, d-c, необратимый адиабатный процесс расширения - кривой 0-с, а процесс сжатия -
с-е.
7.6. Политропные процессы
До сих пор рассматривались процессы, у которых имелись вполне определенные признаки; изохорный процесс осуществлялся при постоянном объеме; изобарный — при постоянном давлении; изотермический — при по-
88
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
стоянной температуре; адиабатный — при отсутствии теплообмена между рабочим телом и внешней средой. Наряду с этими процессами можно представить еще бесконечное множество процессов, у которых имеются другие постоянные признаки.
Условились всякий процесс идеального газа, в котором удельная теп-
лоемкость является постоянной величиной, называть политропным про-
цессом, а линию процесса — политропой.
Из определения политропного процесса следует, что основные термодинамические процессы — изохорный, изобарный, изотермический и адиабатный — если они протекают при постоянной удельной теплоемкости, являются частными случаями политропного процесса.
Удельная теплоемкость политропного процесса сп может принимать самые разнообразные положительные и отрицательные значения от до
.
Удельное количество теплоты, участвующее в политропном процессе, может быть выражено произведением теплоемкости процесса сп на разность температур t2 -t1 в конечном и начальном состояниях:
q cп t2 -t1 и q cпdt . |
(7.19) |
Уравнение политропного процесса выводится на основании уравнения первого закона термодинамики:
q cпdt cpdT -vdp и q cпdT cvdT pdv.
Из этих уравнений найдем:
cп cp / cп cv vdp/ pdv .
Обозначив выражение левой части уравнения через п, получим
cп cp / cп cv n и ndv / v dp / p.
Интегрируя полученное соотношение в пределах от начала до конца процесса, находим
nlgv2/v1 lgp1/p2
или
pvn const. |
(7.20) |
Полученное уравнение является уравнением политропного процесса.
89
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
Показатель политропы п принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных n , изобарных n 0, изотермических n 1 и адиабатных n k .
Поскольку уравнение политропы отличается от уравнения адиабаты только значением показателя п, то, очевидно, все соотношения между основными параметрами могут быть представлены формулами, аналогичными адиабатному процессу:
p2/p1 v1/v2 n;T2/T1 v1/v2 n 1;T2/T1 p2/p1 n 1 / n .
Удельную теплоемкость политропного процесса определяем из форму-
лы:
n cп cp / cп cv , откуда cп cv n k / n 1 . |
(7.21) |
Уравнение (7.21) позволяет определить удельную теплоемкость политропного процесса для каждого значения п.
Если в уравнение (7.21) подставить значения п для частных случаев, то получаем удельные теплоемкости рассмотренных процессов:
изохорного процесса n ,cп cv ; изобарного процесса n 0,cп kcv cp ;
изотермного процесса n 1,cп ; адиабатного процесса n k,cп 0.
Уравнение удельной работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением удельной работы в адиабатном процессе, т. е.:
l 1/ n 1 p1v1 p2v2 , |
(7.22) |
или
l RT1 / n 1 1 T2 / T1 p1v1 / n 1
(7.23)
1 p2 / p1 n 1 / n p1v1 / n 1 1 v1 / v2 n 1 .
Изменение удельной внутренней энергии газа и удельное количество теплоты в политропном процессе определяются по формулам:
u cv t2 t1 ; q cп t2 -t1 cv n k / n 1 t2 -t1 . |
(7.24) |
Располагаемая внешняя работа в политропном процессе по аналогии с адиабатным процессом
90
