
Болезни эндокринной системы
Болезни островкового аппарата поджелудочной железы
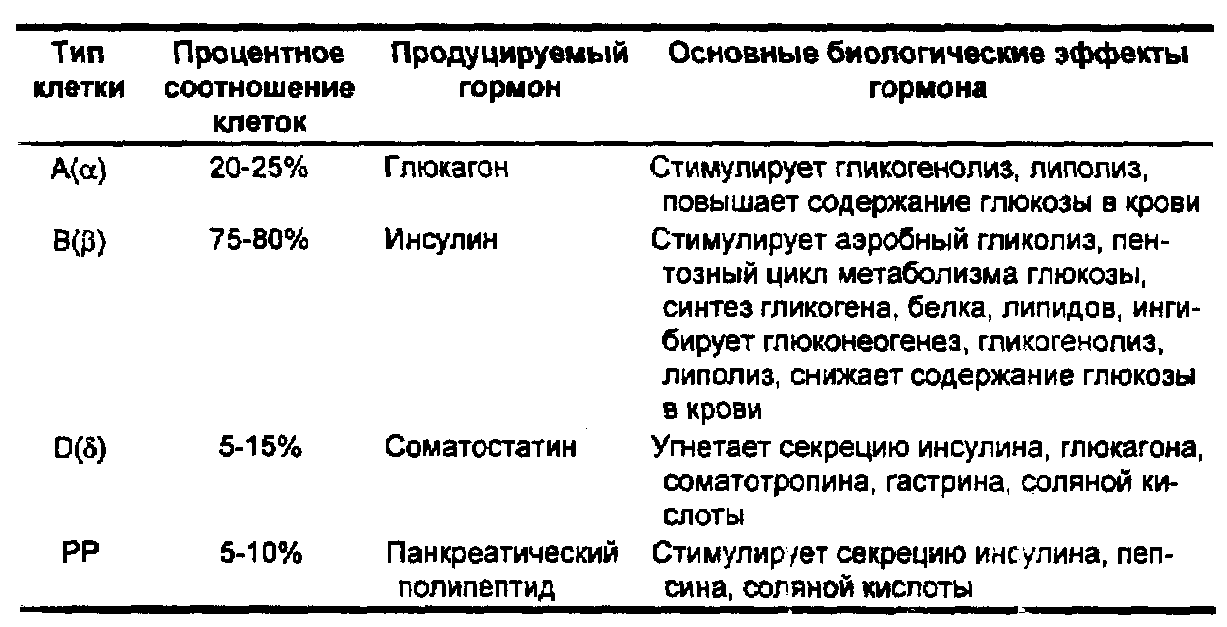
Поджелудочная железа віполняет экзокринную и эндокринную функции. Эндокринная функция осуществляется островками Лангерганса, которых насчитывается около 1-3 млн., что составляет 1-3% массы поджелудочной железы. Наибольшее количество островков сосредоточено в ее хвостовом отделе. Островок имеет 200 микрон в диаметре и содержит от 3 до 5 тыс. клеток. Различают следующие типы клеток (табл. 36).
Каждая -клетка насчитывает около 10,000 секреторных гранул диаметром 0.2 микрона с кристаллами инсулина, каждый кристалл содержит около 300,000 молекул инсулина.
Между клетками островков существуют определенные взаимоотношения, гормоны клеток одного типа влияют на секреторную активность клеток другого типа (Дж. Теппермен, Х. Теппермен, 1989):
• инсулин ингибирует секреторную активность А()-клеток и выделение ими глюкагона;
• глюкагон стимулирует секреторную активность В()-клеток и секрецию инсулина и D()-клеток и секрецию соматостатина;
• соматостатин ингибирует активность А()-клеток и секрецию глюкагона и В()-клеток и секрецию инсулина.
В островках Лангерганса имеются в очень небольшом количестве клетки, вырабатывающие гастрин, вазаактивный интестинальный полипептид, тиролиберин, соматолиберин (М. И. Балаболкин, 1994).
Табл. 36. Типы клеток островков Лангерганса и продуцируемые ими гормоны
САХАРНЫЙ ДИАБЕТ
Сахарный диабет (СД) — эндокринное заболевание, характеризующееся синдромом хронической гипергликемии, являющейся следствием недостаточной продукции или действия инсулина, что приводит к нарушению всех видов обмена веществ, прежде всего углеводного, поражению сосудов (ангиопатии), нервной системы (нейропатии), а также других органов и систем.
Согласно определению ВОЗ (1985) — сахарный диабет — состояние хронической гипергликемии, обусловленное воздействием на организм генетических и экзогенных факторов.
Распространенность сахарного диабета среди населения различных стран колеблется от 2 до 4%. В настоящее время в мире насчитывается около 120 млн. больных сахарным диабетом. Согласно прогнозу ВОЗ эта цифра составит к 2000 г. 160 млн.
Изучение генетических, этиологических, патогенетических и клинических особенностей сахарного диабета позволило исследователям выделить два основных типа сахарного диабета: инсулинзависимый сахарный диабет (ИЗСД) или СД I типа и инсулиннезависимый сахарный диабет (ИНСД) или СД II типа. При ИЗСД имеет место резко выраженная недостаточность секреции инсулина В()-клетками островков Лангерганса (абсолютная инсулиновая недостаточность), больные нуждаются в постоянной, пожизненной терапии инсулином, т. е. являются инсулинзависимыми. При ИНСД на первый план выступает недостаточность действия инсулина, развивается резистентность периферических тканей к инсулину (относительная инсулиновая недостаточность). Заместительная терапия инсулином при ИНСД, как правило, не проводится. Больные лечатся диетой и пероральными гипогликемизирующими средствами. В последние годы установлено, что при ИНСД имеет место нарушение ранней фазы секреции инсулина.
Классификация
Классификация сахарного диабета и других категорий нарушения толерантности к глюкозе (ВОЗ, 1985)
1. Клинические классы 1.1. Сахарный диабет:
1.1.1. Инсулинзависимый сахарный диабет1.
1.1.2. Инсулиннезависимый сахарный диабете2
• у лиц с нормальной массой тела;
• у лиц с ожирением.
1.1.3. Сахарный диабет, связанный с недостаточностью питания3
1.1.4. Другие типы сахарного диабета, связанные с определенными состояниями и синдромами:
• заболеваниями поджелудочной железы;
• заболеваниями гормональной природы;
• состояниями, вызванными лекарственными средствами или воздействием химических веществ;
• изменением инсулина или его рецепторов;
• определенными генетическими синдромами;
• смешанными состояниями-
1.2. Нарушенная толерантность к глюкозе4:
• у лиц с нормальной массой тела;
• у лиц с ожирением;
• нарушенная толерантность к глюкозе, связанная с другими состояниями и синдромами.
Сахарный диабет беременных5.
2. Статистически достоверные классы риска (лица с нормальной толерантностью к глюкозе, но со значительно увеличенным риском развития сахарного диабета):
• предшествовавшие нарушения толерантности к глюкозе;
• потенциальные нарушения толерантности к глюкозе.
Примечания:
1 Синоним инсулинзависимого сахарного диабета — сахарный диабет І типа.
2 Синоним инсулиннезависимого сахарного диабета — сахарный диабет ІІ типа.
3 Сахарный диабет, связанный с недостаточностью питания, встречается в развивающихся тропических странах.
4 Критерии диагностики нарушенной толерантности к глюкозе:
Гликемия натощак < 7 ммоль/л, гликемия через 2 ч после нагрузки глюкозой (75.0 г) 8, но < 11 ммоль/л.
5 Сахарный диабет беременных — диабет, выявленный впервые во время беременности. Если диабет сохраняется и после беременности, он классифицируется как обычный (т. е. термин сахарный диабет беременных» не применяется).
Классификация сахарного диабета (М. И. Балаболкин, 1989)
В отечественной практике широкое распространение получила классификация сахарного диабета М. И. Балаболкина (1989). Достоинствами данной классификации являются выделение степени тяжести СД, а также указание на состояние компенсации.
1.1. Клинические формы диабета.
1.1.1. Инсулинзависимый диабет (диабет І типа).
1.1.2. Инсулиннезависимый диабет (диабет ІІ типа).
1.1.3. Другие формы диабета (вторичный, или симптоматический, сахарный диабет):
• эндокринного генеза (синдром Иценко-Кушинга, акромегалия, диффузный токсический зоб, феохромоцитома);
• заболевания поджелудочной железы (опухоль, воспаление, резекция, гемохроматоз и др.);
• другие, более редкие формы диабета (после приема различных лекарственных препаратов, врожденные генетические дефекты и др.).
1.1.4. Диабет беременных.
2. Степень тяжести диабета:
2.1.1. Легкая (І степень).
2.1.2. Средняя (ІІ степень).
2.1.3. Тяжелая (ІІІ степень).
3. Состояние компенсации:
3.1.1. Компенсация.
3.1.2. Субкомпенсация.
3.1.3. Декомпенсация.
4. Острые осложнения диабета (часто как результат неадекватной терапии):
4.1.1. Кетоацидотическая кома.
4.1.2. Гиперосмолярная кома.
4.1.3. Лактацидотическая кома.
4.1.4. Гипогликемическая кома
5. Поздние осложнения диабета:
5.1.1. Микроангиопатии (ретанопатия, нефропатия).
5.1.2. Макроангиопатия.
5.1.3. Нейропатия.
6. Поражение других органов и систем (энтеропатия, гепатопатия, катаракта, остеоартропатия, дермопатия и др.).
7. Осложнения терапии:
7.1.1. Инсулинотерапии (местная аллергическая реакция, анафилактический шок, липоатрофия).
7.1.2. Пероральными сахароснижающими средствами (аллергические реакции, нарушение функции желудочно-кишечного тракта и др.).
Инсулинзависимый сахарный диабет
Инсулинзависимый сахарный диабет (ИЗСД) — аутоиммунное заболевание, развивающееся при наследственной предрасположенности к нему под действием провоцирующих факторов внешней среды (вирусная инфекция?, цитотоксические вещества?).
Вероятность развития заболевания повышают следующие факторы риска ИЗСД:
• отягощенная по сахарному диабету наследственность;
• аутоиммунные заболевания, в первую очередь эндокринные (аутоиммунный тиреоидит, хроническая недостаточность коры надпочечников);
Табл. 37. Степень риска ИЗСД у родственников больных сахарным диабетом

• вирусные инфекции, вызывающие воспаление островков Лангерганса (инсулит) и 'поражение -клеток.
Этиология
Генетические факторы и маркеры
В настоящее время роль генетического фактора как причины сахарного диабета окончательно доказана. Это основной этиологический фактор сахарного диабета.
ИЗСД считается полигеннымм заболеванием, в основе которого лежат по меньшей мере 2 мутантных диабетических гена в 6 хромосоме. Они связаны с HLA-системой (Д-локусом), которая определяет индивидуальный, генетически обусловленный ответ организма и -клеток на различные антигены.
Гипотеза полигенного наследования ИЗСД предполагает, что при ИЗСД имеются два мутантных гена (иди две группы генов), которые рецессивным путем передают по 'наследству предрасположенность к аутоиммунному поражению инсулярного аппарата или повышенную чувствительность -клеток к вирусным антителам либо ослабленный противовирусный иммунитет.
Kozak (1982) установил степень предсказуемого риска для родственников больных ИЗСД (табл. 37).
Генетическая предрасположенность к ИЗСД связана с определенными генами HLA-системы, которые считаются маркерами этой предрасположенности.
Согласно Д. Фостер (1987) один из генов восприимчивости к ИЗСД расположен на 6 хромосоме, так как имеется выраженная связь между ИЗСД и определенными антигенами лейкоцитов человека (НЬА)^ которые кодируются генами главного комплекса гистосовместимости, локализованными на этой хромосоме.
В зависимости от типа кодируемых белков и их роли в развитии иммунных реакций, гены главного комплекса гистосовместимости подразделяются на 3 класса. Гены І класса включают локусы А, В, С, которые кодируют антигены, присутствующие на всех ниросодержащих клетках, их функция заключается прежде всего в защите от инфекции, особенно вирусной. Гены ІІ класса расположены в D-области, которая включает локусы DP, DQ, DR. Гены этих локусов кодируют антигены, которые экспрессируются только на иммунокомпетентных клетках: моноцитах, Т-лимфоцитах, Р-лимфоцитах. Гены III класса кодируют компоненты комплемента, фактора некроза опухоли и транспортеров, связанных с процессингом антигена.
Предрасположенность к ИЗСД наиболее часто сочетается со следующими антигенами HLA-системs DR3, DR4. Они обнаруживаются почти у 95% больных ИЗСД, в то время как в здоровой популяции — у 16%. Генотипы DR2 и DR5 наоборот, рассматриваются как гены-протекторы, защищающие от развития ИЗСД.
В последние годы наибольшее значение, как факторам риска развития ИЗСД, придают антигенам локуса DQ (DQw2, DQw8).
Предполагается, что в развитии предрасположенности к ИЗСД; имеет значение взаимодействие генов локуса DQ с генами I и II классов, а также с генами, расположенными вне главного комплекса гистосовместимости. Менее значимые, но также в определенной мере предрасполагающим к развитию ИЗСД является обнаружение HLA B8, и D15.
Считается, что при наличии у пациента HLA B8 риск заболеть ИЗСД увеличивается в 2.5-3 раза, HLA B15 — в 2-2.5 раза, HLA В8+В15 — в 9.5—10 раз, HLA DR3 — в 3.5-4 раза, HLA D4 — в 4.5-5 раз, HLA DR3 +DR4 — в 9-9.5 раз.
В последние годы сформировалось представление о том, что в наследовании ИЗСД, кроме генов HLA-системы (хромосома б), принимает участие также ген, кодирующий синтез инсулина (хромосома 11); ген, кодирующий синтез тяжелой цепи иммуноглобулинов (хромосома 14); ген, отвечающий за синтез -цепи Т-клеточного рецептора (хромосома 7) и др.
У лиц с наличием генетической предрасположенности к ИЗСД изменена реакция на факторы окружающей среды. У них ослаблен противовирусный иммунитет и они чрезвычайно подвержены цитотоксическому повреждению -клеток вирусами и химическими агентами.
Вирусная инфекция
Вирусная инфекция может являться фактором, провоцирующим развитие ИЗСД. Наиболее часто появлению клиники ИЗСД предшествуют следующие вирусные инфекции: краснуха (вирус краснухи имеет тропизм к островкам поджелудочной железы, накапливается и может реплицироваться в них); вирус Коксаки В, вирус гепатита В (может реплицироваться в инсулярном аппарате);
эпидемического паротита (через 1 -2 года после эпидемии паротита резко увеличивается заболеваемость. ИЗСД у детей); инфекционного мононуклеоза; цитомегаловирус; вирус гриппа и др. Роль вирусной инфекции в развитии ИЗСД подтверждается сезонностью заболеваемости (часто впервые диагностируемые случаи ИЗСД у детей приходятся на осенние и зимние месяцы с пиком заболеваемости в октябре и январе); обнаружением высоких титров антител к вирусам в крови больных ИЗСД; обнаружением с помощью иммунофлуоресцентных методов исследования вирусных частиц в островках Лангерганса у людей, умерших от ИЗСД. Роль вирусной инфекции в развитии ИЗСД подтверждена в экспериментальных исследованиях. М. И. Балаболкин (1994) указывает, что вирусная инфекция у лиц с генетической предрасположенностью к ИЗСД участвует в развитии заболевания следующим образом:
• вызывает острое повреждение -клеток (вирус Коксаки);
• приводит к персистенции вируса (врожденная цитомегаловирусная инфекция, краснуха) с развитием: аутоиммунных реакций в островковой ткани.
Патогенез
В патогенетическом плане различают три вида ИЗСД: вирусиндуцированный, аутоиммунный, смешанный аутоиммунно-вирусиндуцированный. Однако такое подразделение в определенной мере условно, так как аутоиммунный механизм имеет значение при всех патогенетических формах ИЗСД, тем более, что в настоящее время доказано наличие антигенных эпитопов, общих для -клеток и панкреатотропных вирусов (молекулярная мимикрия). Это приводит к тому, что иммунный ответ организма, первоначально направленный против антигена вируса, в дальнейшем становится направленным против (-клеток островков Лангерганса. Кроме того, независимо от особенностей патогенеза ИЗСД, при любом патогенетическом варианте развивается деструкция -клеток островков поджелудочной железы.
В настоящее время актуальны следующие модели деструкции -клеток и, следовательно, патогенеза ИЗСД.
Копенгагенская модель (Nerup и соавт., 1989). Согласно копенгагенской модели, патогенез ИЗСД выглядит следующим образом:
• антигены панкреатотропных факторов (вирусы, цитотоксические химические вещества и др.), поступившие в организм, с одной стороны, повреждают -клетки и приводят к высвобождению антигена -клеток; с другой стороны, поступившие извне антигены взаимодействуют с макрофагом, фрагменты антигена связываются с HLA-антигенами локуса D и образовавшийся комплекс выходит на поверхность макрофага (т. е. происходит экспрессия антигенов DR). Индуктором экспрессии HLA-DR. является -интерферон, который производится Т-лимфоцитами-хелперами;
• макрофаг становится антигенпредставляющей клеткой и секретирует цитокин интерлейкин-1, который вызывает пролиферацию Т-лимфоцитов-хелперов, а также угнетает функцию -клеток островков Лангерганса;
• под влиянием интерлейкина-1 стимулируется секреция Т-лимфоцитами-хелперами лимфокинов: -интерферона и фактора некроза опухоли (ФНО);
• -интерферон и ФНО непосредственно участвуют в деструкции -клеток островков Лангерганса. Кроме того, интерферон индуцирует экспрессию антигенов HLA II класса на клетках эндотелия капилляров, а интерлейкин-1 увеличивает проницаемость капилляров и вызывает экспрессию антигенов НLА I и II классов на -клетках островков. -клетка, экспрессировавшая HLA DR., сама становится аутоантигеном, таким образом формируется порочный круг деструкции новых -клеток.
Указанные процессы схематично представлены на рис. 2. Лондонская модель деструкции -клеток. (Botazzo и соавт., 1986).
В 1983 г. Botazzzo обнаружил аберрантную (т. е. не свойственную норме) экспрессию молекул HLA-D-локуса на -клетках островков Лангерганса у больных ИЗСД. Этот факт является основным в лондонской модели деструкции -клеток. Механизм повреждения -клеток запускается взаимодействием внешнего антигена (вируса, цитотоксического фактора) с макрофагом (также, как и в копенгагенской модели). Аберрантная экспрессия антигенов DR3 и DR4 на -клетках индуцируется влиянием ФНО и -интерферока при высокой концентрации интерлейкина-1.
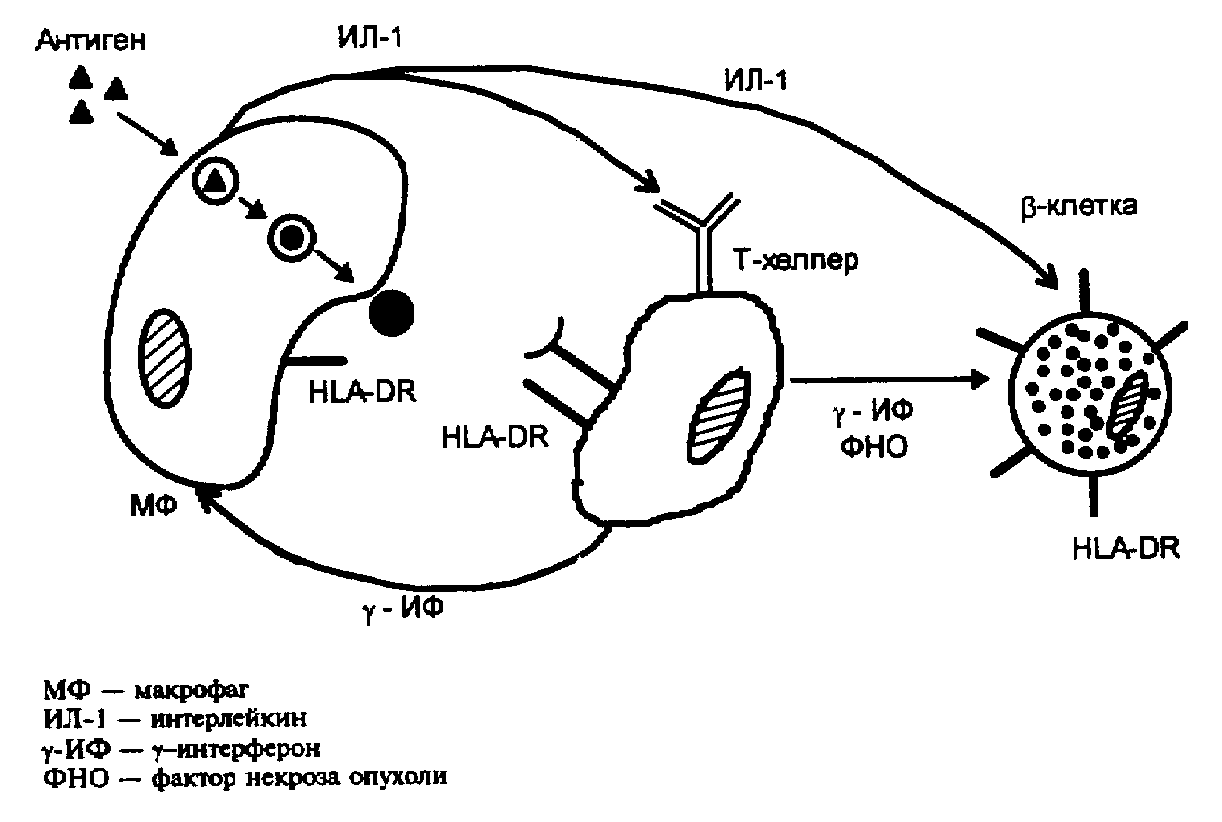
Рис. 2. Копенгагенская модель деструкции -клетки.
-клетка становится аутоантигеном. Островок инфильтрируется Т-хелперами, макрофагами, плазматическими клетками, продуцируется большое количество цитокинов, развивается выраженная иммуновоспалительная реакция с участием цитотоксических Т-лимфоцитов и натуральных киллеров. Все это ведет к деструкции -клеток. В последнее время важное значение в деструкции придают азота оксиду (NО). Азота оксид образуется в организме из L-аргинина под влиянием фермента NО-синтазы. Установлено, что в организме имеется 3 изоформы NО-синтазы: эндотелиальная, нейрональная и индуцированная (иNO-синтеза). Под влиянием эндотелиальной и нейрональной NO-синтаз из L-аргинина образуется азота оксид, участвующий в процессах передачи возбуждения в нервной системе, а также обладающий вазодилатирующим свойством. Под влиянием иNO-синтазы L-аргинина образуется азота оксид, обладающий цитотоксическим и цитостатическим эффектами.
Установлено, что под влиянием интерлейкина происходит экспрессия иNO-синтазы в -клетках островков Лангерганса и непосредственно в (-клетках образуется большое количество цитотоксического азота оксида, вызывающего их деструкцию и угнетающего секрецию инсулина.
Генитеосинтазы локализуется на II хромосоме рядом с геном, кодирующим синтез инсулина. В связи с этим существует предположение, что в развитии ИЗСД имеют значение одновременные изменения структуры этих генов II хромосомы.
Помимо вышеназванных механизмов деструкции -клеток огромную роль играют аутоиммунные процессы.
У больных ИЗСД обнаруживаются различные виды антител к антигенам-компонентам островков:
• антитела к цитоплазме островковых клеток (цитоплазматические антитела), они могут реагировать со всеми типами эндокринных клеток островков;
• антитела к поверхностному антигену островковых клеток, которые взаимодействуют преимущественно с -клетками;
• комплемент зависимые цитотоксические антитела;
• антитела к инсулину и проинсулину;
• антитела к глутаматдекарбоксилазе, которая считается специфическим антигеном -клеток. Этот фермент катализирует превращение глутамата в ГАМК. Синтез глутаматдекарбоксилазы кодируется геном, расположенным на 10 хромосоме. Обнаружено сходство антигенньк детерминант глутаматдекарбоксилазы и вирусов Коксаки (молекулярная мимикрия).
Антитела к компонентам -клеток, в первую очередь глутамат-декарбоксилазе, появляются за 8—10 лет до развития ИЗСД (если в основе ИЗСД первично лежат аутоиммунные механизмы). При
вирусиндуцированном ИЗСД антитела впервые обнаруживаются в период вирусной инфекции.
Факторы, которые вызывают трансформацию -клетки в аутоантиген, окончательно не известны. Наиболее аргументированной является точка зрения, согласно которой экспрессия HLA-DR- антигенов -клетками, чему может способствовать врожденный дефицит Т-супрессорной функции лимфоцитов, трансформирует -клетку в аутоангиген — своего рода антигенпредставляющую клетку. Развивается сенсибилизация лимфоцитов (В-лимфоцитов, К-клеток, Т-лимфоцитов-эффекторов) к измененной -клетке. Образуются антитела к -клеткам, ее компонентам, формируются иммунные комплексы, которые активируют комплемент, развивается аутоиммунный инсулит, деструкция -клеток. К-лимфоциты проявляют цитолитическое влияние на -клетки в присутствии антител к ним, а Т-лимфоциты-эффекторы оказывают непосредственный цитолитический эффект на -клетки. Итогом аутоиммунного инсулита является деструкция подавляющего большинства -клеток островков Лангерганса и развитие абсолютной инсулиновой недостаточности.
После почти полной деструкции -клеток явления аутоиммунного инсулита затихают и антитела к -клеткам обнаруживаются редко, титр их уже невелик.
В патогенезе ИЗСД имеет значение также генетически обусловленное снижение способности -клеток к регенерации у лиц, предрасположенных к ИЗСД. -Клетка является высоко специализированной и имеет очень низкую способность к регенерации. Обнаружен ген регенерации -клеток. В норме регенерация -клеток осуществляется в течение 15-30 суток.
В современной диабетологии предполагается следующая стадийность развития ИЗСД.
Первая стадия — генетическая предрасположенность, обусловленная наличием определенных антигенов HLA-системы, а также генами 11 и 10 хромосом.
Вторая стадия — инициация аутоиммунных процессов в -клетках островков под влиянием панкреатотропных вирусов, цитотоксических веществ и каких-либо других неизвестных факторов. Важнейшим моментом на этой стадии является экспрессия -клетками HLA-DR-антигенов и глутаматдекарбоксилазы, в связи с чем они становятся аутоантигенами, что вызывает развитие ответной аутоиммунной реакции организма.
Третья стадия — стадия активных иммунологических процессов с образованием антител к -клеткам, инсулину, развитием аутоиммунного инсулита.
Четвертая стадия — прогрессивное снижение секреции инсулина, стимулированной глюкозой (1 фазы секреции инсулина).
Пятая стадия — кялинически явный диабет (манифестация сахарного диабета). Эта стадия развивается, когда происходит деструкция и гибель 85-90% -клеток. По данным Wallenstein (1988) при этом еще определяется остаточная секреция инсулина, причем антитела на нее не влияют.
У многих больных после проведенной инсулинотералии наступает ремиссия заболевания («медовый месяц диабетика»). Ее длителъность и выраженность зависит от степени повреждения -клеток, их способности к регенерации и уровня остаточной секреции инсулина, а также тяжести и частоты сопутствующих вирусных инфекций.
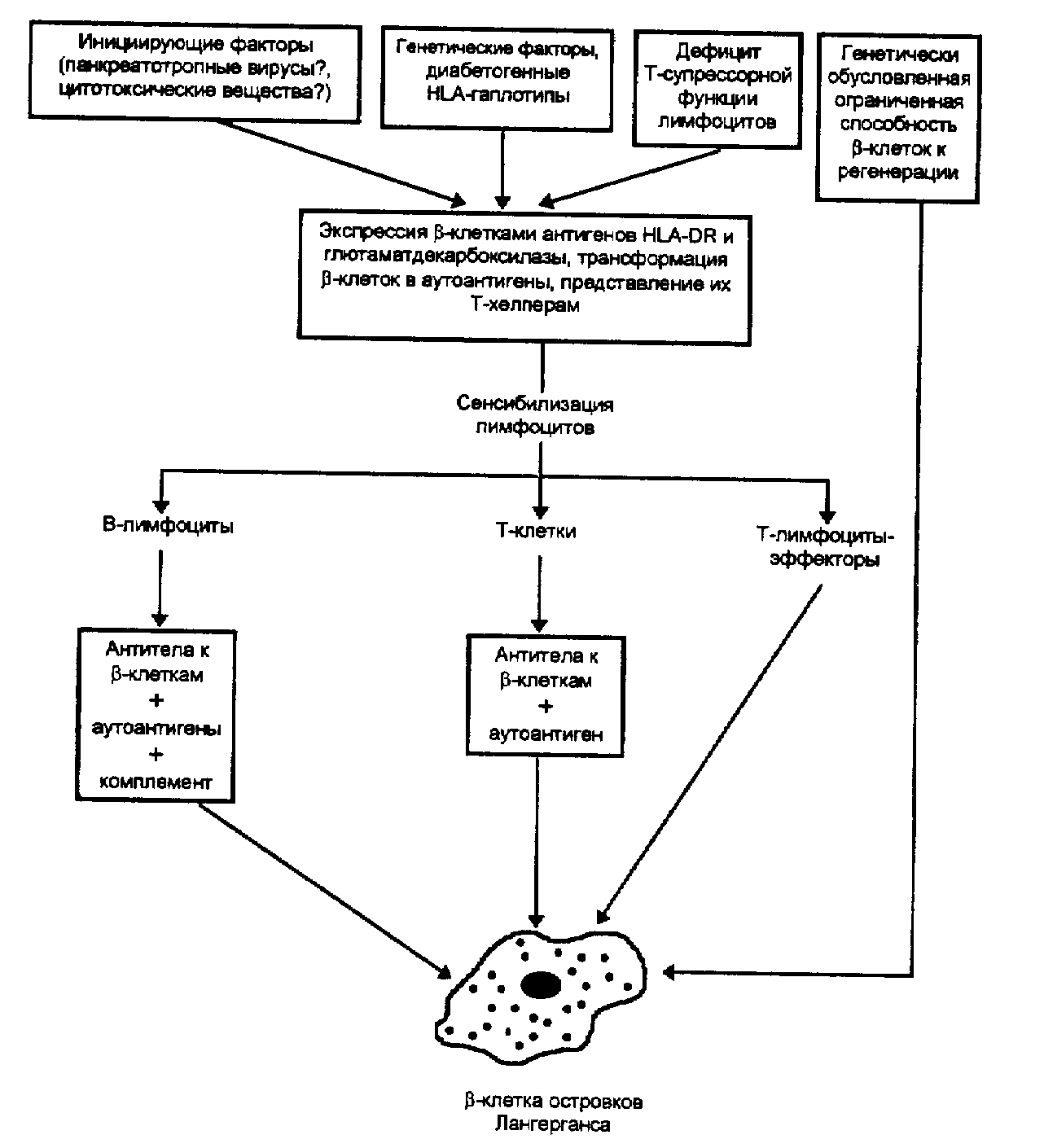
Рис. 3. Схема патогенеза аутоиммунного ИЗСД.
Шестая стадия — полная деструкция -клеток, полное отсутствие секреции инсулина и С-пептида. Клинические признаки
сахарного диабета возобновляются и инсулинотерапия вновь становится необходимой.
Схема патогенеза аутоиммунного ИЗСД показана на рис. 3. В табл. 38 представлены патогенетические особенности вирусиндуцированного и аутоиммунного ИЗСД
Табл. 38. Патогенетические особенности вирусиндуцированного и аутоилшунного ИЗСД (Doniach, Bottazzo 1981)

Инсулиннезависимый сахарный диабет
Инсулиннезависимый сахарный диабет (ИНСД) рассматривается в настоящее время как гетерогенное заболевание, характеризующееся нарушением секреции инсулина и чувствительности периферических тканей к инсулину (инсулинорезистентностью).
Факторами риска развития ИНСД являются:
• наследственная предрасположенность; генетическая основа ИНСД прослеживается почти в 100% случаев. Риск развития ИНСД возрастает от 2 до 6 раз при наличии сахарного диабета у родителей или ближайших родственников (табл. 39).
Табл. 39. Риск заболеть ИНСД для родственников больных сахарным диабетом (Kozak, 1982)

• ожирение — важнейший фактор риска развития ИНСД. Риск развития ИНСД при наличии ожирения 1 ст. увеличивается в 2 раза, при 11 ст. — в 5 раз, при 111 ст. — более, чем в 10 раз. С развитием ИНСД более тесно связана абдоминальная форма ожирения, чем периферическое распределение жира в нижних частях тела.
Этиология
Генетический фактор
Генетическому фактору в развитии ИНСД в настоящее время придается наибольшее значение. Подтверждением генетической основы ИНСД служит то обстоятельство, что у обоих однояйцевых близнецов он развивается в 95—100%. Однако окончательно генетический дефект, ответственный за развитие ИНСД, не расшифрован. В настоящее время обсуждаются два возможных варианта:
• наличие двух дефектных генов, при этом один из них (на 11 хромосоме) ответственен за нарушение секреции инсулина, второй — за развитие инсулинорезистентности (возможно, дефект гена 12 хромосомы, ответственного за синтез инсулиновых рецепторов);
• наличие общего генетического дефекта в системе узнавания глюкозы -клетками или периферическими тканями, что приводит к снижению поступления глюкозы в клетки или к снижению секреции инсулина -клетками в ответ на глюкозу. Предполагается, что ИНСД передается доминантным путем.
Избыточное питание и ожирение
Диабетогенным является питание, характеризующееся употреблением высококалорийной пищи с большим количеством легко
всасывающихся углеводов, сладостей, алкоголя, и дефицитом растительной клетчатки. Роль такого питания особенно возрастает при малоподвижном образе жизни. Указанный характер питания и ожирение тесно взаимосвязаны и способствуют нарушению секреции инсулина и развитию инсулинорезистентности.
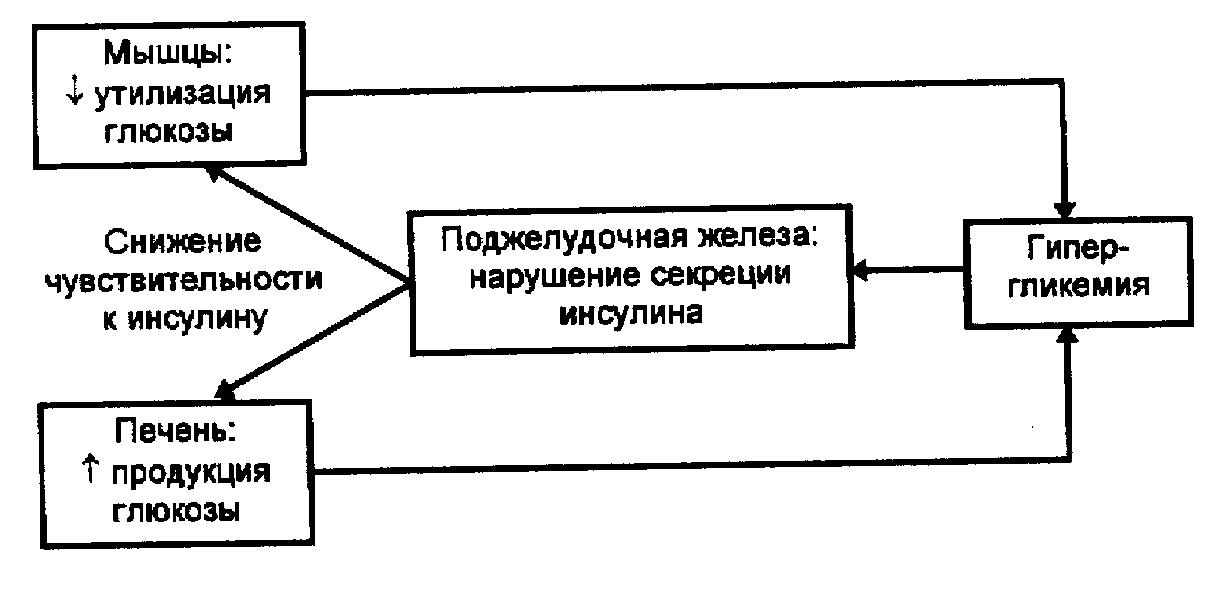
Рис. 4. Уровни нарушения гомеостаза глюкозы при ИНСД
Патогенез
Механизм нарушения гомеостаза глюкозы, а, следовательно, патогенез ИНСД, обусловлен нарушениями на трех уровнях (рис. 4);
• в поджелудочной железе — нарушается секреция инсулина;
• в периферических тканях (в первую очередь в мышцах), которые становятся резистентными к инсулину, что, естественно, приводит к нарушению транспорта и метаболизма глюкозы;
• в печени — повышается продукция глюкозы.
Нарушения секреции инсулина
Нарушения секреции инсулина являются первым ключевым дефектом при ИНСД и выявляются как на самой ранней, так и на выраженной стадиях заболевания.
Нарушения секреции инсулина выражаются в качественных, кинетических и количественных изменениях.
Качественные нарушения секреции инсулина
Выявить эти нарушения стало возможно только после разработки в 1987 г. группой Hales в Кембридже новой методики определения содержания в крови инсулина — иммунорадиометричеcкого исследования.
В этой методике одновременно используются два моноклональных антитела, каждое из которых направлено против специфического антигена гормона или прогормона. Этот метод позволяет избежать перекрестного взаимодействия между инсулином, интактным проинсулином, участками молекул 32-33 и 65-66 проинсулина (Guillausseau, 1996). С 1960 г. по 1987 г. определение инсулина в крови производилось радиоиммунологическим методом, который распознавал как инсулин не только сам инсулин, но и его предшественников (интактный проинсулин и продукты его распада — участки молекул 32-33 и 65-66). Это обстоятельство привело к ложному заключению о гиперинсулинемии у всех больных ИНСД. С помощью иммунорадиометрического метода установлено, что у пациентов с нарушенной толерантностью к глюкозе имеется незначительное снижение уровня инсулина в плазме крови и избыток продуктов распада проинсулина.
У больных ИНСД содержание инсулина в крови натощак значительно снижено и резко увеличен уровень 32-33-участка проинсулина.
В норме проинсулин распадается на инсулин и соединяющий С-пептид. При ИНСД этот процесс нарушен.
Нарушение кинетики секреции инсулина
У здоровых лиц в ответ на введение глюкозы наблюдается двухфазная секреция инсулина. Первый пик секреции начинается сразу после стимуляции глюкозой и постепенно заканчивается к 10 минуте (если глюкоза была введена внутривенно). Этот пик секреции обусловлен выходом из гранул -клеток уже готового, запасенного инсулина. После 10 минуты при внутривенном введении или через 30 минут или позже после перорального приема глюкозы начинается вторая фаза (пик) инсулиновой секреции. Она более продолжительная и отражает секрецию вновь синтезированного инсулина в ответ на стимуляцию -клеток глюкозой.
ИНСД характеризуется отсутствием первой (ранней) фазы секреции и сглаживанием второй фазы секреции инсулина. Этот признак является ранним маркером ИНСД (возможно, генетически детерминированный).
Утрата первой фазы секреции инсулина может быть обусловлена качественными нарушениями секреции инсулина, т. е. избыточным образованием молекул проинсулина, что нарушает формирование секреторных гранул и сокращает запасы образованного инсулина.
Количественные нарушения секреции инсулина
Вопрос о количественном нарушении секреции инсулина у больных ИНСД окончательно не решен. Результаты исследований 1960—1987 г. с использованием несовершенного радиоиммунологического метода свидетельствовали о нормальном или повышенном уровне инсулина в крови больных ИНСД.
Современная точка зрения: инсулинопения является умеренной на стадии нарушения толерантности к глюкозе и выраженной на стадии ИНСД независимо от избытка веса.
В настоящее время обсуждаются следующие механизмы нарушения секреции инсулина.
Снижение массы -клеток островков Лангерганса
Общее количество -клеток при ИНСД снижено умеренно, на 40-60% по сравнению с нормой, в то время как при ИЗСД потеря массы -клеток превышает 75%. Это обстоятельство позволяет считать, что нарушение секреции инсулина при ИНСД обусловлено не только снижением количества, но и дисфункцией -клеток.
Отложение в островках депозитов амилоида
Морфологические исследования островков при ИНСД выявили наличие в них фиброза и отложение амилоида. Депозиты амилоида образуются из измененных отложений специфического белка амилина.
Амилин состоит из 37 аминокислот, секретируется -клетками совместно с инсулином, физиологическая его роль неясна. Имеются данные, что он участвует в превращении проинсулина в инсулин. Установлено, что амилин при ИНСД уменьшает захват глюкозы -клетками и подавляет секрецию инсулина. Существует предположение, что в связи с первичным генетическим дефектом на уровне -клеток при ИНСД — нарушением превращения проинсулина в инсулин — амилин откладывается в -клетках и снижает секрецию инсулина.
«Глюкозотоксичность»
Хроническая гипергликемия сама может вызвать структурные нарушения островков Лангерганса и снижение секреции инсулина.
Наряду с этим гипергликемия уменьшает способность инсулина стимулировать поступление глюкозы в периферические ткани.
«Дефицитный фенотип»
Согласно гипотезе Hales и Barker (1992) недостаточное питание (дефицит аминокислот) в периоде внутриутробного развития или в раннем постнатальном периоде приводит к замедленному развитию эндокринной функции поджелудочной железы и предрасположенности к ИНСД во взрослом состоянии.
Мутации гена глюкокиназы
Мутации гена глюкокиназы, расположенного на 7 хромосоме, приводят к нарушению секреции инсулина у больных, страдающих MODY-диабетом (см. далее).
Снижение чувствительности периферических тканей к инсулину
Снижение чувствительности периферических тканей к инсулину (инсулинорезистентность) играет важную роль в патогенезе ИЗСД.
Различают инсулинорезистентность пререцепторную, рецепторную и пострецепторную.
Пререцепторная инсулинорезистентность
Пререцепторная инсулинорезистентность может быть связана с генетически обусловленной продукцией измененной, неактивной молекулы инсулина или неполной конверсией проинсулина в инсулин.
В основе дефектной молекулы инсулина лежит нарушение последовательности аминокислот в молекуле инсулина (в позиции 24 В-цепи вместо фенилаланина встроен лейцин). Биологическая активность такого инсулина снижена. Нарушается также превращение проинсулина в инсулин, образуется избыток проинсулина, который биологически малоактивен, но при радиоиммунологическом анализе определяется вместе с инсулином и создает ложное впечатление о гиперинсулинемии.
Рецепторная инсулинорезиствитность
Основными органами-мишенями для инсулина являются печень, жировая и мышечная ткани. Инсулин начинает свое действие на клетку посредством связывания (взаимодействия) со специфическими молекулами-рецепторами, расположенными на наружной поверхности мембраны клетки. Количество рецепторов зависит от деятельности гена, расположенного на 19 хромосоме.
Инсулиновый рецептор представляет собой гликопротеин, состоящий из двух -субъединиц и двух -субъединиц. После взаимодействия инсулина с рецептором происходит фосфорилирование -субъединицы и активация тирозинкиназы (второй мессенджер-посредник действия инсулина) и проявляются метаболические эффекты инсулина.
В настоящее время установлено уменьшение количества рецепторов инсулина у 2/3 больных ИНСД. Не исключено, что при ИНСД увеличивается количество рецепторов, находящихся в неработающем, «запасном» состоянии (в норме во взаимодействии с инсулином находятся лишь 10% рецепторов).
При ИНСД возможен генетически обусловленный синтез аномальных неактивных рецепторов к инсулину. В ряде случаев рецепторная инсулинорезистентность обусловлена появлением антител к рецепторам инсулина.
Пострецепторная инсулинорезистентность
Пострецепторные нарушения приводят к уменьшению максимальной метаболической активности инсулина в клетке. При ИНСД установлены следующие пострецепторные нарушения, обусловливающие инсулинорезистентность.
Снижение активности тирозинкиназы ( Freidenberg, Henry, Klein, 1987)
Как указывалось выше, активация тирозинкиназы является важнейшим условием для проявления эффектов инсулина в клетке. Активность тирозинкиназы у больных с ИНСД значительно снижена (на 50% и более), что обусловливает пострецепторную инсулинорезистентность.
Уменьшение числа транспортеров глюкозы
Транспортеры глюкозы (GluT) — это белки, расположенные на внутренней поверхности клеточной мембраны и обеспечивающие транспорт глюкозы внутрь клетки.
Транспортеры глюкозы делятся на 2 группы:
• Nа+-котранспортеры, осуществляющие перенос глюкозы против градиента концентрации путем сопряжения захвата Nа+ и глюкозы;
• облегченные транспортеры, осуществляющие перенос глюкозы путем усиления механизмов пассивного транспорта.
В настоящее время описано 5 транспортеров глюкозы в зависимости от их распределения в различных органах и тканях. GluT-1 рассматривается как повсеместная форма переносчика, ответственная за базовый перенос глюкозы во всех клетках, GluT-2 отвечает за транспорт глюкозы к гепатоцитам и -клеткам островков Лангерганса, GluT-3 проявляет свой эффект в нейронах, СН. GluT-4 — отвечает за инсулинстимулированный захват глюкозы мышечной и жировой тканями, GluT-5— эпителием тонкой кишки и почек.
В инсулинзависимых тканях (жировой, мышечной) инсулин регулирует работу переносчиков глюкозы.
У больных ИНСД выявлено снижение количества и активности транспортера глюкозы GluT-4 в мышечной и жировой ткани (Gerar, 1995), что способствует развитию инсулинорезистентности. Отмечено также уменьшение GluT-2 в -клетках, что способствует уменьшению секреции инсулина.
Уменьшение активности пируватдегидрогеназы и гликогенсинтетазы в мышечной ткани
Окисление глюкозы в мышцах катализируется ферментом пируватдегидрогеназой и регулируется инсулином. Активность этого фермента при ИНСД снижена в связи с конкурентным влиянием свободных жирных кислот, концентрация которых значительно увеличена. Установлено также снижение активности инсулинзависимого фермента гликогенсинтетазы у больных ИНСД, что уменьшает синтез гликогена из глюкозы в мышечной ткани. Groop и соавт. (1993) сообщили о связи между ИНСД и полиморфизмом гена гликогенсинтетазы (хромосома 19).
Указанные нарушения возникают на самых ранних стадиях ИНСД. Снижение синтеза гликогена в мышцах выявлено у лиц с нарушенной толерантностью к глюкозе, имеющих родственников первой степени родства с ИНСД (Guillauseau, 1996).
