
акушерство
.pdfТяжесть асфиксии новорожденного определяют по состоянию дыхательной, сердечнососудистой системы и ЦНС в соответствии со шкалой Апгар, применяемой через 1 и 5 мин после рождения (см. главу "Методы обследования в акушерстве и перинатологии).
Различают легкую, среднетяжелую и тяжелую асфиксию новорожденных. Оценка по шкале Апгар 6-7 баллов через 1 мин после рождения соответствует легкой асфиксии новорожденного, 4-5 баллов - асфиксии средней тяжести, 0-3 балла - тяжелой асфиксии.
Оценка по шкале Апгар через 5 мин после рождения отражает эффективность или неэффективность реанимационных мероприятий.
При сохранении низкой оценки через 5 мин, оценку состояния ребенка по шкале Апгар целесообразно проводить также на 10-й, 15-й и 20-й минутах жизни пока оценка не достигнет 7 баллов или первичная реанимация будет прекращена из-за ее неэффективности. При реанимационных меро-приятиях, включающих ИВЛ, оценка по шкале Апгар учитывает наличие или отсутствие попытки самостоятельного дыхания (0 или 1 балл соответственно).
Помимо оценки состояния новорожденного по шкале Апгар, у всех детей, родившихся в асфиксии, необходимо определить кислотно-основное состояние, которое в большой мере отражает тяжесть асфиксии.
При легкой асфиксии рН крови из вены пуповины составляет ‹ 7,2;
ВЕ $ - 10 мэкв/л. При тяжелой асфиксии изменение кислотно-основного состояния крови более выражено: рН ‹ 7,0 и ВЕ > -15 мэкв/л.
Лечение. Первичная реанимация ребенка, родившегося в асфиксии, проводится в родильном зале неонатологом-реаниматологом. Первую помощь ребенку, родившемуся в асфиксии, должен уметь оказать акушер.
Начало лечебных мероприятий зависит от признаков живорожденности, к которым относятся самостоятельное дыхание, сердцебиение, пульсация пуповины, произвольные движения мышц. При отсутствии всех этих признаков живорожденности плод считается мертворожденным и реанимации не подлежит. Если у ребенка отмечается хотя бы один из признаков живорожденности, ребенку необходимо оказать первичную медицинскую помощь.
Новорожденным, родившимся в асфиксии, оказывают помощь в соответствии с Приложением 1 к Приказу МЗ РФ № 372 "Первичная и реанимационная помощь новорожденному в родильном зале".
Объем и последовательность реанимационных мероприятий зависят от степени нарушения дыхания и сердечной деятельности новорожденного.
Оказание первичной помощи ребенку, родившемуся в асфиксии, начинают с восстановления свободной проходимости дыхательных путей. При аспирации околоплодных вод, особенно с примесью мекония, необходима интубация трахеи с последующей санацией трахеобронхиального дерева. Диаметр интубационной трубки определяется массой тела новорожденного: до 1000 г - 2,5 мм, от 1000 до 2500 г - 3 мм, более 2500 кг - 3,5 мм.
При отсутствии самостоятельного дыхания или его неадекватности (судорожное, нерегулярное, поверхностное) приступают к ИВЛ.
ИВЛ можно проводить саморасправляющимся мешком (мешок Амбу) через лицевую маску или интубационную трубку. Первые 2 вдоха при масочной ИВЛ выполняют с максимальным давлением в конце вдоха - 30 см вод.ст., а при последующих вдохах давление поддерживают в пределах 15 см вод.ст. при здоровых легких и 20 см вод.ст. при аспирации мекония или синдроме дыхательных расстройств.
При ЧСС ниже 80 в минуту и масочной ИВЛ проводят непрямой массаж сердца, положив ребенка на твердую поверхность. Непрямой массаж сердца можно выполнить с помощью II и III пальцев одной кисти или с помощью больших пальцев обеих кистей, обхватывая кистями грудную клетку новорожденного. Частота массажных движений должна составлять 2 в секунду. Если сердечная деятельность не восстанавливается или сохраняется брадикардия, необходимо внутривенное (внутрисердечное) введение 0,1% раствора адреналина в дозе 0,1 мг/кг.
Реанимацию в родильном зале прекращают, если отмечаются адекватное самостоятельное дыхание, нормальные ЧСС и цвет кожных покровов. Если через 20 мин после рождения при проведении адекватных реанимационных мероприятий сердечная деятельность не восстанавливается, констатируют смерть.
Реанимация в родильном зале является лишь первым этапом оказания помощи детям, родившимся в асфиксии. Дальнейшее наблюдение и лечение проводят в отделении (палате) интенсивной терапии, куда ребенка переводят сразу по окончании реанимационных мероприятий. При неадекватном самостоятельном дыхании, шоке, судорогах и центральном цианозе новорожденного доставляют в отделение (палату) интенсивной терапии с продолжающейся ИВЛ, начатой в родильном зале. В дальнейшем комплексное лечение проводится по общим принципам интенсивной терапии новорожденных в зависимости от варианта патологии.
Постгипоксические поражения ЦНС. Гипоксия плода и асфиксия новорожденного могут приводить к перинатальным поражениям ЦНС, в первую очередь к гипоксическиишемическим и гипоксически-геморрагическим поражениям головного мозга.
При легких поражениях ЦНС у ребенка определяется негрубая и непостоянная неврологическая симптоматика (повышенная нервно-рефлекторная возбудимость).
При поражениях ЦНС средней тяжести преобладают симптомы общего угнетения; может развиться гипертензионный синдром. При общем угнетении мышечный тонус снижен или повышен, возможна его асимметрия в верхних и нижних конечностях; отмечается угнетение многих врожденных безусловных рефлексов; новорожденные вяло сосут, часто срыгивают. Локальная неврологическая симптоматика, как правило, отсутствует. При гипертензионном синдроме нарастает двигательное беспокойство с выбуханием родничков, мелкоамплитудным тремором, симптомом Грефе и "заходящего солнца", горизонтальным нистагмом; возможны кратковременные приступы клонических судорог.
Дети с тяжелым поражением ЦНС рождаются в состоянии гипоксемического шока с выраженными нарушениями гемодинамики; оценка по шкале Апгар при рождении не превышает 3 баллов. После первичной реанимации у ребенка сохраняются сердечнососудистые и дыхательные расстройства, резкое угнетение ЦНС. Дети находятся в коматозном состоянии, малоподвижны, слабо стонут, возможны частые судорожные припадки с преобладанием тонического компонента, очаговая сиптоматика. Тяжесть клинической картины обусловлена генерализованным отеком мозга и/или внутричерепными кровоизлияниями.
Наиболее частыми проявлениями постгипоксического перинатального поражения ЦНС, особенно у недоношенных, служат пери/интравентрикулярные кровоизлияния и перивентрикулярная лейкомаляция.
Пери/интравентрикулярные кровоизлияния. Кровоизлияния у новорожденных сначала развиваются в слое субэпендимального герминального матрикса (источник церебральных нейробластов), расположенного вентролатерально к боковому желудочку. Кровоизлияние в герминальный матрикс может наступать сразу после рождения, но чаще происходит в первые 4 дня жизни. На месте кровоизлияния в герминальном матриксе может образоваться киста. Кровоизлияние способно распространиться по всей желудочковой системе мозга.
Клиническое обследование новорожденных, особенно глубоко недоношенных, в первые часы и дни не всегда позволяет выявить четкую картину неврологического дефекта.
В диагностике перинатальных поражений ЦНС важную роль играет нейросонография.
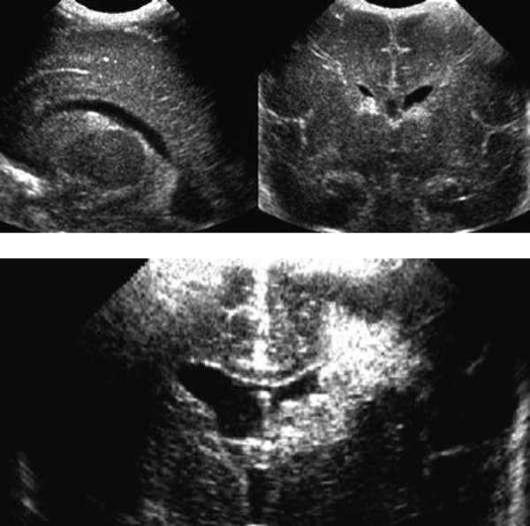
По данным нейросонографии выделяют 4 степени пери/интравентрикулярных кровоизлияний:
- I степень - изолированное субэпендимальное кровоизлияние (рис. 32.5);
-
II степень - внутрижелудочковые кровоизлияния без расширения желудочков мозга;
-III степень - внутрижелудочковые кровоизлияния с расширением желудочков мозга;
-IV степень - внутрижелудочковые кровоизлияния с вентрикуломегалией и паренхиматозным кровоизлиянием (рис. 32.6).
Рис. 32.5. Кровоизлияние I степени. Нейросонограмма
Рис. 32.6. Кровоизлияние IV степени. Нейросонограмма
Под перивентрикулярной лейкомаляцией понимают билатеральный ишемический инфаркт белого вещества, прилежащего к боковым желудочкам головного мозга. Привентрикулярная лейкомаляция особенно часто возникает у недоношенных новорожденных.
Факторами риска развития перивентрикулярной лейкомаляции являются ацидоз, эпизоды гипотензии (среднее АД ниже 30 мм рт.ст.), гиповолемия, резкое снижение АД, эпизоды брадикардии.
В клинической картине в неонатальном периоде на первый план выступают общие симптомы угнетения ЦНС, которые проявляются мышечной гипотонией, преимущественно в нижних конечностей.
Диагноз устанавливают при нейросонографии (рис. 32.7). Пора-жение белого вещества может быть фокальным, с эволюцией в множественные кистозные полости через 1-2 нед. Размеры, число и локализация кист служат важным прогностическим критерием.
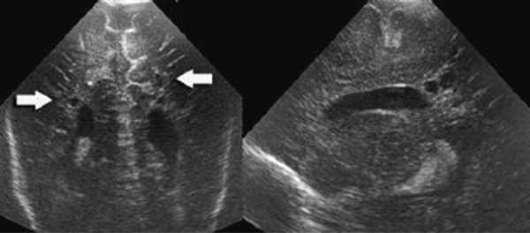
Рис. 32.7. Перивентрикулярная лейкомаляция. Нейросонограмма
Отдаленные последствия перивентрикулярной лейкомаляции - спастическая диплегия, преимущественно нижних конечностей. В тяжелых случаях поражение нижних конечностей сочетается с поражением верхних конечностей и умственной отсталостью; могут отмечаться нарушения зрения.
ЗАДЕРЖКА РОСТА ПЛОДА, ГИПОТРОФИЯ НОВОРОЖДЕННОГО
Под задержкой роста плода (ЗРП) понимают несоответствие размеров плода предполагаемому сроку беременности.
ЗРП наряду с хронической гипоксией, является одним из основных клинических признаков хронической плацентарной недостаточности любого генеза (см. раздел "Плацентарная недостаточность", в главе 23). Помимо этого, патология плода (врожденные аномалии развития), влияя на формирование плаценты и на компенсаторно-приспособительные механизмы в системе мать-плацента-плод, может служить причиной хронической плацентарной недостаточности, и в следствие этого, - ЗРП.
Выделяют две основные формы ЗРП, которые по данным УЗИ характеризуются различными соотношениями показателей фетометрии: симметричная и асимметричная.
Симметричная форма ЗРП, как правило, развивается в ранние сроки беременности (первая половина) и может быть обусловлена врожденной патологией, в том числе наследственными заболеваниями и хромосомными аберрациями (трисомии по 18-й, 21- й, 13-й паре хромосом, моносомии), инфекционными заболеваниями (краснуха, токсоплазмоз, герпес, сифилис, цитомегаловирусная инфекция). Причинами симметричной формы ЗРП могут быть курение, алкоголизм, наркомания, а также недостаточное и неполноценное питание матери.
Асимметричная форма ЗРП развивается в более поздние сроки (III триместр) и, как правило, обусловлена либо экстрагенитальной патологией у матери (гипертоническая болезнь, бронхиальная астма, аутоиммунные заболевания), либо хронической плацентарной недостаточностью на фоне осложнений беременности (гестоз, многоплодная беременность, длительная угроза прерывания и т.д.).
Диагностика ЗРП возможна с помощью наружного акушерского обследования (измерение и пальпация) и УЗИ. Скрининговым методом диагностики ЗРП является определение высоты стояния дна матки, отставание которой от срока беременности на 2 см и более дает основание заподозрить нарушение роста плода. Более объективную информацию дает ультразвуковая фетометрия, которая позволяет установить диагноз, определить форму и степень ЗРП.
Симметричная задержка роста, при которой отмечается пропорциональное уменьшение всех фетометрических показателей (головка, живот, длина бедра), встречается у 10-30% беременных с ЗРП. Правильная диагностика данной формы ЗРП возможна при точном знании срока беременности или при динамической эхографии, когда выявляется отставание прироста фетометрических показателей.
Симметричное отставание фетометрических показателей не всегда позволяет с уверенностью установить диагноз ЗРП, так как маленькие размеры плода могут быть обусловлены конституциональными особенностями родителей, т.е. генетически детерминированы.
Асимметричная форма ЗРП проявляется отставанием размеров туловища (живота) при нормальных размерах головки и бедра и наблюдается у 70-90% беременных с ЗРП. Диагностика асимметричной формы ЗРП не представляет затруднений при ультразвуковой фетометрии.
На основании результатов фетометрии при УЗИ, помимо формы, можно определить степень ЗРП. При I степени показатели фетометрии отстают от нормы на 2 нед, при II степени - на 3-4 нед, при III - более чем на 4 нед. Тяжесть асимметричной формы ЗРП коррелирует с проявлениями хронической плацентарной недостаточности: преждевременным созреванием плаценты, уменьшением ее толщины, а также маловодием.
При ЗРП независимо от ее формы для определения компенсаторных возможностей плода необходима оценка его функционального состояния. ЗРП (обычно асимметричная форма) нередко сочетается с гипоксией, которая выявляется при кардиотокографии, допплерометрии плодово-плацентарного и плодового кровотока, изучении биофизического профиля плода.
При выраженной ЗРП (II-III степени) на кардиотокограммах могут наблюдаться снижение вариабельности сердечного ритма, ареактивный нестрессовый тест; при допплерометрии отмечаются нарушения кровотока в артерии пуповины, аорте, средней мозговой артерии, венозном протоке. Биофизический профиль плода включает в себя угнетение двигательной, дыхательной активности, мышечного тонуса (см. главу "Гипоксия плода").
Тактика ведения беременности и родов. Лечение ЗРП зависит от ее этиологии, срока беременности, формы и выраженности ЗРП и направлено на коррекцию нарушений в системе мать-плацента-плод (см. главу "Плацентарная недостаточность").
Для оценки темпов роста и функционального состояния плода на фоне терапии необходимы повторные УЗИ (через 7-14 дней) с допплерометрией кровотока в системе мать-плацента-плод (каждые 3-5 дней), кардиомониторное наблюдение (ежедневно).
Если под влиянием терапии рост плода нормализуется, его функциональное состояние находится в пределах нормы, то родоразрешение проводят не ранее 37 нед после подтверждения зрелости легких плода. При неэффективности лечения (отсутствие роста плода в течение 2 нед) или ухудшении состояния плода необходимо досрочное родоразрешение независимо от срока.
Гестации. Показанием к кесареву сечению является ЗРП III степени, срок родоразрешения определяется функциональным состоянием плода. При ЗРП II степени показания к абдоминальному родоразрешению определяются состоянием плода и сопутствующей акушерской патологией.
После рождения плода с ЗРП следует взвесить и внимательно осмотреть плаценту с целью выявления инфарктов, отложений фибрина, артериовенозных пороков, определения места прикрепления пуповины. Плаценту отправляют в лабораторию патоморфологии для установления причины ЗРП.
Гипотрофия новорожденных является следствием многочисленных нарушений во внутриутробном периоде. Новорожденный имеет клинические признаки пониженного питания: дефициты массы тела по отношению к его длине (при асимметричной форме), уменьшение толщины подкожного жирового слоя, морщинистую кожу, снижение тургора, сухость и бледность кожных покровов.
Степень гипотрофии новорожденных определяют по массо-ростовому показателю (отношение массы тела ребенка в граммах к длине тела в сантиметрах) соответственно
гестационной норме. При гипотрофии новорожденного I степени и гестационном сроке более 37 нед массо-ростовой показатель составляет от 55 до 60, при II степени - от 50 до 55, при III степени - менее 50. Для нормотрофичного доношенного ребенка этот показатель составляет 60 и более. При определении степени гипотрофии у детей из двойни следует учитывать, что массо-ростовой показатель у них меньше, чем у новорожденных аналогичного гестационного возраста при одноплодной беременности.
У новорожденных с гипотрофией адаптация в раннем неонатальном периоде нередко нарушена. Возможны нарушения терморегуляции, гипо-гликемия, гипокальциемия (особенно в 1-е сутки жизни), гипербилирубинемия, замедленное восстановление массы тела и др.
В то же время у недоношенных детей с гипотрофией реже развивается респираторный дистресс-синдром, чем у нормотрофичных недоношенных. Это обусловлено более ранним образованием альвеолярного сурфактанта, которое стимулируется высоким уровнем эндогенных стероидов при хронической гипоксии плода.
Детей с симметричной гипотрофией необходимо обследовать для выявления внутриутробной инфекции (гепатоспленомегалия, высыпания на коже и слизистых оболочках, аномалии сердечно-сосудистой и нервной системы) или врожденных пороков развития.
Дети, родившиеся с гипотрофией, в дальнейшем нередко отстают в росте, у них отмечают задержку костного возраста, неврологические расстройства различной выраженности, нарушения полового созревания и др. Прогноз наиболее неблагоприятен у детей с симметричной гипотрофией, сопровождающейся врожденной инфекцией или аномалиями развития.
ВНУТРИУТРОБНЫЕ ИНФЕКЦИИ
Внутриутробное инфицирование плода не всегда сопровождается развитием инфекционного заболевания, что объясняется мобилизацией иммунитета и защитных механизмов в системе мать-плацента-плод.
Выделяют вирусные заболевания эмбриона и плода и заболевания, вызванные бактериальной флорой.
Для обозначения инфекций со сходными клиническими проявлениями используют аббревиатуру TORCH: Т - токсоплазмоз, О - другие (other) инфекции (сифилис, хламидиоз, энтеровирусные инфекции, гепатиты А и В, гонорея, листериоз), R - краснуха (rubella), С - цитомегаловирусная инфекция (cytomegalia), Н - герпесвирусная инфекция (herpes).
Значительное место среди многообразных возбудителей внутриутробной инфекции занимают грамотрицательные аэробные бактерии, неспорообразующие анаэробы, микоплазмы, стрептококки группы В, дрожжеподобные грибы.
Тяжесть и клинические проявления внутриутробной инфекции зависят от вида возбудителя, его вирулентности, массивности обсеменения иммунного статуса организма беременной, срока гестации, а также путей проникновения возбудителя в организм.
Внутриутробная инфекция, развившаяся в первые 3 мес гестации, может стать причиной инфекционных эмбриопатий, врожденных пороков развития плода, первичной плацентарной недостаточности, неразвивающейся беременности, самопроизвольного выкидыша. Более неблагоприятны в отношении эмбриопатий микроорганизмы с внутриклеточным циклом развития (вирусы), обладающие высоким тропизмом к эмбриональным тканям.
При внутриутробной инфекции, развившейся после 3-го мес гестации, возникают инфекционные фетопатии с задержкой роста плода, формированием вторичной плацентарной недостаточности, возникновением дизэмбриогенетических стигм,
собственно инфекционным поражением плода. Инфекция, как правило, генерализованная, сопровождается нарушением маточно-плацентарного кровообращения, дистрофическими, некробиотическими реакциями, нарушением формообразовательных процессов с избыточным разрастанием соединительной ткани (глиоз мозга, эндокардиальный фиброэластоз). Воспалительные изменения у плода могут вызвать сужение или обтурацию существующих анатомических каналов и отверстий с последующим развитием аномалий (гидроцефалия, гидронефроз).
Во второй половине фетального периода (с 6-7-го мес) благодаря становлению клеточного и гуморального иммунитета плод приобретает способность специфически реагировать на внедрение возбудителей инфекции.
В качестве симптомов внутриутробной инфекции в раннем неонатальном периоде выявляют гипотрофию, гепатоспленомегалию, желтуху, сыпь, дыхательные расстройства, сердечно-сосудистую недостаточность и тяжелые неврологические нарушения.
Для диагностики внутриутробного инфицирования используют бактериологические и иммунологические методы. К ним относится обнаружение в посевах микроорганизмов более 5-102 КОЕ/мл. Более современным и специфичным является метод молекулярной гибридизации, суть которого заключается в идентификации фрагментов ДНК или РНК клеток возбудителя. Посевы и соскобы берут у беременных из влагалища и цервикального канала.
Для диагностики внутриутробного инфицирования высокочувствителен ELISA - метод определения моноклональных антител с помощью тест-системы в жидкостях и средах организма матери и плода (кровь плода, полученная с помощью кордоцентеза).
Высокий титр антител в сочетании с выделенным антигеном (возбудителем) свидетельствует об инфицированности плода и элементов плодного яйца.
Эхографические признаки внутриутробной инфекции включают в себя многоводие, утолщение и несвоевременное созревание плаценты, гиперэхогенность кишечника, пиелоэктазию, газ в желчном пузыре плода, гепатомегалию с увеличением живота плода.
Общие принципы профилактики и лечения внутриутробной инфекции состоят в этиотропной противомикробной терапии; профилактике (лечении) фетоплацентарной недостаточности; коррекции и профилактике нарушений микробиоценозов организма беременной (бифидумбактерин, ацилакт или лактобактерин внутрь или вагинально в критические сроки беременности или в сочетании с курсами антибактериальной или противовирусной терапии).
Вирусные инфекции. Краснуха. Наибольшую опасность для эмбриона представляет вирус краснухи. Риск заражения краснухой существует при отсутствии в крови женщины антител к антигену вируса.
При заболевании краснухой в первые 2 мес беременности вероятность инфицирования эмбриона достигает 80%, а возникновения уродств - 25%. Поражение эмбриона вирусом может закончиться его гибелью (эмбриотоксический эффект) или возникновением врожденных пороков сердца, глухоты, катаракты, микроофтальмии, хориоретинита и микроцефалии. Инфицирование плода в более поздние сроки может сопровождаться появлением у новорожденного типичных кожных высыпаний.
Высокий риск возникновения эмбриопатий при заболевании краснухой или контакте с больным краснухой в первые 3 мес беременности требует ее прерывания.
По рекомендации ВОЗ женщинам детородного возраста вне беременности исследуют кровь на антитела к вирусу краснухи. Оптимальной мерой профилактики считается иммунизация вакциной краснухи девочек и женщин детородного возраста, не имеющих антител к вирусу краснухи.
Цитомегаловирус является наиболее распространенным вирусом, передающимся плоду во внутриутробном периоде.
При цитомегалии отмечается высокий риск прерывания беременности, самопроизвольного выкидыша, неразвивающейся беременности, преждевременных родов, антенатальной гибели плода, аномалий развития, многоводия. Ультразвуковыми маркерами инфицирования плода могут быть микроцефалия, кальцификаты в головном мозге, вентрикуломегалия, гиперэхогенность кишечника. В I и II триместрах беременности вероятность инфицирования эмбриона/плода наименьшая, к концу беременности она достигает 40%.
Выделение цитомегаловируса у беременной не означает острого заболевания. Часто формируется бессимптомное вирусоносительство или субклиническая хроническая инфекция. У серопозитивных беременных возможны обострение и реактивация процесса с развитием внутриутробной инфекции. Наивысший риск внутриутробного поражения плода связан с первичной цитомегаловирусной инфекцией, которая возникает у 1-4% беременных. При хронической или латентной инфекции у беременных показано сероиммунологическое обследование 1 раз в 1,5-2 мес.
Лечение во время беременности заключается в проведении курсов пассивной иммунизации противоцитомегаловирусным иммуноглобулином (во 2-й половине беременности). По показаниям назначают специфический противовирусный препарат (ацикловир), а также виферон, который оказывает иммуномодулирующее и антиоксидантное действие.
Вопрос о прерывании беременности решается индивидуально в зависимости от выявленной у плода патологии.
Ранними проявлениями у новорожденного являются желтуха, гепато-, спленомегалия, геморрагический синдром. У новорожденных с врожденной цитомегаловирусной инфекцией вирус обнаруживают в моче, слюне, спинномозговой жидкости. Летальность при врожденной цитомегаловирусной инфекции достигает 20-30%; у 90% выживших детей отмечаются поздние осложнения в виде потери слуха, задержки умственного и физического развития, хориоретинита, атрофии зрительного нерва, нарушение роста зубов и т.д.
Эффективной специфической противовирусной терапии у детей, как и у взрослых, не существует. Для снижения виремии рекомендуют специфический антицитомегаловирусный иммуноглобулин.
Вирус простого герпеса. Инфицирование плода происходит восходящим (из шейки матки) и трансплацентарным (гематогенным) путем. Инфекционные поражения плаценты и плода, формирование врожденных пороков развития, антенатальная гибель плода при герпетической инфекции возможны в любом сроке гестации. Интранатально при хроническом герпесе инфицируются 0,5-1% плодов; при остром генитальном герпесе и обострении хронического риск инфицирования плода в родах достигает 40%. Возможно и постнатальное поражение новорожденных при герпетических проявлениях у матери.
При первичном инфицировании женщины в ранние сроки беременности необходимо ставить вопрос о ее прерывании. При возникновении заболевания в более поздние сроки или при инфицировании до беременности проводят динамический ультразвуковой контроль развития и состояния плода. Курсовая терапия, включает в себя противовирусные препараты (во 2-й половине беременности) (ацикловир) и иммуномодуляторы. Проведение противовирусной терапии в I триместре беременности нежелательно.
Метод родоразрешения при герпетической инфекции зависит от наличия или отсутствия поражения половых органов к моменту родов. При герпетическом
поражении половых органов в конце беременности рекомендуется родоразрешение путем кесарева сечения.
У новорожденных возможны локализованные герпетические поражения кожи или глаз (офтальмогерпес). Диссеминированный процесс может проявляться признаками сепсиса. Везикулярные элементы на слизистых оболочках и коже являются важным диагностическим критерием заболевания. Для диагностики исследуют содержимое везикул. При всех клинических формах неонатальной герпетической инфекции назначают ацикловир и иммуномодуляторы.
Вирусные гепатиты. Беременные с легкими формами гепатита А находятся под амбулаторным наблюдением акушера-гинеколога и инфекциониста.
Тератогенность вируса гепатита А не доказана. Риск передачи вируса плоду незначителен, но установлена возможность вертикальной передачи инфекции во время родов.
При контакте беременной с больным гепатитом А необходимо ввести ей g-глобулин с профилактической целью.
Передача вируса гепатита A новорожденному возможна, если мать находится в инкубационном периоде или в остром периоде заболевания во время родов, а также при переливании инфицированной крови.
Гепатит В передается через инфицированные препараты крови, слюну, выделения из влагалища. Маркером гепатита В является HbsAg, обнаруживаемый при исследовании материнской крови. При гепатите В отмечается повышенная частота самопроизвольных абортов, задержки роста плода и преждевременных родов. Риск инфицирования плода значительно выше, если женщина перенесла острый гепатит в III триместре беременности. Трансплацентарная передача гепатита В наблюдается редко, плод чаще заражается во время родов. Возможно также заражение новорожденного гепатитом В при грудном вскармливании.
При HBs-Ag-позитивной крови у матери всем новорожденным, так же, как и родившимся у здоровых матерей, проводится вакцинация в первые 12 ч после рождения. Если мать перенесла гепатит В во время беременности, новорожденному дополнительно вводят специфический иммуноглобулин.
Новорожденных, родившихся у матерей - носительниц вируса гепатита В, не изолируют. Новорожденные с подтвержденным гепатитом В должны быть изолированы.
Гепатит С (ни А, ни В). Носительство антител к вирусу гепатита С отмечается у 1,5- 5,2% беременных. Пути передачи инфекции к плоду такие же, как при гепатите В, но чаще бывает вертикальная передача вируса. Методы профилактики не разработаны.
Профилактика заражения персонала вирусным гепатитом заключается в использовании двух пар перчаток при приеме родов и выполнении хирургических операций.
Грипп. Вирус гриппа может проникать через плаценту. При тяжелом гриппе у беременных возможны самопроизвольное прерывание беременности, аномалии развития, гибель плода, рождение недоношенных и функционально незрелых детей.
Во время вспышек гриппа беременных целесообразно иммунизировать поливалентной убитой вакциной.
Парвовирусная инфекция может проявляться кожной сыпью, болями в горле, артралгиями, транзиторной апластической анемией, субфебрилитетом. Риск прерывания беременности при отсутствии антител к парвовирусу наиболее высок до в сроки 20 нед. Заражение плода происходит в фазу вирусемии.
В ранние сроки беременности при парвовирусной инфекции возможны самопроизвольные аборты, в поздние сроки - внутриутробная гибель плода, а также развитие неиммунной водянки плода как проявления тяжелой формы гемолитической анемии. В большинстве наблюдений при серологически подтвержденной инфекции у матери повреждающего действия на плод не отмечается, что можно объяснить нейтрализацией вируса антителами.
Специфической терапии парвовирусной инфекции не существует, для профилактики тяжелых осложнений применяют иммуноглобулин.
Коксаки-вирусная инфекция в I триместре беременности может приводить к формированию пороков развития желудочно-кишечного тракта и мочеполовой системы, ЦНС. При инфицировании в поздние сроки беременности у новорожденного возможны лихорадка, рвота, гипотония, кожные высыпания, судороги.
ВИЧ-инфекция. У ВИЧ-инфицированных женщин часто происходят преждевременные роды и бывает задержка роста плода. Вирус может передаваться внутриутробно или при грудном вскармливании. Кесарево сечение не уменьшает риск инфицирования новорожденных.
У детей, инфицированных ВИЧ, отмечаются кожные проявления в виде бактериальной, грибковой и вирусной экзантем.
В настоящее время для лечения приобретенного иммунодефицита применяют зидовудин. У серопозитивных беременных этот препарат предотвращает передачу вируса плоду. Кормление ребенка грудью не рекомендуется.
Бактериальные инфекции. При бактериальном инфицировании плодного яйца в ранние сроки эмбрион обычно погибает и беременность заканчивается самопроизвольным выкидышем; тератогенный эффект отсутствует. При инфицировании в поздние сроки беременности повышен риск преждевременных родов.
Бактериальное инфицирование плода может происходить трансплацентарно при очагах фокальной инфекции в организме матери (тонзиллит, гайморит, кариес, пародонтоз, пиелонефрит и др.) и восходящим путем при преждевременном излитии околоплодных вод. Развитию восходящей инфекции способствуют кольпиты, цервициты, биопсия хориона, амниоцентез, кордоцентез, фетоскопия, частые влагалищные исследования во время родов.
Внутриутробная бактериальная инфекция может проявляться симптомами хориоамнионита (повышение температуры тела, озноб, тахикардия, гноевидные выделения из половых путей, лейкоцитоз и др.) и сопровождаться нарушениями состояния плода.
Стрептококковая инфекция. Эта инфекция передается, как правило, восходящим путем, происходит преимущественно интранатальное инфицирование плода. Тяжелые формы внутриутробной инфекции (пневмония, менингит, сепсис) наблюдаются редко. Лечение состоит в проведении антибиотикотерапии матери в соответствии с чувствительностью возбудителя.
Листериоз. Антенатальное заражение листериозом в ранние сроки беременности (трансплацентарно) приводит к гибели плода и самопроизвольному аборту. На более поздних сроках беременности инфекция проявляется сепсисом с возникновением специфических гранулем в органах и тканях плода.
У новорожденных врожденный листериоз проявляется аспирационной пневмонией, часто поражаются орган слуха, ЦНС и печень. Возможны высыпания на коже, слизистых оболочках глотки, зева, конъюнктиве. Возбудитель инфекции можно обнаружить в содержимом кожных папул, меконии, моче и спинномозговой жидкости.
