
Volume1
.pdf
748 Часть 2. Основные генетические механизмы
образуется преждевременный стоп-кодон и, следовательно, синтезируется укороченная форма белка. В клетках печени редактирующий фермент не экспрессируется и синтезируется полная форма аполипопротеина B. Две изоформы белка обладают различными свойствами, и каждая играет специализированную роль в метаболизме липидов, специфичном для органа, в котором она образуется.
Почему вообще существует редактирование РНК, остается загадкой. Одна из идей состоит в том, что оно возникло в ходе эволюции для исправления «ошибок» в геноме. Другое предположение, что оно появилось как своего рода небрежный способ образования клеткой слегка различающихся белков от одного гена. Третья возможность — что редактирование РНК первоначально развивалось как защитный механизм против ретровирусов и ретротранспозонов, а позже было адаптировано клеткой, чтобы изменять смысл определенных мРНК. Действительно, редактирование РНК до сих пор играет важную роль в защите клетки. Некоторые ретровирусы, включая ВИЧ (см. рис. 5.71), подвергаются существенному редактированию после того, как заразят клетки. Это гиперредактирование порождает множество вредных мутаций в вирусном РНК-геноме, а также приводит к тому, что вирусные мРНК задерживаются в ядре, где в итоге деградируют. Несмотря на то что некоторые современные ретровирусы защищают себя от действия этого механизма, он, повидимому, помогает держать многие вирусы под контролем.
У приматов частота А →I-редактирования значительно выше, чем у других млекопитающих, и в большинстве случаев оно происходит на РНК, транскрибируемых с представленных в большом изобилии Alu-элементов. Было выдвинуто предположение, что А → I-редактирование остановило эти мобильные элементы от полного «захвата» нашего генома благодаря инактивации необходимых для их пролиферации транскриптов РНК (см. рис. 5.74). Если эта идея верна, то редактирование РНК, возможно, глубоко повлияло на формирование современного генома человека.
7.5.8. Экспорт РНК из ядра может регулироваться
По подсчетам, пределы клеточного ядра у млекопитающих покидает только около одной двадцатой части от всей массы синтезируемых РНК. Согласно главе 6, большинство молекул РНК млекопитающих подвергается обширному процессингу, и «оставшиеся» фрагменты РНК (вырезанные интроны и последовательности РНК с 3′-конца до сайта расщепления/полиаденилирования) деградируют в ядре. Не до конца процессированные или поврежденные иным путем РНК также в итоге разрушаются как часть системы контроля качества образования РНК.
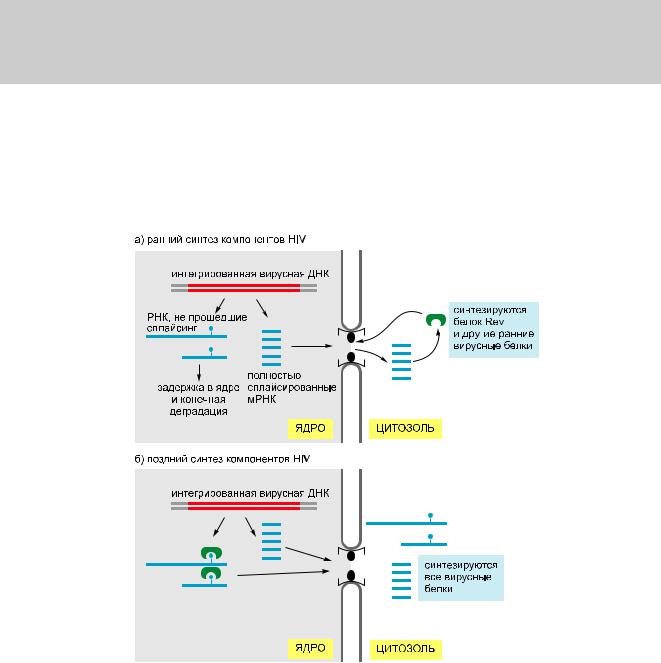
Как описано в главе 6, экспорт молекул РНК из ядра откладывается до момента окончания процессинга. Однако для регуляции экспрессии генов могут использоваться механизмы, которые преднамеренно игнорируют эту контрольную точку. Эта стратегия закладывает основу для одного из наиболее хорошо изученных примеров
регулируемого ядерного транспорта (regulated nuclear transport) мРНК, который встречается у вируса СПИДа человека, ВИЧ.
В главе 5 отмечалось, что ВИЧ, попав в клетку, управляет образованием двухцепочечной ДНК-копии своего генома, которая затем встраивается в геном хозяина (см. рис. 5.71). Встроившись, вирусная ДНК транскрибируется РНК полимеразой II клетки-хозяина как одна длинная молекула РНК. Далее этот транскрипт сплайсируется множеством различных способов с образованием свыше 30 различных видов мРНК, с которых, в свою очередь, транслируются разнообразные белки (рис. 7.102). Для образования вирусного потомства целые, несплайсированные
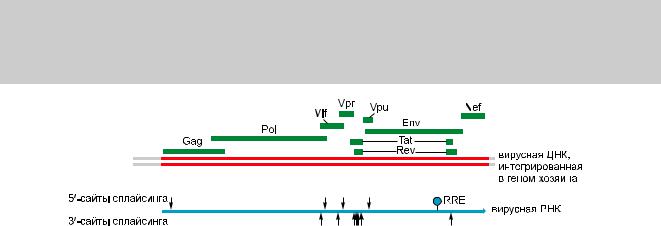

Глава 7. Контроль генной экспрессии 751
которые транслируют с нее полипептидную цепь (см. рис. 6.40). Как только первый цикл трансляции «проходит» тест на нонсенс-опосредованное разрушение (см. рис. 6.80), обычно начинается настоящая трансляция мРНК. Если мРНК кодирует белок, который предназначен для секреции или экспрессирования на клеточной поверхности, то сигнальная последовательность на аминоконце белка направит его к эндоплазматическому ретикулуму (ER; endoplasmic reticulum). Компоненты сортирующего белки аппарата клетки распознают сигнальную последовательность сразу же, как она появляется из рибосомы, и направляют весь комплекс, состоящий из рибосомы, мРНК и растущего белка, к мембране ER, где синтезируется оставшаяся часть полипептидной цепи, как описано в главе 12. В других случаях свободные рибосомы полностью синтезируют белок в цитозоле, а сигналы, содержащиеся в законченной полипептидной цепи, затем могут направлять белок к другим участкам в клетке.
Некоторые мРНК сами направляются к специфическим местам внутри клетки перед началом своей эффективной трансляции, что позволяет клетке расположить молекулы мРНК близко к местам, где существует потребность в кодируемом ими белке. Такая стратегия предоставляет клетке множество преимуществ. Например, позволяет создавать асимметрию в цитозоле клетки, а это ключевой этап на многих стадиях развития. Локализованная мРНК в сочетании с контролем трансляции также позволяет клетке осуществлять независимую регуляцию экспрессии генов
вразличных частях клетки. Это свойство является особенно важным в больших, сильно поляризованных клетках, например нейронах, где конусы роста должны реагировать на сигналы, не ожидая ответа от отдаленного ядра. Локализация РНК встречается у многих организмов, включая одноклеточные грибы, растения и животных, и, вероятно, является обычным механизмом, используемым клетками, чтобы сконцентрировать интенсивный синтез белков в определенных местах.
Открыто несколько различных механизмов локализации мРНК (рис. 7.104), но для них всех необходимо наличие специальных сигналов в самой мРНК. Эти сигналы обычно сосредоточены в 3′-нетранслируемой области (UTR; untranslated region) — области РНК, которая тянется от стоп-кодона, терминирующего синтез белка, до начала поли-A хвоста (рис. 7.105). Такая локализация мРНК обычно сопряжена с механизмами контроля трансляции, чтобы гарантировать, что мРНК останется неактивной, пока не попадет на свое место.
Яйцо дрозофилы представляет особенно яркий пример локализации РНК. Локализация мРНК, кодирующей регуляторный белок bicoid, происходит путем прикрепления ее к цитоскелету на переднем конце развивающегося яйца. Когда оплодотворение запускает трансляцию этой мРНК, то создается градиент концентрации белка bicoid, играющего ключевую роль в направлении развития передней части эмбриона (показано на рис. 7.53 и более подробно обсуждается в главе 22). Многие мРНК в соматических клетках локализуются похожим способом. Например,
вфибробластах млекопитающих мРНК, кодирующая актин, посредством сигнала
в3′-UTR располагается в богатом актиновыми филаментами кортексе клетки.
Вглаве 6 упоминалось, что молекулы мРНК, выходя из ядра, несут многочисленные метки в виде модификаций РНК (5′-кэп и 3′-поли-A хвост) и связанных белков (например, комплексов соединения экзонов), отмечающих успешное завершение различных этапов процессинга пре-мРНК. Только что было описано, что 3′-UTR мРНК можно рассматривать как «почтовый индекс», направляющий мРНК в различные места в клетке. Ниже мы также увидим, что мРНК несут информацию, устанавливающую их среднюю продолжительность жизни в цито-


Глава 7. Контроль генной экспрессии 753
Рис. 7.105. Опыт, показывающий значение 3'- UTRдлялокализациимРНКвопределенныхоб-
ластяхцитоплазмы.Дляэтогоопытабылиподготовленыдверазныефлуоресцентномеченые молекулыРНКпутемпроведениятранскрипции ДНК in vitro в присутствии флуоресцентно меченых производных UTP. Одна РНК (меченная красным флуорохромом) содержит кодирующую область белка Hairy (волосатости) дрозофилы вместе со смежной 3'-UTR (см. рис. 6.22). ДругаяРНК(меченнаязеленымфлуорохромом) содержиткодирующуюобластьбелкаHairyбез 3'-UTR. Две РНК смешали и ввели в эмбрион дрозофилы на стадии развития, при которой множествоядернаходитсявобщейцитоплазме (см.рис.7.53).Когдаспустя10минутвизуализировалифлуоресцентныеРНК,полнаяРНКбелка Hairy(красная)располагаласьнапереднейсторонеядер(голубые),алокализациитранскрип-
та без 3'-UTR (зеленый), не произошло. Белок 
 Hairy является одним из многих регуляторных
Hairy является одним из многих регуляторных 
 белков, определяющих позиционную информацию в развивающемся эмбрионе дрозофилы (описано в главе 22). Считается, что локализация его
белков, определяющих позиционную информацию в развивающемся эмбрионе дрозофилы (описано в главе 22). Считается, что локализация его
мРНК (в этом опыте показано, что она зависит от 3'-UTR) критична для нормального развития мухи. (С
любезногоразрешенияSimonBullockиDavidIsh-Horowicz.)
этапа, инициирующего трансляцию. Детали инициации трансляции у эукариот и у бактерий разнятся (как видно из главы 6), но они используют несколько одинаковых основных механизмов регуляции.
В мРНК бактерий консервативный участок из шести нуклеотидов, последо- вательность Шайна – Дальгарно, всегда находится на несколько нуклеотидов впереди инициирующего кодона AUG. Эта последовательность спаривается с 16S РНК малой субчастицы рибосомы, правильно располагая инициирующий кодон AUG в рибосоме. Поскольку такое взаимодействие вносит значительный вклад в эффективность инициации, то оно предоставляет бактериальной клетке простой способ регулирования синтез белка при помощи механизмов контроля трансляции (translational control). Такие механизмы, осуществляемые белками или молекулами РНК, в основном, включают в себя или раскрытие, или блокирование последовательности Шайна – Дальгарно (рис. 7.106).
Эукариотические мРНК не содержат последовательности Шайна – Дальгарно. Вместо этого, как описано в главе 6, выбор кодона AUG как сайта начала транскрипции во многом определяется его близостью к кэп-структуре на 5′-конце молекулы мРНК — участке, где малая рибосомная субчастица связывается с мРНК иначинает поиск инициирующего кодона AUG. Несмотря на существенные различия в инициации трансляции, эукариоты используют сходные стратегии для регуляции трансляции. Например, репрессоры трансляции связываются с 5′ концом мРНК и тем самым ингибируют инициацию трансляции. Другие репрессоры распознают нуклеотидные последовательности в 3′-UTR специфических молекул мРНК и снижают интенсивность инициации трансляции, препятствуя коммуникации между

Глава 7. Контроль генной экспрессии 755
7.5.11. Фосфорилирование фактора инициации трансляции позволяет глобально регулировать синтез белка
Эукариотические клетки понижают общую скорость синтеза белка в ответ на различные стрессовые ситуации, включая недостаток факторов роста и питательных веществ, заражение вирусами и внезапное повышение температуры. Во многом это снижение вызвано фосфорилированием специфическими протеинкиназами, реагирующими на изменение условий, фактора инициации трансляции eIF2.
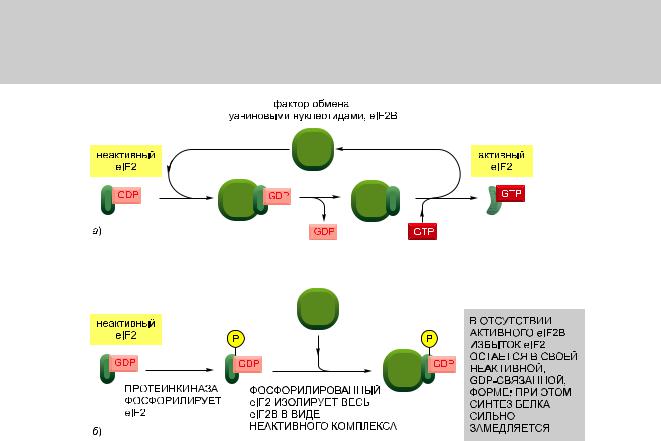
Нормальная функция eIF2 была описана в общих чертах в главе 6. Он образует комплекс с GTP и опосредует связывание инициаторной метионил-тРНК с малой субчастицей рибосомы, которая затем связывается с 5′-концом мРНК и начинает поиск старт-кодона по всей мРНК. После распознавания кодона AUG белок eIF2 гидролизует связанный GTP до GDP, что приводит к конформационному изменению белка и его освобождению от малой субчастиц рибосомы. Далее большая субчастицы рибосомы присоединяется к малой субчастице, и образуется полная рибосома, которая начинает синтез белка (см. рис. 6.71).
Поскольку eIF2 очень прочно связывается с GDP, то необходим фактор обмена гуаниновыми нуклеотидами (см. рис. 3.73), обозначаемый eIF2B, для высвобождения GDP — чтобы новая молекула GTP могла связаться и реализовалась возможность повторного использования eIF2 (рис. 7.107, а). Если eIF2 фосфорилирован, то его повторное использование невозможно: фосфорилированный eIF2 необычайно прочно связывается с eIF2B, тем самым инактивируя его. В клетке содержится больше eIF2, чем eIF2B, и всего лишь часть фосфорилированного eIF2 может связать почти весь eIF2B. Это препятствует повторному использованию нефосфорилированного eIF2 и значительно замедляет процесс синтеза белка (рис. 7.107, б)
Регулирование концентрации активного eIF2 особенно важно в клетках млекопитающих, где eIF2 является частью механизма, позволяющего клеткам вступать в непролиферирующую стадию покоя (называется Go), в которой скорость общего синтеза белка снижена до примерно одной пятой от скорости в пролиферирующих клетках (описано в главе 17).
7.5.12. Инициация, происходящая на кодонах AUG, расположенных перед сайтом начала трансляции, может регулировать инициацию трансляции у эукариот
В главе 6 говорилось, что трансляция у эукариот обычно начинается с первого кодона AUG с 5′-конца мРНК — с первого кодона AUG, который встречает малая субчастица рибосомы при поиске старт-кодона на мРНК. Однако нуклеотиды, непосредственно окружающие AUG, также влияют на эффективность инициации трансляции. Если участок распознавания достаточно слабый, сканирующие рибосомные субчастицы будут иногда пропускать первый кодон AUG на мРНК и, вместо этого, перепрыгивать на второй или третий кодон AUG. Этот явление, известное как «ослабленное сканирование» (leaky scanning) ,— стратегия, часто используемая для образования с одной мРНК двух или более близкородственных белков, которые различаются только по своим аминоконцам. Очень важно, что это позволяет некоторым генам образовывать один и тот же белок с сигнальной последовательностью и без нее на аминоконце, так что белок направляется в два разных места в клетке (например, как в митохондрии, так и в цитозоль). В некоторых случаях клетка может регулировать относительное содержание изоформ белка, получаемых с по-

Глава 7. Контроль генной экспрессии 757
специфических мРНК, содержащих uORF. Например, это может давать возможность клеткам дрожжей адаптироваться к острой нехватке отдельных питательных веществ путем выключения синтеза всех белков, кроме тех, которые необходимы для синтеза недостающих веществ. Детали этого механизма хорошо проработаны для специфической мРНК дрожжей, которая кодирует белок, называемый Gcn4. Этот белок является регуляторным белком, необходимым для активации множества генов, кодирующих важные для синтеза аминокислот белки.
Матричная РНК гена Gcn4 содержит четыре коротких uORF, которые ответственны за избирательное повышение трансляции Gcn4 в ответ на вызванное аминокислотным голоданием фосфорилирование eIF2. Механизм повышения трансляции Gcn4 сложный. В общих чертах: малая субчастица рибосомы движется вдоль мРНК, встречая каждый из uORF, но направляя трансляцию только подгруппы из них; если происходит трансляция последнего uORF, как и в случае нормальных, неголодающих клеток, то рибосомы диссоциируют на конце uORF и трансляция Gcn4 оказывается неэффективной. Глобальное понижение активности eIF2, вызванное недостатком питательных веществ (см. рис. 7.108), повышает вероятность того, что сканирующая малая субчастица рибосомы пройдет четвертую uORF до того, как встретится с молекулой eIF2 (см. рис. 6.72). Такая субчастица рибосомы может свободно инициировать трансляцию на фактических последовательностях Gcn4, и происходящее в результате увеличение количества этого регуляторного белка приводит к образованию набора белков, усиливающих синтез аминокислот внутри клетки.
7.5.13. Участок внутренней посадки рибосомы предоставляет возможность регулировать трансляцию
Трансляция примерно 90 % эукариотических мРНК начинается с первого после 5′-кэпа кодона AUG, но определенные AUG-кодоны, как отмечалось в предыдущем разделе, могут пропускаться во время процесса сканирования. В этом разделе обсуждается еще один способ, с помощью которого клетки могут инициировать трансляцию на участках, удаленных от 5′-конца мРНК, используя специализированный тип последовательности РНК, называемый участком вну-
тренней посадки рибосомы (internal ribosome entry site, IRES). Последователь-
ность IRES может встречаться на множестве различных мест мРНК. В некоторых редких случаях мРНК содержит две находящиеся вместе разные кодирующие белок последовательности, и трансляция первой последовательности происходит благодаря обычному механизму сканирования, а трансляция второй – посредством IRES. Последовательности IRES обычно имеют длину в несколько сотен нуклеотидов и сворачиваются в специфические структуры, которые связывают многие, но не все, из тех же самых белков, которые используются для инициации нормальной кэп-зависимой трансляции (рис. 7.108). В действительности для различных IRES требуются различные подгруппы факторов инициации. Однако все они обходятся без 5′-кэпа и фактора инициации трансляции eIF4E, который его распознает.
Некоторые вирусы используют IRES как часть своей стратегии, чтобы осуществлять трансляцию своих молекул мРНК, при этом блокируя нормальную кэп-зависимую трансляцию мРНК хозяина. При заражении эти вирусы образуют протеазу (закодированную в вирусном геноме), которая расщепляет фактор трансляции eIF4G клетки хозяина, делая его не способным связываться с eIF4E, кэп-
