
- •Лабораторная работа №1. Броуновское движение
- •1. Цель работы
- •2. Вопросы, знание которых обязательно для допуска к выполнению работы
- •3. Сведения из теории
- •Описание установки
- •1) Настройка микроскопа и определение увеличения установки
- •2) Подготовка препарата с броуновскими частицами
- •3) Наблюдение броуновского движения
- •4. Задания по обработке результатов и указания к их выполнению.
- •5. К оценке погрешностей
- •6. Для получения зачета необходимо:
- •Лабораторная работа №2. Измерение коэффициента диффузии паров в воздухе
- •1. Цель работы
- •2. Вопросы, знание которых обязательно для допуска к выполнению
- •3. Сведения из теории
- •Принцип измерения коэффициента диффузии пара в воздухе
- •4. Практические задания
- •Порядок выполнения работы
- •5. Для получения зачета необходимо:
- •Методы определения коэффициента динамической вязкости жидких и газообразных веществ
- •4. Практические задания
- •4. Порядок выполнения работы
- •3. Сведения из теории
- •4. Порядок выполнения работы
- •5. Практические задания
- •6. Для получения зачета необходимо:
- •Лабораторная работа №6. Поверхностное натяжение
- •1. Цель работы
- •2. Вопросы, знание которых обязательно для допуска к выполнению
- •3. Сведения из теории
- •1) Метод отрыва кольца
- •2) Метод отрыва капель
- •3) Метод измерения по добавочному давлению Лапласа
- •4) Метод измерения , основанный на капиллярных явлениях.
- •4. Задания и порядок их выполнения
- •5. Для получения зачета необходимо:
- •Часть 2. Плавка метала.
- •4. Задания и порядок их выполнения.
- •5. Для получения зачета необходимо:
- •4. Экспериментальные задания
- •5. Для получения зачета необходимо:
4. Порядок выполнения работы
Определить
коэффициент вязкости глицерина при
комнатной температуре, измерив время
вытекания
![]() объема
объема![]() через капилляр вискозиметра.
через капилляр вискозиметра.
Получить температурную
зависимость
![]() ,
измерив время вытекания объема глицерина
,
измерив время вытекания объема глицерина![]() через капилляр вискозиметра при различных
температурах в интервале
через капилляр вискозиметра при различных
температурах в интервале![]()
![]() .
.
Построить зависимость
![]() и определить энергию активации перескока
и определить энергию активации перескока![]() ,
частоту колебаний молекулы глицерина
около положения равновесия
,
частоту колебаний молекулы глицерина
около положения равновесия![]() и частоту скачков
и частоту скачков![]() .
.
5. Для получения зачета необходимо:
Уметь отвечать на вопросы типа:
1) Как вязкость жидкости зависит от температуры;
2) В чем отличие механизмов вязкого течения жидкостей и газов.
Лабораторная работа № 5. Изопроцессы в
газе. Измерение отношения
![]()
1. Цель работы
Познакомиться с методом Клемана-Дезорма
определения
![]() .
На примере этой работы практически
познакомиться с некоторыми процессами
в газе. Научиться графически изображать
процессы в газе с соблюдением масштабов.
.
На примере этой работы практически
познакомиться с некоторыми процессами
в газе. Научиться графически изображать
процессы в газе с соблюдением масштабов.
2. Вопросы, знание которых обязательно для допуска к выполнению
1) Что называется теплоемкостью системы?
2) Удельная теплоемкость вещества.
3) Изохронная, изобарная молярная теплоемкости газа и их связь.
4) Теоретическое
значение
![]() для одноатомных и двухатомных газов.
для одноатомных и двухатомных газов.
5) Как связаны теплоемкость при постоянном объеме и внутренняя энергия газа?
6) Чему равна теплоемкость газа при постоянной температуре?
7) Изохорический, изотермический, изобарический процессы в газах. Их уравнения.
8) 1 начало термодинамики.
9) Адиабатический процесс в газе. Его уравнение.
10) Как изменяется температура тела при адиабатическом расширении, при адиабатическом сжатии? (уравнение адиабаты, связывающее температуру и объем).
3. Сведения из теории
Теплоемкости
различных веществ относятся к числу их
важнейших термодинамических характеристик.
В физике рассматриваются исходная
![]() и изобарная
и изобарная![]() теплоемкости. Последняя сравнительно
легко измеряется экспериментально, в
то время как измерить
теплоемкости. Последняя сравнительно
легко измеряется экспериментально, в
то время как измерить![]() сложно. Значительно проще измерить
сложно. Значительно проще измерить![]() .
Измерение
.
Измерение![]() представляет интерес еще и потому, что
само это отношение непосредственно
входит во многие уравнения термодинамики.
представляет интерес еще и потому, что
само это отношение непосредственно
входит во многие уравнения термодинамики.
Впервые величина
![]() для газов была измерена французскими
физиками Клеманом и Дезормом в 1819г.
Настоящая работа повторяет идею их
опыта. Измерение
для газов была измерена французскими
физиками Клеманом и Дезормом в 1819г.
Настоящая работа повторяет идею их
опыта. Измерение![]() предлагаемым методом основано на том,
что величина
предлагаемым методом основано на том,
что величина![]() входит в уравнение адиабаты идеального
газа
входит в уравнение адиабаты идеального
газа
![]() (уравнение
Пуассона)
(уравнение
Пуассона)
чтобы определить
![]() ,
достаточно провести адиабатный процесс
в изучаемом газе, измерить параметры
двух разных состояний, а затем из
уравнения
,
достаточно провести адиабатный процесс
в изучаемом газе, измерить параметры
двух разных состояний, а затем из
уравнения
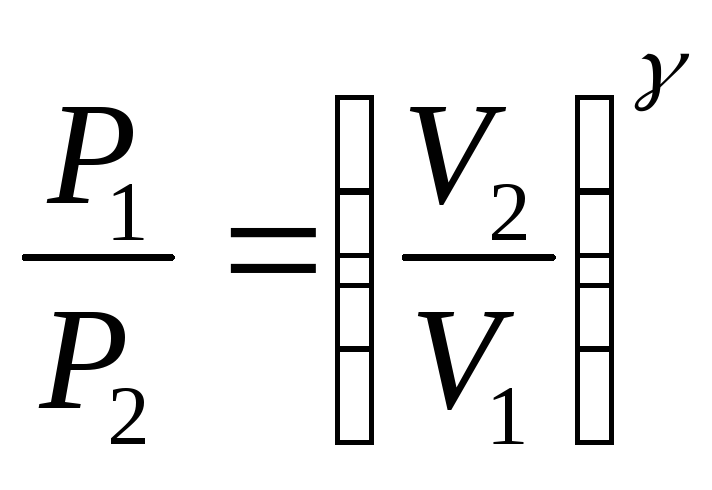 Найти
величину
Найти
величину
![]() .
.
Однако, измерить
![]() ,
объемы занимаемые моле газа в двух
различных состояниях практически
невозможно.
,
объемы занимаемые моле газа в двух
различных состояниях практически
невозможно.
В методе Клемана-Дезорма эта трудность преодолена путем проведения двух изопроцессов – адиабатного расширения газа и изохорного нагрева.
4. Порядок выполнения работы
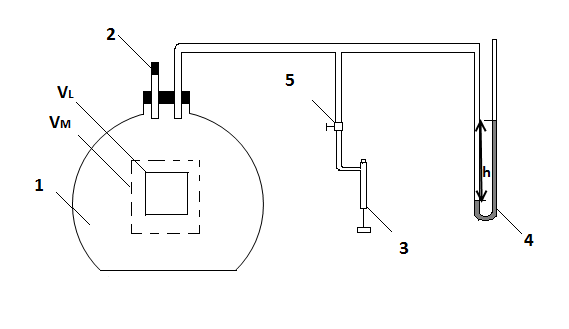
Рис.1
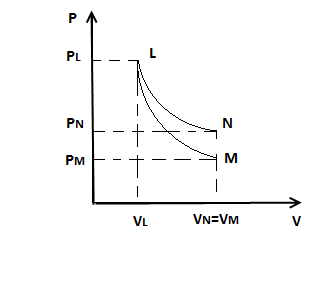
Рис.2
Экспериментальная
установка для определения
![]() воздуха изображена на рис. 1. она состоит
из бутыли большого объема
воздуха изображена на рис. 1. она состоит
из бутыли большого объема![]() ,
закрытой пробкой
,
закрытой пробкой![]() и соединенной с насосом
и соединенной с насосом![]() и жидкостным манометром
и жидкостным манометром![]() .
.
С помощью насоса
![]() накачать в бутыль
накачать в бутыль![]() при закрытой пробке
при закрытой пробке![]() некоторое дополнительное количество
газа. Давление газа в бутыли станет
больше атмосферного на
некоторое дополнительное количество
газа. Давление газа в бутыли станет
больше атмосферного на![]() .
При накачивании газа совершается работа
против сил давления газа, что приводит
к увеличению его внутренней энергии, а
следовательно и температуры. Процесс
остывания газа до комнатной температуры
путем теплообмена через стенки бутыли
происходит при постоянном объеме
.
При накачивании газа совершается работа
против сил давления газа, что приводит
к увеличению его внутренней энергии, а
следовательно и температуры. Процесс
остывания газа до комнатной температуры
путем теплообмена через стенки бутыли
происходит при постоянном объеме![]() и сопровождается понижением давления.
Установившееся в результате релаксации
температуры состояние
и сопровождается понижением давления.
Установившееся в результате релаксации
температуры состояние![]() характеризуется параметрами:
характеризуется параметрами:
![]() ;
; ![]() ;
;![]()
Где
![]() – объем моля газа, выделенный сплошной
рамкой на рис. 1.
– объем моля газа, выделенный сплошной
рамкой на рис. 1.
Открыть пробку в бутыли. Процесс выравнивания давлений займет 1-2секунды и, следовательно, процесс с достаточной точностью можно считать адиабатным.
После выравнивания давлений быстро закрыть пробку.
Газ в бутыли
перейдет в состояние
![]() ,
которое характеризуется параметрами:
,
которое характеризуется параметрами:
![]() ;
; ![]() ;
;![]()
При адиабатном
расширении произойдет некоторое
охлаждение газа в бутили. После релаксации
температуры газа в бутили к комнатной
при изохорном процессе становится
состояние
![]() ,
характеризующееся параметрами
,
характеризующееся параметрами![]() и
и![]() .
Так как в состояниях
.
Так как в состояниях![]()
![]() ,
можно сказать, что в координатах
,
можно сказать, что в координатах![]() точки, характеризующие эти состояния,
лежат на одной изотерме.
точки, характеризующие эти состояния,
лежат на одной изотерме.
Из уравнения
адиабатного процесса
![]() следует, что
следует, что
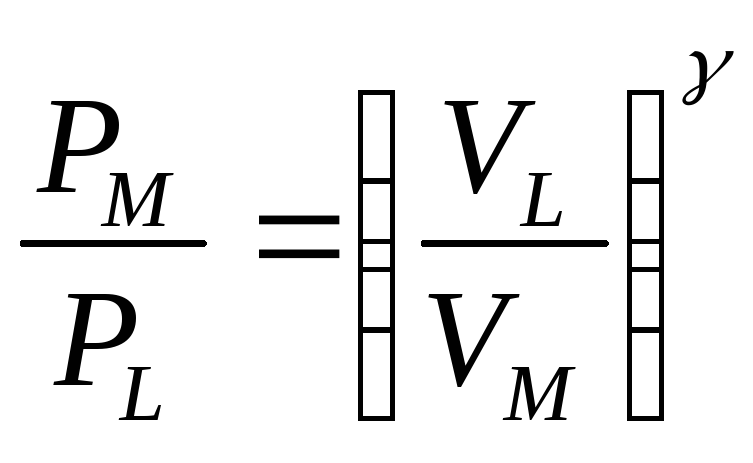
Из условий
изотермического процесса
![]() находим, что
находим, что
![]() .
.
Из условий изохорного
процесса
![]() следует, что
следует, что
![]() .
.
Из этих трех соотношений получаем:
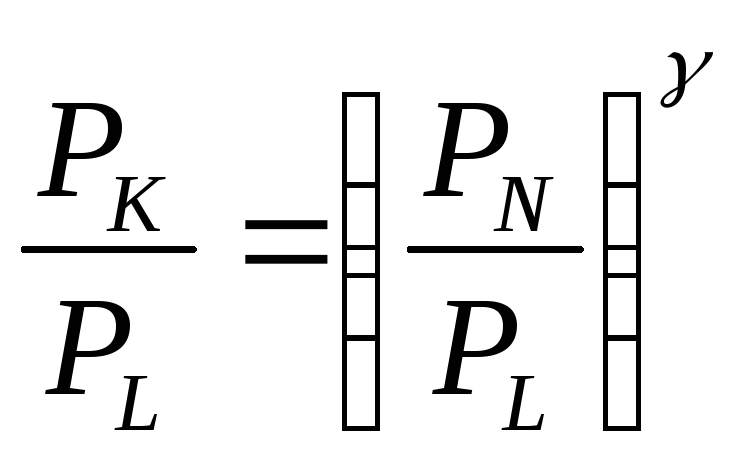 .
.
Так как
![]() ;
;![]()
вытекает
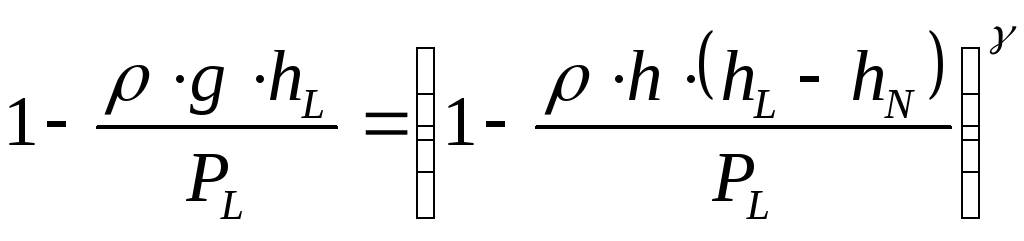 откуда
откуда
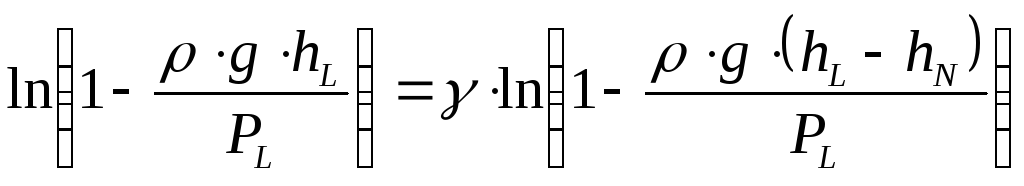 ,
,
Т.к.
![]() ,
то из условия, что при
,
то из условия, что при![]()
![]() получим:
получим:
![]() или
или
![]() .
.
Таким образом,
чтобы вычислить
![]() ,
необходимо измерить разность высот
столбов жидкости в манометре в состоянии
,
необходимо измерить разность высот
столбов жидкости в манометре в состоянии![]() .
.
Из молекулярно-кинетической
теории газов известно, что
![]() ,
а
,
а![]() ,
следовательно
,
следовательно![]() ,
где
,
где![]() – число степеней свободы молекулы. Зная
– число степеней свободы молекулы. Зная![]() ,
можно определить число степеней свободы
молекул газа и оценить степень
достоверности экспериментальных
результатов.
,
можно определить число степеней свободы
молекул газа и оценить степень
достоверности экспериментальных
результатов.
