- •4. Общие закономерности строения и химического поведения оксосоединений
- •4.1 Оксосоединения
- •3. Технические способы получения формальдегида
- •3.1 Каталитическое окисление метанола:
- •3.2 Каталитическое окисление метана:
- •11. Специфические методы для ароматического ряда
- •1. Реакции нуклеофильного присоединения
- •1.1 Присоединение магнийалкилов:
- •2.1 Образование иминов и оксимов:
- •2.2 Образование гидразонов:
- •5. Реакции окисления альдегидов и кетонов
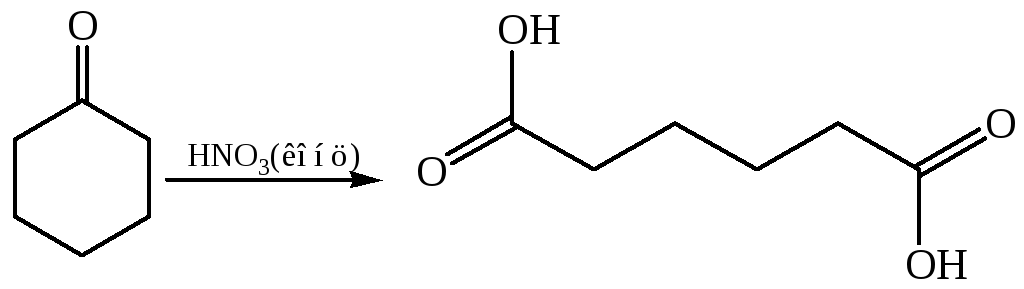
- •5.2.1 Окисление циклических кетонов:
- •6. Реакции окисления-восстановления (диспропорционирования)
- •8.4.1 Синтез коричного альдегида:
- •8.4.2 Синтез бензаль- и дибензальацетона:
- •4.2 Карбоновые кислоты и их производные
- •4.2.1 Монокарбоновые кислоты
- •1. Реакции карбоновых кислот с нуклеофильными реагентами
- •4. Реакции α-водородного атома
- •4.2.2 Производные карбоновых кислот
- •1. Взаимодействие с хлоридом фосфора (V):
- •2. Взаимодействие с тионилхлоридом:
- •1. Гидролиз:
- •1. Ацилирование аммиака:
- •1.1 Щелочной гидролиз:
- •1.2 Кислотный гидролиз:
- •3. Реакция аммонолиза:
- •4.2.3 Дикарбоновые кислоты
- •4.2.4 Непредельные карбоновые кислоты
- •4.2.4.1 Одноосновные кислоты этиленового ряда
- •2. Гидролиз акрилонитрила:
- •1. Из ацетона и синильной кислоты:
- •4.2.4.2 Непредельные дикарбоновые кислоты
- •4.2.5 Жиры
- •Особенности физических свойств гомо-функциональных производных углеводородов
- •Экологические проблемы производства и применения гомофункциональных производных углеводородов
5. Реакции окисления альдегидов и кетонов
5.1 Окисление альдегидов. Альдегиды окисляются наиболее легко, превращаясь в карбоновые кислоты с тем же числом атомов углерода в цепи:

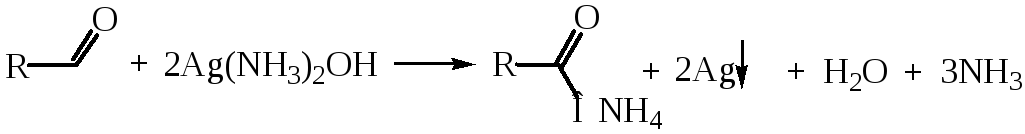
Для окисления альдегидов могут быть использованы не только обычные окислительные реагенты (КМnO4, СrО3), но и такие мягкие окислители, как [Ag(NH3)2]OH, Cu(OH)2.
5.1.1
5.1.2

В этих реакциях альдегиды выступают в качестве восстановителей, восстанавливая ион серебра до металлического серебра (реакция «серебряного зеркала») и ион Сu2+ до оксида меди (I) Сu2О красного цвета. Обе реакции известны как качественные пробы на альдегидную группу.
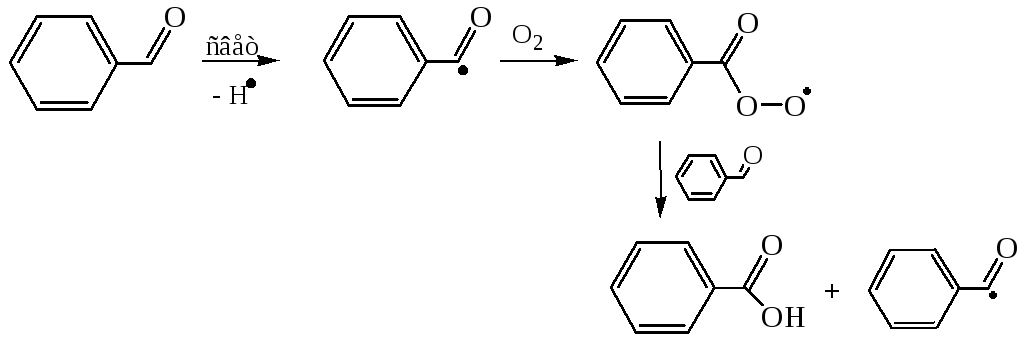
5.1.3 Окисление ароматических альдегидов. В отличие от алифатических, очень легко окисляются кислородом воздуха на свету через стадию образования стабильного ароильного радикала:
5.2 Окисление кетонов требует более жестких условий и окислителей, например, хромовая смесь, щелочной раствор перманганата калия. В кислой или щелочной среде происходит енолизация кетона, а затем окисление с разрывом кратной связи енола. Поскольку у кетонов переход в енольную форму возможен по двум направлениям, то в результате окисления происходит разрыв связей С–С по обе стороны от кетонной группы (окислительное расщепление) Это приводит у несимметричных кетонов к образованию смеси четырех карбоновых кислот с меньшим числом атомов углерода:
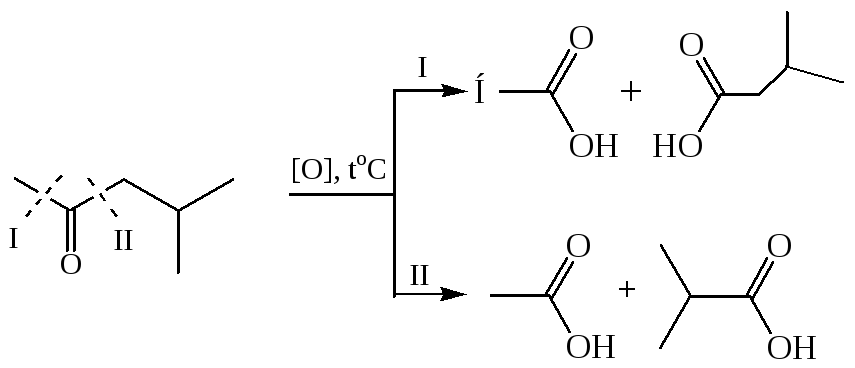
5.2.1 Окисление циклических кетонов:
5.2.2 Окисление по α-положению. При этом не затрагиваются альдегидная группа и не разрушается связи С–С у кетонов. Например, известно, что оксид селена (IV) способен селективно окислять метальные или метиленовые группы, связанные с карбонилом, образуя α-кетоальдегиды или α-дикетоны:
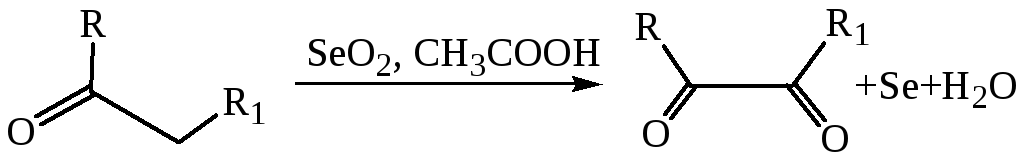
6. Реакции окисления-восстановления (диспропорционирования)
6.1 Реакция Канниццаро (1853 г.) характерна для альдегидов, не содержащих в α-положении водородных атомов, и происходит при их обработке концентрированными растворами щелочей. Если в α-положении имеются водородные атомы, то при обработке карбонильного соединения раствором щелочи протекает более быстрая реакция альдольной конденсации (п. 8.2), сопровождающаяся процессами олигомеризации и осмоления.
Реакция Канниццаро – окислительно-восстановительный процесс (диспропорционирование), протекающий под действием концентрированного водного или водно-спиртового раствора щелочи при слабом нагревании в присутствии катализаторов (Со, Ni, Аg, Сu или их оксидов:
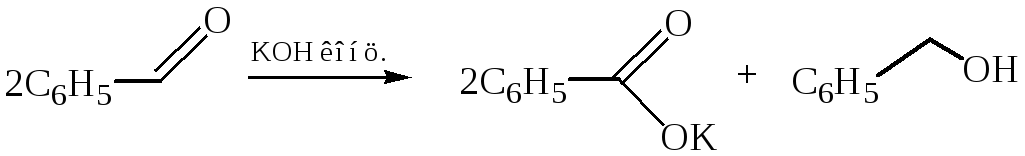
Поскольку реакция происходит в щелочной среде, то конечными продуктами превращения являются соль кислоты и спирт.
Механизм реакции Канниццаро:

Ключевой стадией этого процесса является II стадия – передача гидрид-иона. Роль щелочи заключается в переводе альдегида в анион гидратной формы путем присоединения ОН-аниона как нуклеофила к карбонильной группе (I стадия). Образовавшийся анион имеет возможность передать гидрид-ион другой молекуле, поскольку при этом возникает стабильная молекула кислоты (II стадия). Реакция завершается быстрым обменом протона (III стадия). Движущей силой этой реакции является образование сопряженного карбоксилат-иона.
В реакцию Канниццаро могут вступать и два различных альдегида. В этом случае ее называют перекрестной. Если в реакции принимают участие два альдегида с приблизительно одинаковой реакционной способностью, то в результате получается смесь четырех продуктов – два спирта и соли двух кислот. Если же активность различна, то альдегид, более активный в АN реакциях, активируется щелочью и затем передает гидрид-ион второму альдегиду. Поэтому в результате реакции образуются два продукта – соль кислоты из более активного альдегида и спирт, например:
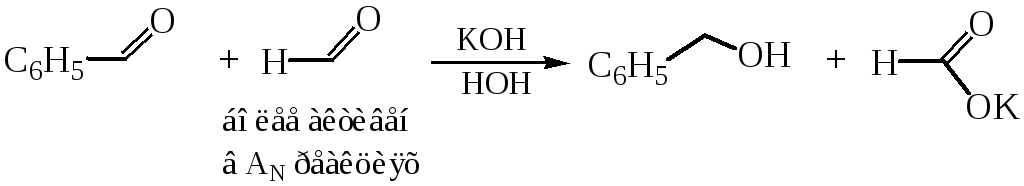
6.2 Реакция Тищенко (1906 г.). В эту реакцию вступают только альдегиды, образуя под действием каталитических количеств этилата алюминия сложный эфир – продукт взаимодействия кислоты и спирта:
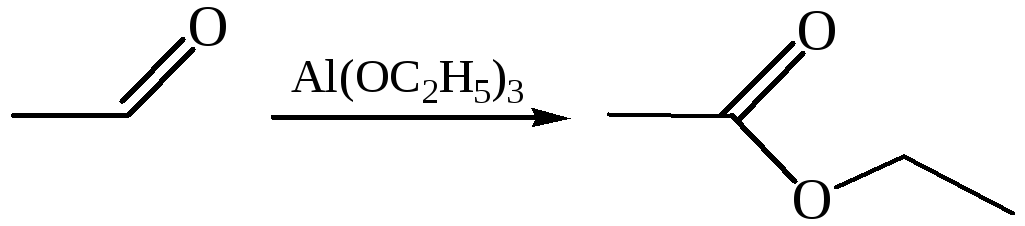
Реакция также протекает с переносом гидрид-иона от одной молекулы альдегида к другой под действием алкоголята алюминия:
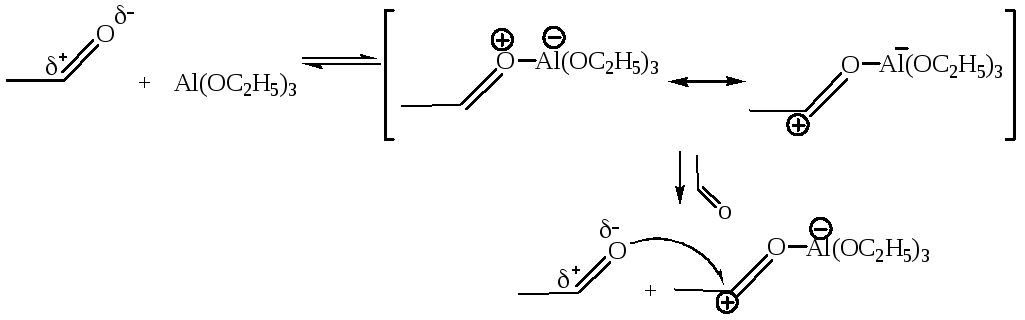
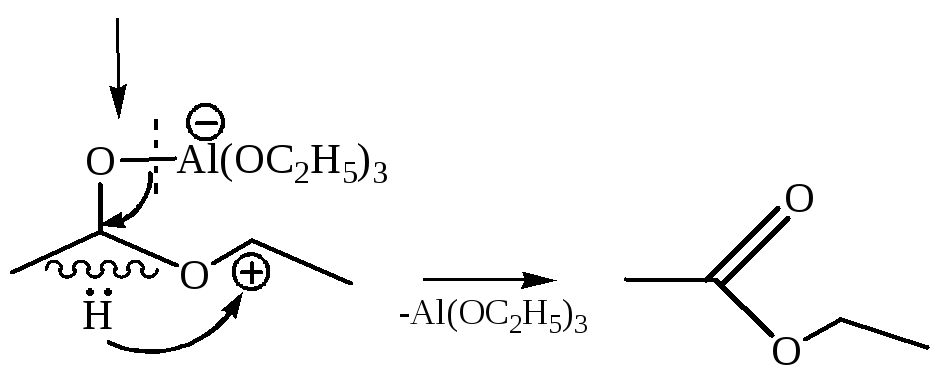
Несмотря на наличие водорода в α-положении, альдольная конденсация здесь не протекает, так как алкоголяты алюминия слабые основания, не способные отщеплять протон в α-положении к карбонилу.
Реакцию Тищенко проводят в отсутствие воды и спирта. Наличие воды в реакционной смеси приведет к гидролизу алкоголята и сложного эфира, а в присутствии спирта может произойти реакция Меервейна-Понндорфа.
6.3 Реакция Меервейна–Понндорфа (1925 г.). Классическим примером данной реакции является взаимодействие кетонов с изопропилатом алюминия в изопропиловом спирте:
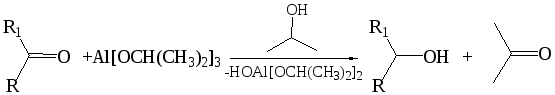
Источником гидрид-иона в этом процессе является изопропилат алюминия. На первой стадии имеет место ассоциация кетона с алкоголятом алюминия как кислотой Льюиса. Связь С=О еще более поляризуется, и затем происходит перенос гидрид-иона в циклическом (шестичленном) переходном состоянии:
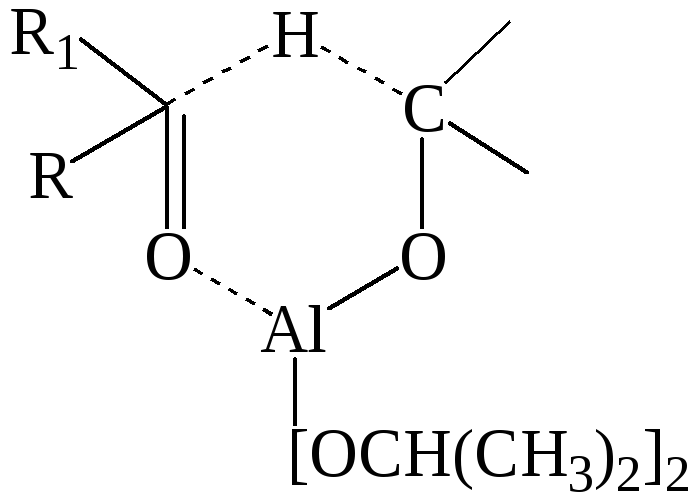
Образовавшийся смешанный алкоголят затем разрушается с образованием спирта – конечного продукта восстановления кетона.
7. Полимеризация альдегидов. Благодаря π-связи карбонильные соединения должны проявлять склонность к реакциям полимеризации с образованием гетероцепных полимеров, в полимерной цепи которых кроме атомов углерода находятся другие атомы – атомы кислорода. Молекулы альдегидов, таких, как формальдегид и ацетальдегид, способны к полимеризации с образованием циклических и линейных полимеров.
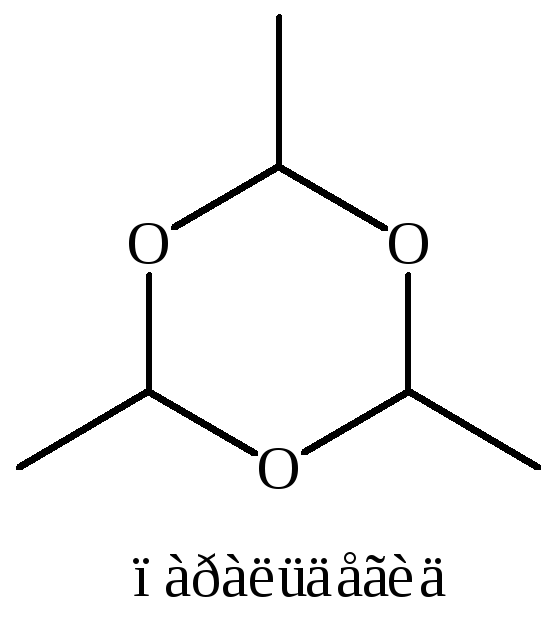
7.1 Полимеризация формальдегида до циклического ацеталя – триоксиметилена (триоксана) – при температуре ниже 80 °С:

Циклоолигомеризация формальдегида протекает специфично. Например, в присутствии серной кислоты образуется не тример, а тетрамер (тетраоксиметилен), в основе молекулы которого лежит восьмичленный цикл.
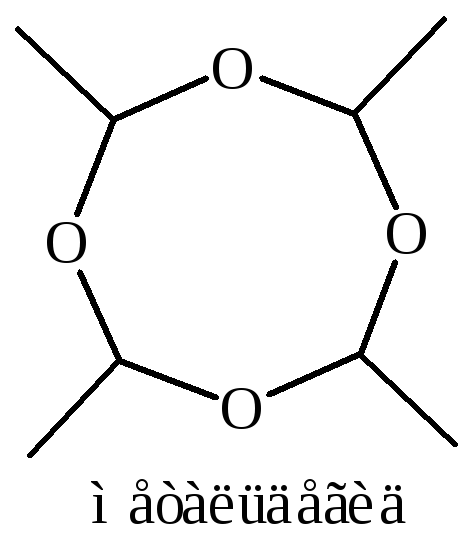
7.2 Полимеризация ацетальдегида в присутствии сильных кислот при 20 °С с образованием паральдегида (тример), а при 0 °С – метальдегида (тетрамер):
|
|
|
Оба соединения деполимеризуются при нагревании с серной кислотой. Паральдегид используется как снотворное, а метальдегид – в качестве средства для борьбы с улитками, а также как сухое топливо.
8. Реакции с участием α-водородных атомов. Енолизация, кетоенолъная таутомерия. Карбонильная группа альдегидов и кетонов оказывает сильное электроноакцепторное влияние на соседние с ней атомы углерода. Это обуславливает высокую подвижность атома водорода при α-углеродном атоме и возможность его миграции к атому кислорода карбонильной группы. Образующиеся при этом непредельные спирты называются енолами, а сам процесс – енолизацией. Енолизация карбонильных соединений обратима:

Такие взаимопревращения могут катализироваться как кислотами, так и основаниями. В случае простых альдегидов и кетонов равновесие сильно сдвинуто в сторону образования кето-формы, что связано с величиной энергии соответствующих связей в кето- (С–Н; С–С и С=О) и енольной формах (С=С; С–О и О–Н). Суммарная энергия трех первых связей составляет приблизительно 360 ккал/моль, а других трех связей – 345 ккал/моль. Таким образом, кето-форма более устойчива, чем енольная.
8.1 Галогенирование карбонильных соединений. Альдегиды и кетоны, имеющие подвижный атом водорода при α-углеродном атоме, легко вступают в реакции галогенирования в присутствии как кислот, так и оснований:
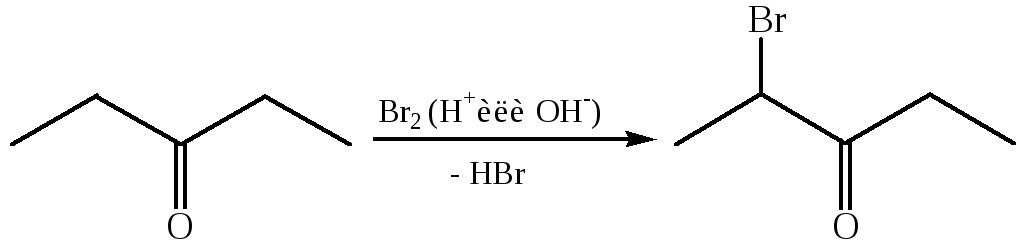
При кислотном катализе происходит протонирование карбонильной группы. В образующемся полярном аддукте происходит депротонирование С–Н связи при α-углеродном атоме и образование енола:

В дальнейшем осуществляется взаимодействие енольной формы кетона с галогеном, имеющее общие черты с электрофильным присоединением галогена к алкенам:

В присутствии сильного основания кето-форма карбонильного соединения депротонируется по α-углеродному атому с образованием резонансно-сопряженного енолят-иона, который вследствие высокой нуклеофильности быстро взаимодействует с молекулой галогена:
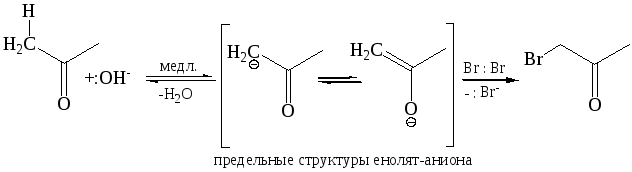
![]()
Скорость реакции галогенирования альдегидов и кетонов зависит не от вида галогена, а только от вида и количества катализатора, определяющего лимитирующую стадию процесса – образование енола или енолят-аниона, которые затем быстро атакуются реагентом.
8.2 Альдольная и кротоновая конденсация заключается в самоконденсации альдегидов и кетонов и протекает в очень мягких условиях. Катализаторами процесса могут быть как основания, так и кислоты Однако чаще всего проводят конденсацию в щелочной среде (NаОН, Na2СО3, К2СО3, Ва(ОН)2). Под влиянием разбавленного основания две молекулы оксосоединения могут вступать в реакцию конденсации с образованием β-гидроксиальдегида (альдоля) или β-гидроксикетона.
8.2.1 Образование простейшего альдоля из уксусного альдегида впервые наблюдал в 1872 г. русский химик и композитор А. П. Бородин:
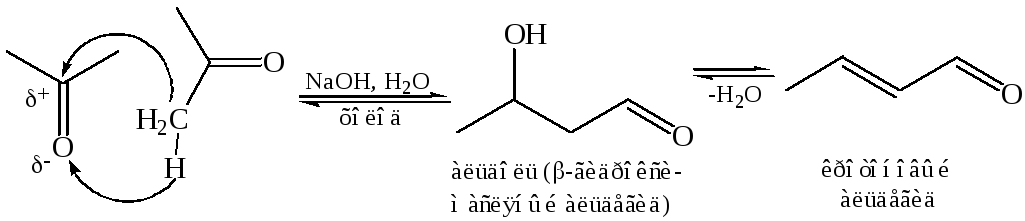
При нагревании альдоль легко отщепляет воду, что приводит к образованию α, β-непредельного соединения. В случае реакции Бородина образуется кротоновый альдегид, имеющий сопряженную систему связей. Поэтому часто этот процесс называют кротонизацией, а реакцию в целом – альдольно-кротоновой конденсацией.
По механизму альдольная конденсация может быть отнесена к АN реакциям, причем одна молекула альдегида выступает в роли карбонильной, а другая – в роли метиленовой компоненты. Механизм альдольной конденсации складывается из следующих стадий:
I стадия – активация реагента, образование активного карбаниона:
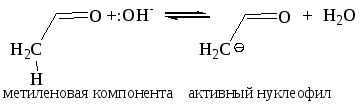
II стадия – АN реакция по карбонильному углероду с образованием связи С–С:
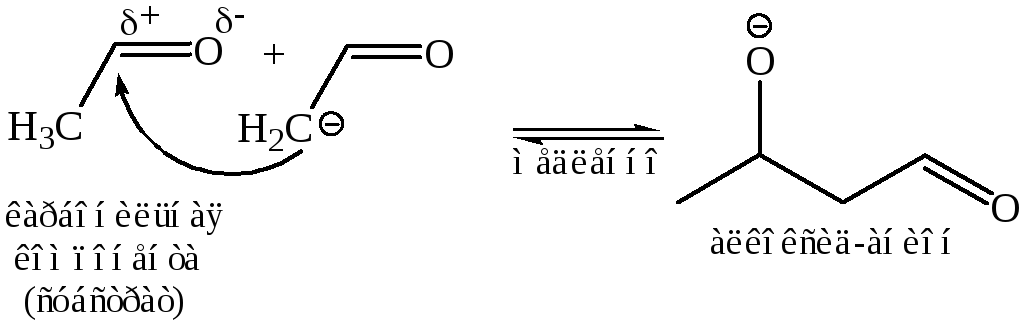
III стадия – протонирование алкоксид-иона и регенерация катализатора:

Последняя стадия протекает легко, так как алкоксид-ион – более сильное основание, чем гидроксид-ион.
Альдольная конденсация – обратимая реакция, обратный процесс превращения альдоля в исходное карбонильное соединение носит название ретроальдольного распада который примечателен тем, что в результате происходит катализируемый основанием разрыв связи С–С.
8.2.2 Альдольная конденсация кетонов. Кетоны труднее вступают в реакцию конденсации из-за совместного действия электронного и пространственного факторов. Реакция катализируется менее растворимыми в воде основаниями Ва(ОН)2, Аl(ОН)3, для проведения реакции требуется более высокая температура:

8.2.3 Смешанная альдольная конденсация между различными оксосоединениями, особенно в тех случаях, когда одна молекула карбонильного соединения не имеет α-Н-атома и может выступать поэтому только в качестве карбонильной компоненты, например:

При кислотном катализе механизм альдольной конденсации иной. Под действием протона одна молекула (карбонильная компонента) оксосоединения превращается в карбокатион, а другая (метиленовая компонента) – в енол, после чего следует стадия присоединения:
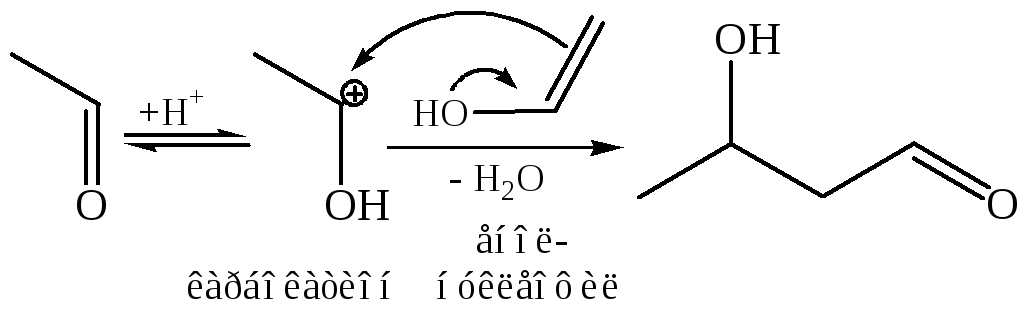
Альдоль в кислой среде быстро превращается в α, β-непредельное соединение, поскольку протон катализирует и реакцию дегидратации спиртов.
8.2.4 Кротоновая конденсация – взаимодействие двух молекул карбонильного соединения друг с другом в присутствии оснований или кислот, сопровождающееся отщеплением воды и образованием непредельного карбонильного соединения.
Основной катализ обычно осуществляется при нагревании. Катализатор сначала обеспечивает образование альдоля, а затем его протонирование по α-углеродному по отношению к карбонильной группе атому (гиперконъюгация). На завершающей стадии процесса происходит отщепление гидроксид-аниона:

Кротоновая конденсация широко используется для синтеза непредельных альдегидов и кетонов, в частности для промышленного синтеза кротонового альдегида.
8.3 Реакция Перкина (1868 г.). В эту реакцию вступают ароматические альдегиды (карбонильная компонента) и ангидриды карбоновых кислот (метиленовая компонента) Процесс протекает по типу альдольной конденсации. Промежуточные аддукты легко дегидратируются с образованием α, β-непредельных соединений. В качестве катализатора используют ацетат или карбонат натрия (калия), анион которых выступает в роли мягкого основания, активирующего метиленовую компоненту. Реакцию проводят при длительном и сильном нагревании, что исключает возможность использования алифатических альдегидов:
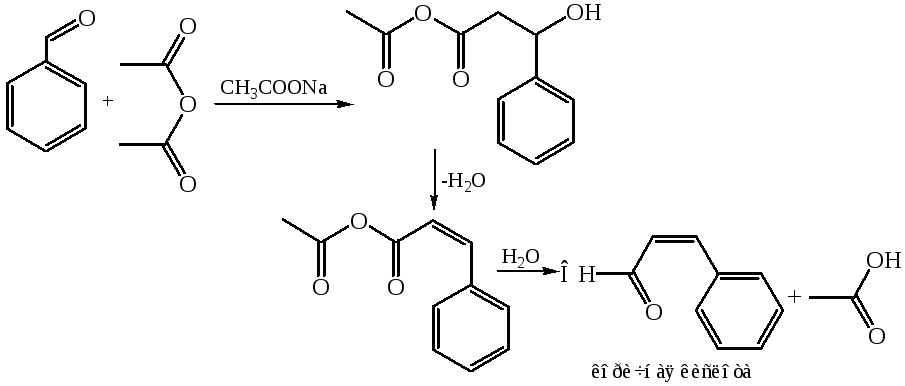
8.4 Коденсация Кляйзена-Шмидта (1881 г.). Реакция является одним из важнейших вариантов смешанной конденсации. В качестве карбонильной компоненты в этом случае используются ароматические альдегиды, а в роли метиленовой компоненты – алифатические альдегиды и кетоны.