- •4. Общие закономерности строения и химического поведения оксосоединений
- •4.1 Оксосоединения
- •3. Технические способы получения формальдегида
- •3.1 Каталитическое окисление метанола:
- •3.2 Каталитическое окисление метана:
- •11. Специфические методы для ароматического ряда
- •1. Реакции нуклеофильного присоединения
- •1.1 Присоединение магнийалкилов:
- •2.1 Образование иминов и оксимов:
- •2.2 Образование гидразонов:
- •5. Реакции окисления альдегидов и кетонов
- •5.2.1 Окисление циклических кетонов:
- •6. Реакции окисления-восстановления (диспропорционирования)
- •8.4.1 Синтез коричного альдегида:
- •8.4.2 Синтез бензаль- и дибензальацетона:
- •4.2 Карбоновые кислоты и их производные
- •4.2.1 Монокарбоновые кислоты
- •1. Реакции карбоновых кислот с нуклеофильными реагентами
- •4. Реакции α-водородного атома
- •4.2.2 Производные карбоновых кислот
- •1. Взаимодействие с хлоридом фосфора (V):
- •2. Взаимодействие с тионилхлоридом:
- •1. Гидролиз:
- •1. Ацилирование аммиака:
- •1.1 Щелочной гидролиз:
- •1.2 Кислотный гидролиз:
- •3. Реакция аммонолиза:
- •4.2.3 Дикарбоновые кислоты
- •4.2.4 Непредельные карбоновые кислоты
- •4.2.4.1 Одноосновные кислоты этиленового ряда
- •2. Гидролиз акрилонитрила:
- •1. Из ацетона и синильной кислоты:
- •4.2.4.2 Непредельные дикарбоновые кислоты
- •4.2.5 Жиры
- •Особенности физических свойств гомо-функциональных производных углеводородов
- •Экологические проблемы производства и применения гомофункциональных производных углеводородов
4. Реакции α-водородного атома
4.1 Галогенирование кислот. Подобно альдегидам и кетонам у карбоновых кислот водород у α-углеродного атома приобретает повышенную подвижность. Однако поскольку величина δ+ на атоме углерода карбоксильной группы понижена за счет +М эффекта, то влияние карбоксила на α-углеродный атом значительно меньше, чем у альдегидов и кетонов.
Благодаря подвижности атомов водорода связи Сα–Н карбоновые кислоты могут подвергаться свободнорадикальному галогенированию. Однако в этом случае вследствие высокой активности и малой избирательности атомов хлора галогенирование может происходить и по другим положениям цепи:
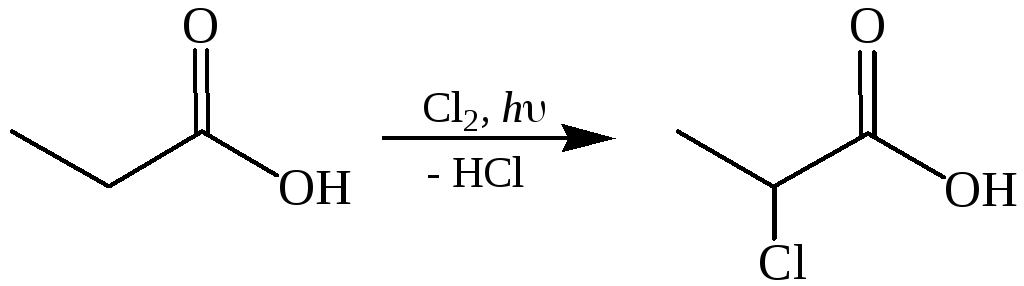
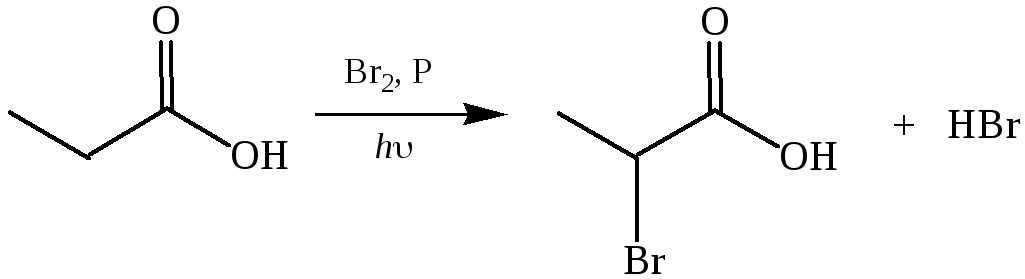
5. Реакция Геля–Фольгарда–Зелинского. Осуществляют галогеном в присутствии небольших количеств красного фосфора:
6. Реакции декарбоксилирования. Одноосновные кислоты довольно устойчивы к нагреванию. Однако если их нагревать при температуре выше 300 °С с MnO2 или ThO2, то происходит декарбоксилирование с образованием альдегидов или кетонов. Если в углеводородном остатке кислоты имеются сильные электроноакцепторные группы, то возможно довольно легкое отщепление СО2 при температурах 100–150 °С.
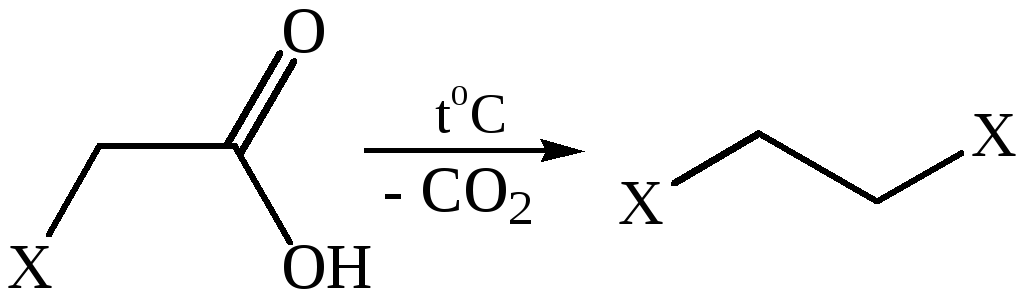
где Х= –NO2,–COOH, –C=O
6.1 Реакция Кольбе (электролиз солей карбоновых кислот, часть 1, глава 8.1).
6.2 Образование оксосоединений. При пиролизе кальциевых или бариевых солей карбоновых кислот образуются оксосоединения:
|
|
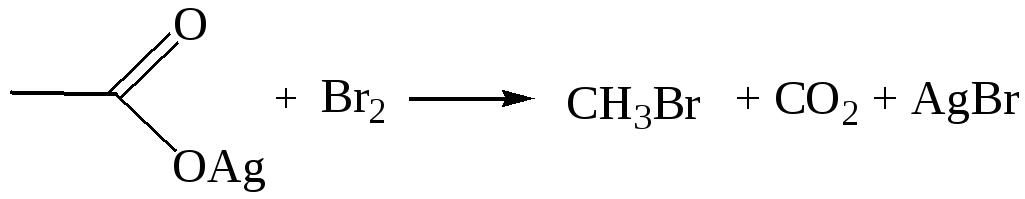
6.3. Образование галогеналканов (реакция Хунсдиккера). Декарбокси-лирование происходит также при взаимодействии серебряных или ртутных солей карбоновых кислот с йодом или бромом. Эта реакция лучше всего проходит с первичными кислотами:
|
|
Предполагают, что промежуточным продуктом является гипогалогенит, который распадается на радикалы:
|
|
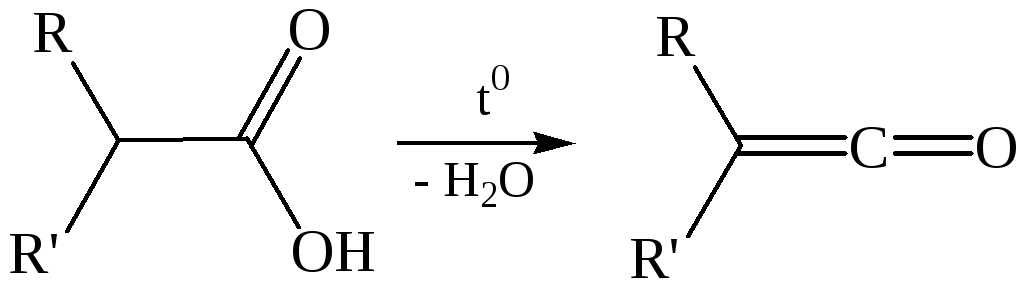
6.4. Пиролиз карбоновых кислот (образование кетенов) протекает при 700–800 °С с образованием кетенов:
|
|
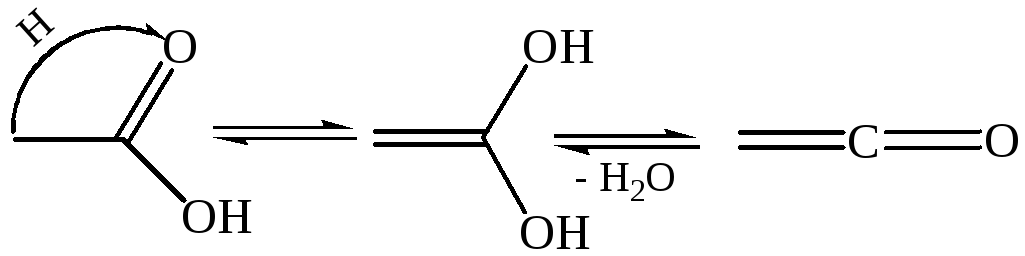
6.5. Дегидратация карбоновых кислот протекает при высоких температурах с образованием кетенов:
|
|
6.6 Реакция Дюма (часть 1, глава 8.1)
Отдельные представители. Муравьиная кислота – бесцветная едкая жидкость с острым запахом, смешивающаяся с водой. Впервые выделена в XVII веке из красных муравьев перегонкой с водяным паром. В природе встречается в свободном состоянии в крапиве.
Муравьиная кислота по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот. В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода. По этой причине муравьиная кислота является наиболее сильной кислотой по сравнению с другими членами своего гомологического ряда.
В молекуле муравьиной кислоты можно выделить и альдегидную группу, поэтому кислота вступает в реакции, характерные как для кислот, так и для альдегидов. В частности, как и альдегиды, НСООН проявляет восстановительные свойства.
Муравьиная кислота широко используется в органическом синтезе, например, для получения формамида, диметилформамида, щавелевой кислоты. Муравьиная кислота обладает бактерицидным действием, поэтому используется для консервирования и для дезинфекции емкостей для пива и вина. Формиат алюминия используют для пропитки текстильных изделий.Применяют муравьиную кислоту и при крашении тканей.
Уксусная кислота представляет собой бесцветную жидкость с острым запахом и кислым вкусом, неограниченно смешивающуюся с водой. Безводную уксусную кислоту называют «ледяной», так как при 16 °С она замерзает и образует кристаллы, подобные льду. Обычная уксусная кислота, содержащая 2–3 % воды, замерзает при температуре ниже 13 °С.
Разбавленные водные растворы уксусной кислоты образуются при брожении вина. При перегонке водных растворов получают приблизительно 80 % кислоту («уксусную эссенцию»), которую применяют для пищевых целей.
Уксусную кислоту используют в качестве растворителя и как исходное вещество для синтеза производных уксусной кислоты (ацетилхлорида, ацетангидрида, амидов, сложных эфиров). Ацетаты применяют в текстильной промышленности в качестве протравителей и в синтезе как основные катализаторы, а также их используют для борьбы с вредителями растений, 3–6 % растворы (столовый уксус) используют как вкусовую приправу и консервант. Эфиры уксусной кислоты применяют в качестве растворителей лаков и красок. Многие эфиры и амиды уксусной кислоты используются в медицине в качестве лекарственных средств.
Пальмитиновая кислота представляет собой бесцветное кристаллическое вещество со слабым запахом стеарина, в воде не растворяется, широко распространена в природе, в виде сложных эфиров с глицерином входит в состав жиров. Получают пальмитиновую кислоту обработкой жиров щелочью (гидролиз, омыление). При этом образуются соли (пальмитаты), после подкисления, которых осаждается сама кислота. Пальмитиновая кислота и ее производные используются в качестве ПАВ (моющих средств и др.), а ее натриевая соль называется мылом.
Стеариновая кислота – бесцветное кристаллическое вещество со слабым запахом стеарина. Ее эфиры с глицерином входят в состав жиров.
Получают стеариновую кислоту омылением жиров, обычно образуется смесь стеариновой и пальмитиновой кислот. Стеариновую кислоту в смеси с пальмитиновой используют в производстве свечей, их натриевые соли являются обыкновенным мылом. В органическом синтезе стеариновую кислоту используют для получения других поверхностно-активных веществ. Производные пальмитиновой и стеариновой кислот принадлежат к важным природным веществам – липидам.
Наиболее важные источники алифатических карбоновых кислот – животные и растительные жиры, которых можно получить кислоты с неразветвленной цепью и с четным числом атомов углерода, начиная от шести и до восемнадцати атомов углерода.