
- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
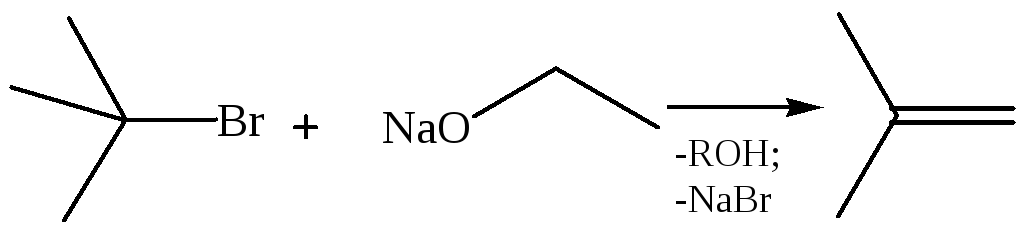
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
1.1.5 Алкилирование (реакция Вильямсона):
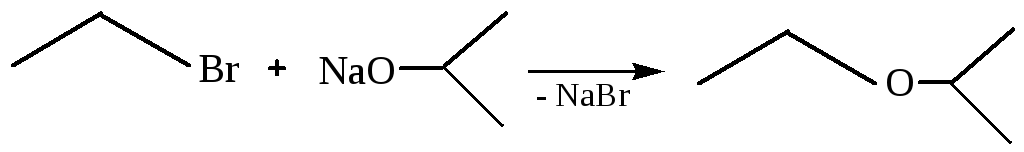
1.1.6 Ацилирование:
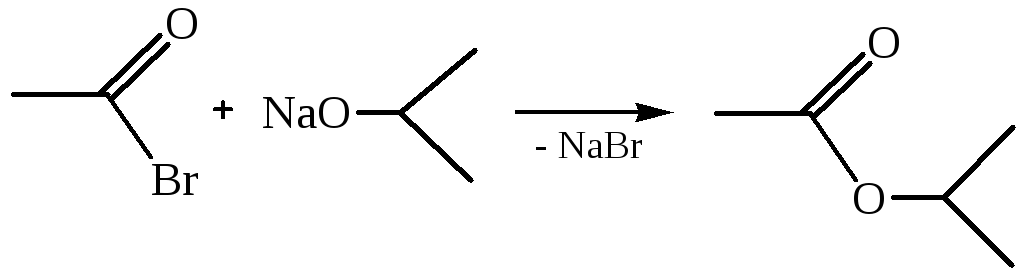
1.1.7 Введение кратных связей:
2 Реакции, протекающие с разрывом связи С–О. Основные свойства обнаруживаются в присутствии сильных минеральных кислот. Подобно воде, спирты присоединяют протон с образованием иона алкилоксония, представляя собой основания Бренстеда:
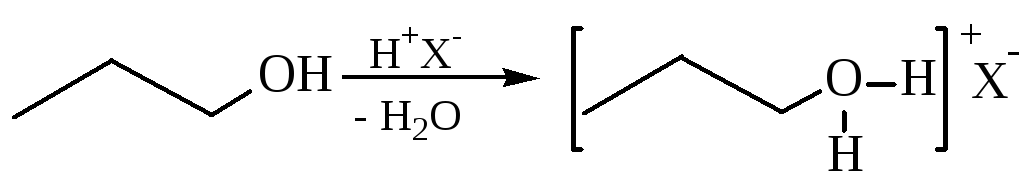
Взаимодействие протекает быстро и легко, что обычно характерно для реакций кислот с основаниями. Образующиеся соли алкилоксония устойчивы при низкой температуре. Благодаря образованию оксониевых солей спирты лучше растворимы в минеральных кислотах, чем в воде. В ионе алкилоксония близость положительно заряженного атома кислорода и электронодефицитного атома углерода разрыхляет связь R–О, что облегчает реакции SN.
Основные свойства спиртов в ряду (первичные, вторичные, третичные) возрастают благодаря усилению +I алкильного радикала, что способствует повышению электронной плотности на атоме кислорода и облегчает присоединение протона. Сильными основаниями спирты не являются, поэтому при разбавлении их растворов в минеральных кислотах они выделяются в свободном состоянии.
2.1 Нуклеофильное замещение гидроксильной группы. В результате реакции SN должен вытесняться ОН-анион:
![]()
Однако эта реакция затруднена, поскольку ОН-анион является невыгодной уходящей группой (плохим нуклеофугом), т. к. представляет собой частицу с большой энергией (низкая возможность делокализации отрицательного заряда) и его вытеснение энергетически невыгодно, поэтому у спиртов реакции замещения ОН-группы протекают в условиях кислотного катализа. Роль кислотного катализатора заключается в создании более выгодной уходящей группы:
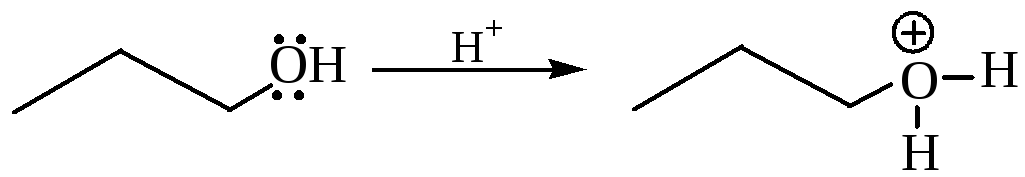
В образовавшемся катионе алкилоксония реакция SN протекает более легко, т. к. в роли уходящей группы выступает бедная энергией молекула воды и увеличивается электронодефицит на реакционном центре.
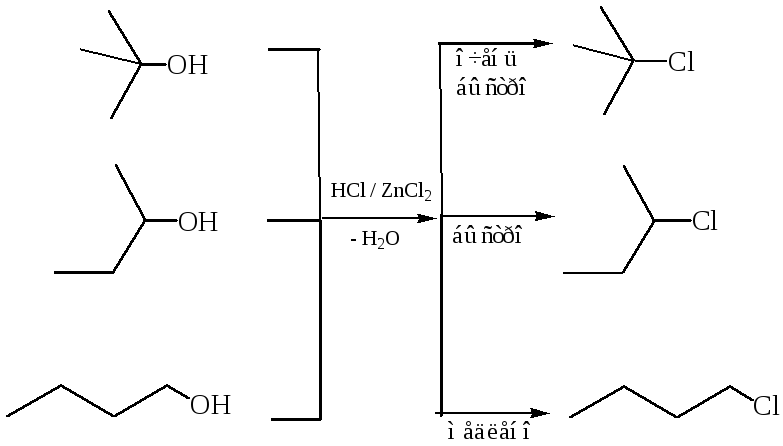
2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
![]()
На различной реакционной способности первичных, вторичных, третичных спиртовосновано их отличие пробой Лукаса.
2.1.2 Взаимодействие спиртов с кислотами Льюиса. Благодаря НЭП на кислородном атоме спирты могут реагировать с кислотами Льюиса, образуя оксониевые соединения с донорно-акцепторной связью:

В присутствии сильных протонных кислот и кислот Льюиса спирты способны образовывать карбкатионы и выступать в роли электрофильных реагентов, например, в SЕ реакциях бензольного кольца:

![]()
С накоплением ЭД групп в молекуле спирта основность возрастает, т. к. увеличивается электронная плотность на атоме кислорода. Если с ОН-группой связан ЭА заместитель, то основность соединения снижается. Например, у фенолов вследствие +М эффекта электронная плотность на атоме кислорода понижена, поэтому фенолы с кислотами оксониевых солей не образуют.
2.1.3 Замещение ОН-группы на остаток минеральной кислоты. При взаимодействии спиртов с кислородсодержащими минеральными кислотами образуются сложные эфиры:
2.1.3.1
![]()
2.1.3.2
![]()
2.1.3.3
![]()
Подобно кислым и средним солям в случае многоосновных кислот возможно образование кислых и средних сложных эфиров. Средние эфиры получают сухой перегонкой кислого эфира либо обработкой спирта олеумом:
![]()
![]()
