
- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
4. Реакции элементорганических соединений
4.1 Металлорганические соединения, в основном магний- и литийорганические, при взаимодействии с альдегидами, кетонами, производными карбоновых кислот позволяют легко получать спирты с удлинением углеродной цепи:
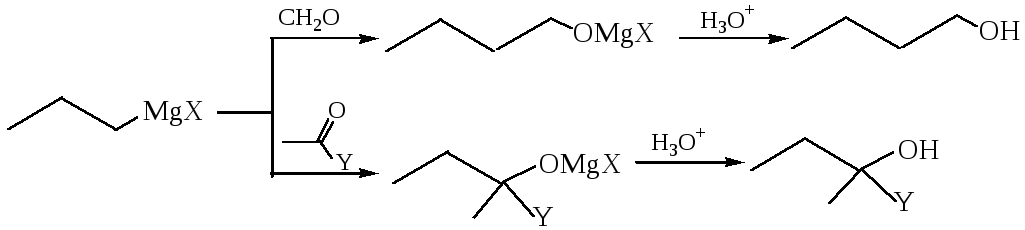
где Х=Hal, Y= H, R, Hal, OR, NH2, NR2, OCOR; R= алкил, арил.
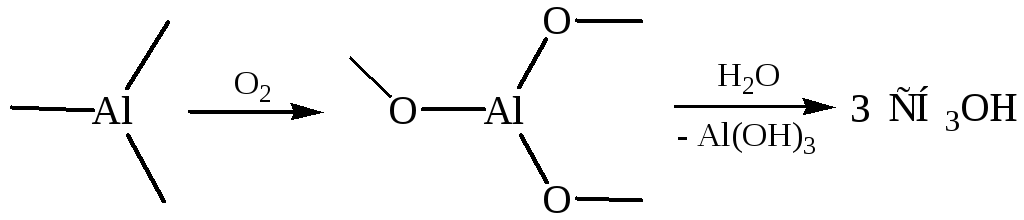
4.2 Окисление металлорганических соединений:
![]()
В промышленности применяют окисление алюминий- и борорганических соединений (К. Циглер):
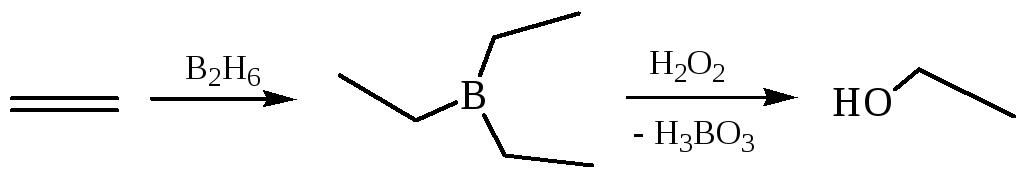
4.3 Гидроборирование – окисление алкенов:
5. Ферментативные реакции. Наиболее древний способ получения этанола, при этом используют растительное сырье (крахмал, картофель, патока, древесина):
(С6Н10О5)n
![]() С2Н5ОН
+ СО2
С2Н5ОН
+ СО2
6. Гидролиз галогеналканов. Реакция протекает при нагревании галогеналканов с водой (обратимо) или щелочью:
![]()
Физические свойства и строение. Низшие спирты – жидкости с характерным запахом, выше С10 – твердые вещества почти без запаха. Спирты могут образовывать водородные связи:
![]()
Энергия водородной связи составляет 20–40 кДж/моль, что на порядок ниже энергии ковалентных связей (ЕН–О = 456 кДж/моль). Таким образом, молекулы спирта ассоциированы за счет водородных связей, и при нагревании требуется дополнительная энергия для их разрушения и переведения молекул в газообразное состояние. Ориентационное взаимодействие делает молекулярные кристаллы спиртов и фенолов более прочными, что приводит к повышению температур плавления и кипения по сравнению с углеводородами и галогенуглеводородами с близкой молекулярной массой. Чем меньше углеводородный радикал, больше гидроксильных групп, тем значительней такое повышение. Все эти закономерности прослеживаются в таблице 9.
С удлинением углеводородной цепи относительное влияние водородных связей уменьшается, поэтому высшие одноатомные спирты по своим физическим свойствам близки к соответствующим углеводородам.
Возможность образования водородных связей между молекулами спиртов и воды способствует растворению спиртов в воде, которая увеличивается при уменьшении углеводородного радикала (гидрофобной части) и увеличении числа гидроксильных групп. Высшие спирты по растворимости в воде подобны обычным углеводородам.
Таблица 9 – Физические свойства спиртов
|
Формула |
Название |
Мол. масса |
Температура, °С |
Растворимость в воде при 20°С г/на 100 г | |
|
плавления |
кипения | ||||
|
CH3OH |
метанол, метиловый спирт |
32 |
–98 |
65 |
неограниченно |
|
CH3CH2OH |
этанол, этиловый спирт |
46 |
–117,3 |
78,5 |
неограниченно |
|
CH3(CH2)2OH |
пропанол-1, пропиловый спирт |
60 |
–127 |
97 |
неограниченно |
|
CH3CH(OH)CH3 |
пропанол-2, изопропи-ловый спирт |
60 |
–88,5 |
82 |
неограниченно |
|
CH3(CH2)3OH |
бутанол-1, бутиловый спирт |
74 |
–89,6 |
117,9 |
9 |
|
CH3(CH2)7OH |
октанол-1, октиловый спирт |
130 |
–16,7 |
195 |
0,059 |
|
CH2(OH)CH2(OH) |
этилен-гликоль |
62 |
–13,2 |
197,2 |
неограниченно |
|
CH2(OH)CH(OH)CH2(OH) |
глицерин |
92 |
17,9 |
290 (разл.) |
неограниченно |
|
C6H5OH |
фенол |
94 |
43 |
181,2 |
8,2 |
|
C6H4(OH)2 |
гидрохинон |
ПО |
170,5 |
286,2 |
5,9 |
Таблица 10 – Физические параметры связей С–O и О–Н
|
Связь |
Длина, нм |
Средняя энергия связи, кДж/моль |
Полярность, μ, D |
Поляризумость, RD, см3 |
|
С–O |
0,143 |
340 |
0,8 |
1,54 |
|
О–Н |
0,096 |
465 |
1,51 |
1,64 |
Полярность С–О и О–Н связей в спиртах и фенолах подтверждается наличием у них дипольного момента. НЭП атома кислорода вносят существенный вклад в реакционную способность данного класса соединений, однако вследствие высокой электроотрицательности атома кислорода связи С–О и О–Н обладают невысокой поляризуемостью.
Уменьшение длины связи С–О фенолов (0,136 нм) по сравнению со спиртами (0,143 нм), связанное с разностью ковалентных радиусов C(sp2) и С(sp3), приводит к ее упрочнению в фенолах. Частично это может быть связано с сопряжением ОН группы с бензольным кольцом. Сопряжение играет определяющую роль в уменьшении энергии связи О–Н в фенолах по сравнению со спиртами, так как в реакции:
RO–H
![]() RO•
+ Н•
RO•
+ Н•
образующийся фенокси-радикал стабилизирован сопряжением, что делает его образование энергетически более предпочтительным по сравнению с алкоксирадикалом.
Пространственная ориентация связей кислорода и природа его НЭП зависят от характера углеводородного заместителя. Атом кислорода, имеющий электронную конфигурацию внешнего слоя 2s22p4 может, как атомы азота или углерода, образовывать связи в различных состояниях. Sp3 гибридизация осуществляется для предельных спиртов, в которых угол связи С–O–H близок к тетраэдрическому (105–108о). У фенолов наблюдается sp2 гибридизация, валентный угол равен 120о, а НЭП занимают свободную р и sp2 орбитали. При нахождении атома кислорода в основном состоянии валентный угол будет составлять 90о, а НЭП будут находиться на s и p орбиталях, т. е. будут энергетически неравноценными.
Химические свойства алканолов. Реакции гидроксилсодержащих соединений могут протекать как с участием гидроксильной группы, так и с участием углеводородного радикала.
Гидроксильная группа как функциональная группа обуславливает главные химические свойства этого класса органических соединений. В реакциях могут разрываться либо связи С–О, либо связи О–Н. Существенный вклад в реакционную способность вносит также НЭП атома кислорода. Среди реакций спиртов можно выделить несколько важнейших типов превращений (рисунок 1).
Полярность связи С–О предопределяет ее склонность к гетеро-литическому разрыву, в результате чего возможны реакции замещения гидроксигруппы. Поскольку на С-атоме субстрата имеется дефицит электронов, то его атаковать может только нуклеофил. Поэтому для гидроксилпроизводных характерны реакции нуклеофильного замещения ОН-группы (SN реакции).
В процессе превращения гетеролизу может подвергаться связь СО–Н. В этом случае гидроксилпроизводное, отдавая протон, проявляет кислотные свойства.
Благодаря наличию на атоме кислорода НЭП гидроксилпроизводное может присоединять протон, т. е., согласно протолитической теории, проявлять свойства основания.
Благодаря этой же НЭП гидроксилсодержащее соединение может участвовать в реакции в роли нуклеофильного реагента.

Рисунок 1 – Схема реакционной способности алканолов
1. Реакции с сохранением атома кислорода. Кислотно-основные свойства спиртов. Водные растворы спиртов нейтральны и, подобно воде, амфотерны.
Кислотные свойства связаны с высокой полярностью связи О–Н, что приводит к ее ионизации. Легкость разрыва связи О–Н, т. е. степень депротонирования гидроксилпроизводного, определяется полярностью и энергией диссоциации этой связи: чем выше полярность связи О–Н и устойчивее образующийся анион, т. е. ниже энергия диссоциации, тем легче разрывается связь О–Н и выше кислотность. Следовательно, ЭА заместители, связанные с ОН-группой, повышают кислотность соединения, а ЭД заместители ее понижают.
Понижение кислотных свойств спиртов происходит под влиянием алкильного радикала, вызывающего положительный индукционный эффект, который противодействует поляризации связи О–Н (+I алкильного радикала нагнетает избыточную электронную плотность на атом кислорода и полярность связи О–Н уменьшается). Сила положительного индукционного эффекта возрастает с увеличением размера и степени разветвленности алкиального радикала, поэтому кислотные свойства убывают при переходе от первичных к третичным спиртам.
Образование алкоголятов, их свойства:
1.1.1
![]()
1.1.2
![]()
1.1.3
![]()
1.1.4
![]()
В результате реакции образуются алкоголяты (соли спиртов) – твердые вещества, устойчивые только в безводной среде. Связь между кислородом и металлом ионная, поэтому алкоголята в растворе практически полностью диссоциирует на алкоксидион (RO:) и катион металла, т. е. вода является более сильной кислотой, чем спирт. По этой причине алкоголят нельзя получить взаимодействием спирта с водной щелочью, ибо равновесие этой реакции смещено в сторону гидролиза соли. Алканоляты не только сильные основания, но и сильные нуклеофильные реагенты.
