- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
3.4 Простые эфиры
Простые эфиры можно рассматривать как производные спиртов и фенолов, в которых атом водорода гидроксильной группы замещен углеводородным остатком. Общая формула простого эфира R–О–R1. В тех случаях, когда с атомом кислорода связаны различные углеводородные остатки, простой эфир называют смешанным, одинаковые остатки – симметричным. В зависимости от природы углеводородного радикада простые эфиры подразделяются на:
простые эфиры с открытой цепью;
циклические;
насыщенные;
ненасыщенные;
ароматические и т. д.
По названиям углеводородных остатков составляют название простого эфира. Примеры простых эфиров и их названий приведены в таблице 14.
Таблица 14 – Классификация и номенклатура простых эфиров
|
Формула |
Название |
Класс |
|
СН3–О–СН3 |
диметиловый эфир метоксиметан |
предельный симметричный |
|
С2Н5–О–С2Н5 |
диэтиловый эфир этоксиэтан |
предельный симметричный |
|
СН3–О–СН(СН3)2 |
метилизопропиловый эфир 2-метоксипропан |
предельный смешанный |
|
СН3–О–С6Н5 |
метилфениловыйэфир метоксибензол анилзол |
жирно-ароматический смешанный |
|
СН2=СН–О–С2Н5 |
винилэтиловый эфир |
непредельный смешанный |
|
|
алкеноксид |
циклический эпоксид оксиран |
|
| ||
|
|
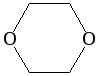
1,4-диоксан |
циклический |
|
|
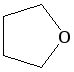
тетрагидрофуран |
циклический |
Способы получения простых эфиров
Реакция галогенопроизводных углеводородов с алкоголятами – реакция Вильямсона. В качестве алкилирующих средств в этом синтезе могут быть использованы алкилгалогениды и диалкилсульфаты. Вследствие возможного протекания конкурирующей реакции элиминирования этот способ более пригоден для первичных субстратов и практически не используется для третичных:
![]()
Дегидратация спиртов под влиянием кислот. Метод для получения симметричных простых эфиров из первичных спиртов или смешанных эфиров из первичного и третичного спиртов:
![]()
Присоединение спиртов к алкинам приводит к образованию виниловых эфиров:

4. Окисление алкенов. Мягкое окисление алкенов надкислотами или кислородом в присутствии серебряного катализатора приводит к образованию трехчленных циклических простых эфиров – оксиранов (эпоксидов) (часть 1, глава 8.2).
Физические свойства простых эфиров. Неспособность молекул простых эфиров образовывать водородные связи делает эти соединения более легколетучими по сравнению со спиртами с близкой молекулярной массой. В смесях с оксисодержащими соединениями, в частности, с водой, простые эфиры образуют водородные связи за счет атома кислорода как донора пары электронов, поэтому низшие эфиры ограниченно растворимы в воде. Циклические простые эфиры, имея более доступный для сольватации атом кислорода, образуют более прочные водородные связи, поэтому они хорошо растворимы в воде (таблица 15).
Таблица 15 – Физические свойства простых эфиров
|
Формула |
Название |
Мол. масса |
Температура, °С |
Растворимость в воде г/100 г | |
|
плавления |
кипения | ||||
|
|
Диэтиловый эфир |
74 |
–116 |
35 |
7,5 |
|
|
Ди (н-пропиловый) эфир |
100 |
–122 |
90 |
8 |
|
|
Тетрагидрофуран |
72 |
–108 |
66 |
Растворим |
|
Продолжение таблицы 15 | |||||
|
|
Диоксан |
88 |
12 |
101 |
Неограниченно |
|
|
Эпоксиэтан, окись этилена |
44 |
–112 |
11 |
Неограниченно |
|
|
Эпоксипропан, окись пропилена |
58 |
–112 |
34 |
Растворим |
Химические свойства простых эфиров. Простые эфиры – один из немногих классов органических соединений, обладающих невысокой реакционной способностью. В отличие от спиртов простые эфиры, не имея гидрофильного водорода, не проявляют кислотных свойств, однако остальные типы реакций, характерные для спиртов, присущи и простым эфирам:
Наличие в молекулах простых эфиров на атоме кислорода НЭП определяет их способность участвовать в реакциях в качестве оснований.
Вследствие большей электроотрицательности атома кислорода по сравнению с атомом углерода связь Сδ+–Оδ– в простых эфирах подобно связи С–О в спиртах полярна. На углеродном атоме имеется дефицит электронов, что делает возможной нуклеофильную атаку по этому атому с разрывом простой эфирной связи. Однако этот процесс расщепления простого эфира невыгоден по двум причинам:
вследствие электронодонорных свойств углеводородных заместителей, полярность связи С–О невелика;
алкокси-анион, так же как и гидрокси-анион, невыгодная уходящая группа (богата энергией), поскольку в ней нет условий для эффективной делокализации отрицательного заряда.

Следовательно, большинство простых эфиров – довольно инертные химические соединения. Они устойчивы к действию водных растворов кислот, щелочей. Простые эфиры могут расщепляться только некоторыми реагентами, например, при нагревании с концентрированной йодистоводородной кислотой или под действием металлического натрия при повышенной температуре.
1. Основные свойства. Обладая электронной парой на атоме кислорода, простые эфиры могут образовывать координационные комплексы с различными протонными или апротонными кислотами. Однако поскольку атом кислорода обладает довольно высокой электроотрицательностью и стерически мало доступен, он является слабым донором электронной пары. Вследствие этого простые эфиры – слабые основания. Они могут образовывать соли только с сильными кислотами (Н–кислоты и кислоты Льюиса) и в отсутствие воды.
1.1 Взаимодействие с концентрированной серной кислотой. Простые эфиры протонируются, давая растворы оксониевых солей:

В водной среде оксониевые соли легко гидролизуются, регенерируя при этом исходные эфир и кислоту.
1.2 Взаимодействие с кислотами Льюиса. Эфиры посредством семиполярной связи образуют комплексы:
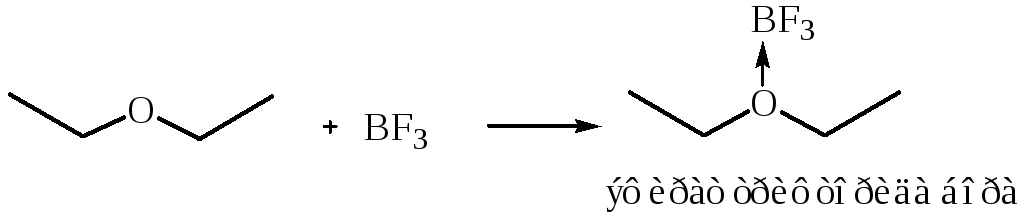
2. Реакции нуклеофильного замещения. Необходимыми условиями для расщепления простой эфирной связи является наличие сильного нуклеофила и перевод алкокси-аниона в выгодную уходящую группу. Последнее может быть достигнуто, если SN реакцию осуществлять с оксониевой солью эфира, т. е. в присутствии сильной кислоты.
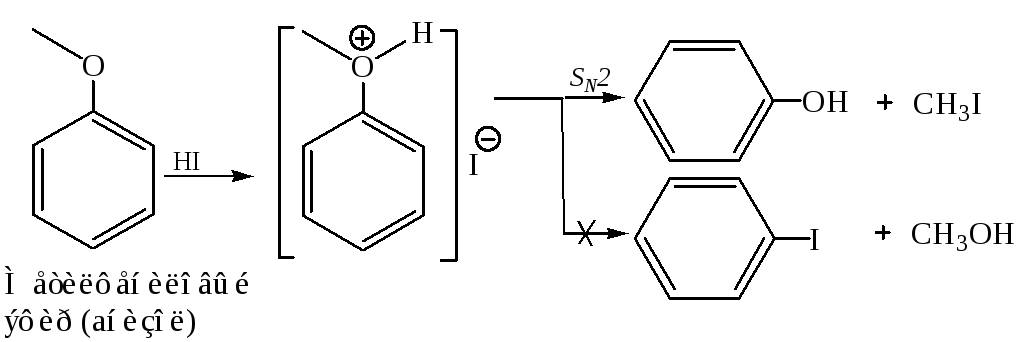
Реакция SN у простых эфиров идет еще труднее, чем у спиртов, т. к. группа RO – является плохой уходящей группой. Однако в кислой среде в результате протонирования по кислороду она превращается в несколько лучшую уходящую группу ROH и нуклеофильное замещение становится возможным.
Природа углеводородного радикала определяет в таких случаях, какой из механизмов – SN1 или SN2 – реализуется, причем закономерности здесь такие же, как в случае алкилгалогенидов. В качестве кислот, катализирующих реакции нуклеофильного замещения простых эфиров, обычно используют HI, H2SO4, НВr.
В
данном случае образуется исключительно
фенол, так как связь
![]() прочнее по сравнению
прочнее по сравнению![]() ,
и последняя разрывается легче.
,
и последняя разрывается легче.
3. Отщепление (элиминирование) для простых эфиров, аналогично спиртам, можно осуществить действием сильных кислот, в частности, серной кислоты:
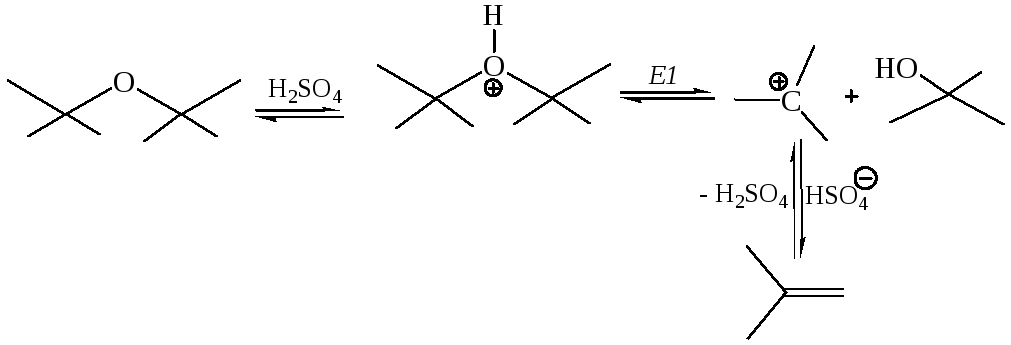
Реакции простых эфиров Е2 типа можно осуществить действием очень сильных оснований, в частности, алкилпроизводных щелочных металлов:

3.1 Расщепление простых эфиров при высоких темепратурах активными металлами (Шорыгин, 1910 г.):
![]()
4. Окисление простых эфиров идет легко по С–Н связи кислородом воздуха на свету, поэтому их хранят в темных (светонепроницаемых) емкостях. При длительном хранении в присутствии кислорода воздуха на свету у алифатических эфиров происходит свободнорадикальный процесс окисления, приводящий к образованию неустойчивых пероксидов.
Автоокисление эфиров протекает у α-углеродного атома, поскольку в качестве интермедиатов в этом случае выступают свободные радикалы, стабилизированные делокализацией неспаренного электрона с участием НЭП атома кислорода:
|
| |
|
Триплетный кислород |
Синглетный кислород |
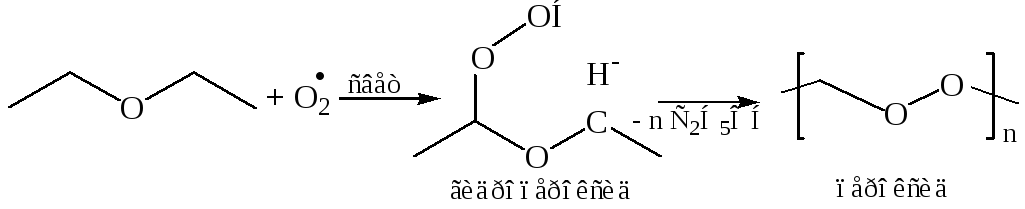
Работа с простыми эфирами, не освобожденными от перекисей, требует особой осторожности. Остаток после перегонки может содержать опасные в отношении взрыва концентрации перекисей. Эфиры, очищенные от перекисей, хранят, как правило, над металлическим натрием или гидридом кальция.