
Ответы на зачет / зачет все ответы
.pdfНативный белок-белок с неизменной структурой и свойствами.
Признаки денатурации: потеря биологической активности, изменение конформации белковой молекулы, увеличение числа функциональных групп(появляются гидрофобные),уменьшение растворимости и осаждение, изменение вязкости, оптической активности, прозрачности растворов белка, изменение окрашиваемости.
При денатурации белки изменяют свои свойства и теряют биологическую активность, несмотря на то, что их первичная структура сохраняется.
Денатурацию вызывают физические факторы: температура, давление,
механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Явление денатурации можно использовать и для качественного анализа присутствия белков в растворах. Для этого пользуются пробой с кипячением исследуемой жидкости после ее подкисления. Образующееся при этом помутнение связано с денатурацией белка. Часто используют и осаждение органическими кислотами: сульфосалициловой или трихлоруксусной.
8. Практическое использование электрофореза. Свойства белков в изоэлектрической точке.
Электрофорез - направленное движение коллоидных частиц или макроионов под действием внешнего электрического поля.
Электрофорез применяют в лечебных целях в физиотерапии. В химической промышленности он используется для осаждения дымов и туманов, для изучения состава растворов и др. Электрофорез является одним из наиболее важных методов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии.
лекарственный электрофорез
Суть метода заключается в том, что лекарственные средства наносят на проклодки электродов и вводят через кожные покровыс помощью постоянного электрического тока. В этом случае на организм действует два фактора - лекарственный препарат и гальванический ток. В растворе, как и в тканевой жидкости, многие лекарственные вещества распадаются на ионы и в зависимости от их заряда вводятся при электрофорезе с того или иного электрода. Проникая при прохождении тока в толщину кожи под электродами, лекарственные вещества образуют кожные депо, из которых они за счет осмоса и диффузии движения лекарственное вещество медленно и постепенно

проникают в более глубокие ткани, распространяясь с током крови по всему организму. В дальнейшем лекарство распределяется в различных органах.
В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. Изоэлектрическая точка белка в сильной степени зависит от присутствия в растворе ионов солей; в то же время на ее величину не влияет концентрация белка.
9. Классификация сложных белков. Фосфопротеины и их биологическая роль. Фосфатная модификация в регуляции активности ферментов.
Сложные белки ( в составе аминокислоты(АК), соединенные с другими макромолек:лами):
1)Гликопротеиды (АК + углевод)
2)Липопротеиды (АК + липид)
3)Металлопротеиды (АК + металл)
4)Нуклеопротеиды (АК + нуклеиновая кислота)
5)Фосфопротеиды (АК + фосфат-ион)
6)Хромопротеиды ( АК + окрашенная группа разной природы)
Фосфопротеины – это белки, в которых присутствует фосфатная группа, она связывается с пептидной цепью через остатки тирозина, серина, треонина (т.е. тех аминокислот, которые содержат ОН-группу).
Фосфорная кислота может выполнять:
1.Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине молока, яичном альбумине.
2.Функциональную роль. В клетке присутствует много белков, которые связаны с фосфатом не постоянно, а в зависимости от активности метаболизма. Белок может многократно переходить в фосфорилированную или в дефосфорилированную форму, что играет регулирующую роль в его работе.
Био.роль:
- Содержатся в нервной ткани - В костях, зубах фосфопротеины концентируют Са2+, что важно для минерализации
- Участвуют в регуляции активности ядра, окислительных процессах в митохондриях, транспорте ионов в клетке
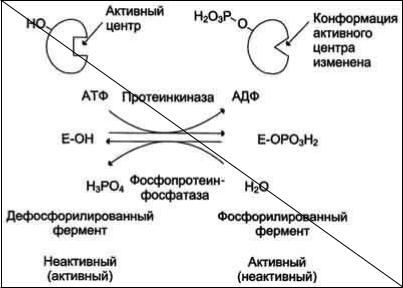
Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование ( осуществляется ферментами протеинкиназами) /дефосфорилирование (осуществляется фосфопротеинфосфатазами). Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. Результат: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфорилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов.
10.Строение хромопротеинов. Важнейшие представители и биологическая роль.
Хромопротеины содержат окрашенные простетические группы. Сюда относят гемопротеины (содержат гем), ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В2), кобамидпротеины (содержат витамин В12)
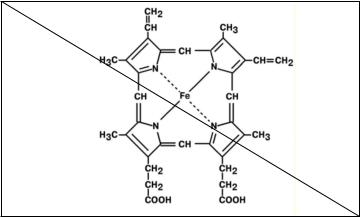
●Гемопротеины Подразделяются на неферментативные (гемоглобин, миоглобин) и ферменты
(цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
●Цитохромы Цитохромы отличаются аминокислотным составом пептидных цепей и числом цепей и
разделяются на типы а, b, с, d. Все они неспособны связывать кислород, кроме цитохрома а3, который содержит ионы меди. Цитохромы находятся в составе дыхательной цепи митохондрий и цепи микросомального окисления.
Био. роль: участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
11.Структура и биологическая роль гемоглобина, физиологические и аномальные типы.
Гемоглобин содержит гем-тетрапиррольный комплекс с атомом Fe2+ в центре.
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Типы гемоглобина:
1)Физиологические гемоглобины;
2)Патологические (аномальные).
К физиологическим гемоглобинам относятся:
-Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
-Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
-Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около
90-96%.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
-HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
12. Структура и биологическая роль гемоглобина. Производные гемоглобина
Структуру и био. роль см. пункт 11. Производные:
-HbO2 – оксигемоглобин (связан с молекулой O2);
-HbCO – карбоксигемоглобин;(комплекс с угарным газом)
-HbCO2 – карбгемоглобин; (комплекс с углекислым газом)
-HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
-Метгемоглобин - окисленная -
13) Структура и биологическая роль нуклеопротеинов и нуклеиновых кислот
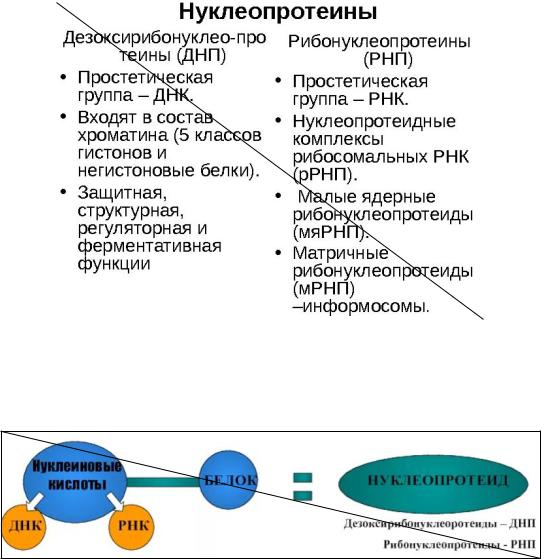
Нуклеопротеины являются комплексом нуклеиновых кислот с белками. При этом нуклеиновые кислоты являются простетической группой. Бывают двух типовдезоксирибонуклеопротеины (ДНК+белок) и рибонуклеопротеины (РНК+белок)
Структура: как правило, нуклеопротеины состоят из высокого процента основных аминокислотных остатков (лизина, аргинина и гистидина). При физиологическом pH эти аминокислоты заряжены положительно, что способствует взаимодействию с молекулами генетического материала.
Нуклеиновые кислоты образованы скелетом сахаров и фосфатов, которые придают ему отрицательный заряд. Притяжение между положительными зарядами белков и отрицательными зарядами нуклеиновой кислоты приводит к взаимодействию неспецифического типа.
К нуклеопротеинам относят гистоны, протамины, рибосомы.
Гистоны. Структурно они являются основными белками хроматина. Существует 5 классов гистонов, различающихся по размерам, аминокислотному составу и величине положительного заряда (Всегда положительный!).
Н1богатые лизином
Н2Абогатые аргинином и лизином
Н2В-умеренно богатые аргинином и лизином
Н3-ботагые аргинином
Н4-богатые глицином и аргинином
Гистоны обеспечивают компактизацию хроматина (наматывание цепи ДНК на гистоновые бусины).
Протамины. Представляют собой небольшие ядерные белки, характеризующиеся высоким содержанием аминокислотного остатка аргинина. Основная роль протаминов заключается в замене гистонов в гаплоидной фазе сперматогенеза. Было высказано предположение, что этот тип основных белков имеет решающее значение для упаковки и стабилизации ДНК в мужской гамете. Они отличаются от гистонов, так как они позволяют более плотную упаковку.
Рибосома. Они представляют собой очень сложный молекулярный механизм, образованный одной или несколькими рибосомными РНК и набором белков.
Биологическое значение нуклеопротеинов:
ДНП (дезоксирибонуклеопротеины): уплотнение ДНК, участие в регуляторных процессах репликации, транскприпции ДНК, гомологичной рекомбинации (кроссинговер)
РНП (рибонуклеопротеины): участие в репликации ДНК, регуляция экспрессии генов, регуляция метаболизма центральной РНК, защитная функция (ряд рибонуклеопротеинов связан с РНК в защитные комплексы, например в РНК вирусов)
Нуклеиновые кислоты
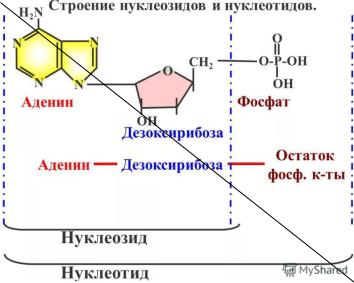
Нуклеиновые кислоты– это полинуклеотиды, неразветвленные и нерегулярные, исключительно крупные биополимеры. Нуклеиновые кислоты состоят из нуклеотидов. Нуклеотиды — это 3-х компонентные соединения, состоящие из азотистого основания (пуринового или пиримидинового), остатков пентозы (рибозы или дезоксирибозы) и остатка фосфорной кислоты.
Нуклеозид — это соединение, состоящее из азотистого основания и пентозы (рибозы или дезоксирибозы)
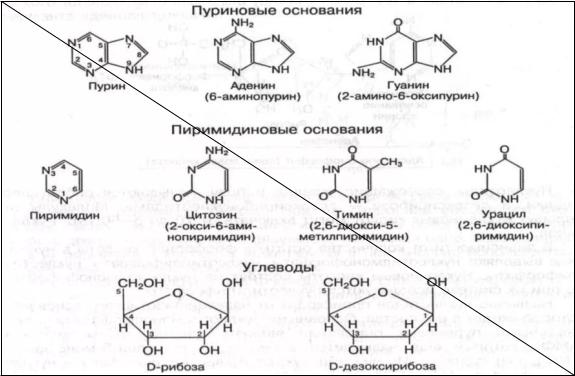
! в состав ДНК входят только А (аденин), Т(тимин), Г(гуанин), Ц (цитозин) В состав РНК входят А (аденин), У(урацил), Г(гуанин), Ц(цитозин)
Пуриновые и пиримидиновые нуклеотиды представлены в виде рибонуклеотидов и дезоксирибонуклеотидов.
Биологическая роль нуклеотидов:
1)являются универсальными источниками энергии в клетке (АТФ, ГТФ и др.);
2)являются активаторами и переносчиками мономеров в клетке (например, УДФглюкоза, ЦДФ-холин);
3)являются аллостерическими регуляторами активности ферментов;
4)входят в состав коферментов (НАД , НАДФ , ФАД, КоАSH);
5)циклические мононуклеотиды (цАМФ, цГМФ) являются вторичными посредниками действия гормонов и других сигналов на клетку;
6)являются мономерами в составе нуклеиновых кислот.
Строение ДНК ДНК преимущественно сосредоточена в ядре, митохондриях и хлоропластах. Является
полинуклеотидом. В ДНК входят 4 типа нуклеотидов, включающих дезоксирибозу, остаток фосфорной кислоты и различающихся азотистыми основаниями: А, Т, Г, Ц. Связь между нуклеотидами 3´-5´-фосфодиэфирная. Связь образуется между 3´-ОН- группой остатка дезоксирибозы одного нуклеотида и 5´-остатком фосфорной кислоты другого. У молекулы есть 3´-конец и 5´-конец.
Первичная структура ДНК — это последовательность нуклеотидов в полинуклеотидной цепи. Соединены нуклеотиды 3´-5´-фосфодиэфирной связью.
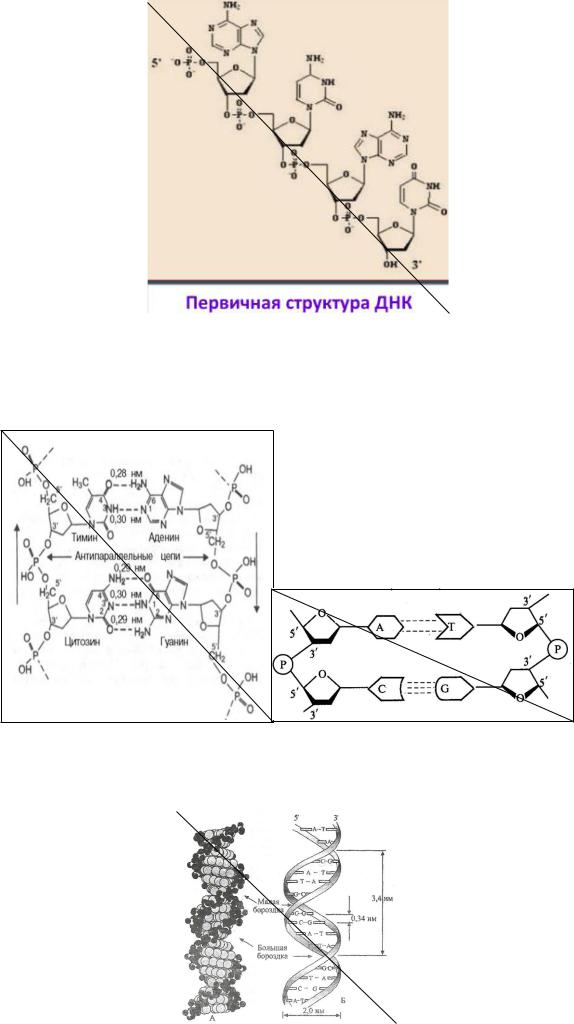
Вторичная структура ДНК-это укладка 2-х полипептидных цепей в форме спирали. Две полинуклеотидные спирали расположены антипараллельно, связаны комплементарными взаимодействиями (водородными связями) между азотистыми основаниями. Между А, Т/ A, Y 2 водородные связи, между Г, Ц- 3 водородные связи.
Поверхность двойной спирали имеет две спиральные бороздкибольшую и малую. Белки связываются с ДНК в области большой бороздки, куда выступают азотистые основания.
Азотистые основания в двойной цепи локализованы внутри спирали, сахарофосфатный остов снаружи.
Третичная структура ДНКформируется только при связывании ДНК с белкамигистонами и служит для компактизации ДНК в ядре
Функции ДНК: хранение, воспроизводство и передача по наследству генетического материала, экспрессия генов, репликация и компактизация ДНК для передачи генетического материала
Строение РНК
Нуклеотиды РНК образованы одним из 4-х азотистых оснований: А, У, Г, Ц, рибозы и остаток фосфорной кислоты. Связь между нуклеотидами 3´-5´-фосфодиэфирная. Связь образуется между 3´-ОН-группой остатка рибозы одного нуклеотида и 5´-остатком фосфорной кислоты другого. У молекулы есть 3´-конец и 5´-конец. Как правило состоит из одной цепи.
Выделяют несколько видов РНК: тРНК, мРНК, рРНК
Особенности структуры мРНК: на 5'-конце – КЭП (шапочка) – определенная последовательность нуклеотидов (7-метилгуанозинтрифосфат и 2'-О-метилпуриновый нуклеотид). На 3'-конце большинства мРНК – поли-адениловый хвост (50-400 А- нуклеотидов). Функция мРНК – перенос информации от ДНК на белок синтезирующую систему клетки
Особенности структуры рРНК: 1) Большая часть структуры рРНК – это биспиральные участки.
2)У эукариот синтезируются кодируемые5S рРНК и 45S рРНК, последняя гидролизуется на три фрагмента – 28S рРНК, 18S рРНК и 5,8S рРНК.
3)В комплексе с белком образует рибосому.
Функции рРНК – аутокаталитическое созревание, обеспечение рибосомного биосинтеза белков.
Особенности структуры тРНК
1)Самые маленькие из НК.
2)60 % нуклеотидов – гуанин и цитозин.
3)60 % нуклеотидов спарены и образуют шпильки и петли.
4)5'-концом всегда является гуаниловая (редко цитидиловая) кислота со свободным остатком фосфата у С-5'.
5)На противоположном конце – ЦЦА, к которому присоединяется активированная аминокислота с образованием аминоацил-тРНК.
Функции тРНК – связывание аминокислоты, закодированной в структуре антикодона тРНК, доставка ее к месту синтеза.
14) Современное представление о механизме ферментативного катализа (на примере гидролиза ацетилхолина холинэстеразой)
Основная функция ферментов заключается в снижении энергии активации и повышении скорости химических реакций в соответствии с потребностями живого организма.
