
Ответы на зачет / зачет все ответы
.pdf
34-Цикл Кребса его биологическая роль Цикл трикарбоновых кислот-универсальных метаболический процесс осуществ. В митохондриях с
целью сжигания Ацетил-КоА не зависит от источника его происхождения.
В цикле Кребса представляет систему осуществляющую распад продуктов метаболизма и вырабатывающую в ходе этого расщепления основную часть энергии необходимую для организма. В этом цикле идет подготовка субстратов для дыхательной цепи в процессе распада уксусной кислоты отдельные продукты используются для анаболизма продукты: НАДН2-6 ФАДН2-2 СО2-4 ГТф-2
Ферменты:1- цитрат синтетаза 2- аконитаза 3,4- изоцитрат дегидрогеназа 5- мультифермент альфакетоглутарат дегидрогеназа комплекс 6- сукцинат синтетаза 7-сукцинат дегидрогеназа 8- фумараза 9-малат дегидрогеназа
Оксалоацетат под действием фермента (1) превращается в цитрат реакция необратимая Цитрат превращается в Цис аконитат под действием фермента (2)обратимая Цис аконитат в изоцетрат под действием фермента (3)
изоцитрат в альфакетоглутарат (необратимой окисление) (4) альфакетоглутарат в сукцинил-КоА (5)
сукцинил-КоА в сукцинат(6) сукцинат в фумарат(7) фумарат в малат(8)
малат в оцсалоцалетат(9)

35энергетический эффект аэробного окисления глюкозы 1 этап-гликолиз происходит в цитоплазме из 10 реакций всего одна окислительная 6 её
осуществляет фермент глицеральдегидфосфатдегидрогеназа в результате реакций ГАФ окисляется а НАД+ в составе фермента восстанавливается и превращается в НАДН+ но так как окисляется 2 ГАФа то образуется 2 молекулы 2НАДН+ также образуется 4 молекулы АТФ 2 тратятся в 1 и 2 реакциях образуются в 7 и 10 2-этап окислительное декарбоксилирование пирувата в митохондриях осуществляет 3 фермента 5
коферментов в ходе процесса пируват теряет карбоксильную группу и мы получаем CO2 пируват также теряет Н+ которая оказывается у кофермента НАДН+ главный продукт процесса ацетил-КоА подведем итог 2CO2 2 ацетил-КоА 2НАДН+
этап 3 цикл кребса главная задача окислить ацетил-КоА до СО2 окислительные реакции 4 5 7 9 происходит дегидрирование в 4 5 декарбоксилирование выделяется CO2 две молекулы ацетилКоА окисляются до 4 CO2 мы получаем 6 молекул HAДН2 и 2 ФАДН2
итог гликолиз 8 атф окис декарбоксилирование 6 атф цикл Кребса 24 атф
36-Пентозный путь окисления глюкозы это альтернативный путь окисления глюкозы к синтезу атф не приводит этот процесс поставляет
клеткам кофермент НАФН2 наиболее важными процессами в которых он необходим являются:синтез высших жирных кислот синтез холестерина микросомальное окисление . Все ферменты пентозофосфатного пути локализованы в цитозоле можно выделить окислительные и неокислительный этап образование пентоз Окислительный этап поставляет клеткам два основных продукта НАДФН2 пентозы Образование
пентоз включает две реакции дегидрирования . Кофермент дегидрогеназ является НАДФ+ который восстанавливается до НАДФН2 Ключевым ферментом данного процесса является глюкозо-6-фосфатдегидрогеназа Неокислительный этап служит для синтеза различных модификаций углеродов включая и
пентозы. На этом этапе обратимые реакции переноса 2 и 3 углеродных фрагментов с одной

молекулы на другую. В этих превращениях принимают участие ферменты пентозофосфатизомеразы, транскетолазы, трансальдолазы. Транскетолаза в качестве кофермента использует тиаминдифосфат(ТДФ) неокислительный этап образования пентоз обратим следовательно он может служить для образования гексоз и пентоз этот путь наиболее активно функционирует в печени жировой ткани молочной железе коре надпочечников гонадах эритроцитах 2ВАРИАНТА СХЕМЫ ТК В ТЕТРАДКЕ ФЕРМЕНТЫ НЕКОТОРЫЕ

37) Регуляция углеводного обмена
У высших организмов обмен углеводов подвержен сложным механизмам регуляции, в которых участвуют гормоны, метаболиты и коферменты.
Одной из важнейших функций клеток печени является накопление избыточной глюкозы в виде гликогена и ее быстрое высвобождение по мере метаболической необходимости (буферная функция). После полной мобилизации запасов гликогена печень может поставлять глюкозу за счет синтеза (глюконеогенез). Кроме того, как и все ткани, она потребляет глюкозу путем гликолиза. Функции накопления (синтеза) глюкозы в виде гликогена и его распада должны быть взаимосогласованы. Таким образом, совершенно невозможно одновременное протекание гликолиза и глюконеогенеза, как и синтеза и деградации гликогена. Согласование процессов обеспечивается тем, что синтез (анаболизм) и распад (катаболизм) катализируются двумя различными ферментами и контролируются независимо.
Гормоны. К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин и глюкагон, глюкокортикоид кортизол и катехоламин адреналин. Инсулин индуцирует синтез гликогенсинтазы (гликогенез), а также некоторых ферментов гликолиза. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза. Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза и репрессирует пируваткиназу, ключевой фермент гликолиза. Другие эффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ. По этому механизму тормозится синтез гликогена и активируется расщепление гликогена (гликогенолиз). Торможение пируваткиназы глюкагоном также обусловлено взаимопревращением ферментов. В присутствии адреналина и глюкагона в клетках печени повышается уровень цАМФ, т.е. оба гормона воздействуют как на гликолиз, так и на глюконеогенез.
Глюкокортикоиды, прежде всего кортизол, индуцируют все ключевые ферменты глюконеогенеза. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ и цитрата тормозят гликолиз путем аллостерической регуляции фосфофруктокиназы. Кроме того, АТФ тормозит пируваткиназу. Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы (торможение конечным продуктом). АМФ, сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Фруктозо-2,6-дифосфат. Важную роль в обмене веществ в печени играет фруктозо-2,6-дифосфат. Это сигнальное вещество образуется в незначительных количествах из фруктозо-6-фосфата и выполняет чисто регуляторную функцию: стимулирует гликолиз путем активации фосфофруктокиназы и подавляет глюконеогенез с помощью торможения фруктозо-1,5- дифосфатазы.
38) Современное представление о биологическом окислении. Пути биологического окисления.
Согласно современной теории БО:
·Окисление происходит как в аэробных, так и в анаэробных условиях.
·В аэробных организмах существует несколько путей использования О2
·Реакции БО необходимы в первую очередь для получения энергии в форме АТФ, а также для синтеза новых веществ, разрушения ксенобиотиков и продуктов метаболизма.
·БО является сложным, многостадийным процессом, в котором ведущую роль играют ферменты оксидоредуктазы.
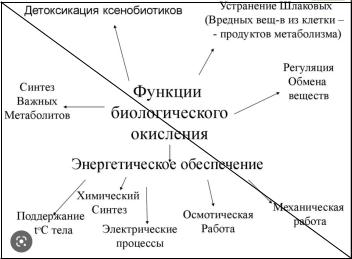
Биологическое окисление (БО) совокупность окислительно-восстановительных реакций, которые протекают во всех живых клетках.
Субстрат БО – вещество, способное отдавать электрон. (Любые вещества, способные вступать в реакции окисления).
Дыхательная цепь – цепь переноса электронов. В переносе электронов от субстратов БО к О2 принимают участие: 1) НАД и НАДФ зависимые ДГ; 2) ФАД и ФМН зависимые ДГ; 3) цитохромы; 4) коэнзим Q; 5) белки, содержащие негемное железо.
Существует несколько путей биологического окисления:
1.Оксидазный (субстрат – вещества, образующиеся в рузельтате внутриклеточного метаболизма, способные отдавать электроны, ферменты – оксидоредуктазы, коферменты – НАД+)
2.Оксигеназный ( ферменты – оксидоредуктазы, оксигеназы, кислород встраивается в молекулу субстрата, цитохромы, кофермент - гем)
3.Пероксидазный( фермент – НАДФН2 – оксидазы, в пероксисомах или клетках способных к фагоцитозу)
4.Свободнорадикальный (активные формы кислорода, вещества, имеющие неспаренный электрон)
39)Оксигеназный путь биологического окисления.
В некоторых тканях содержатся ферменты, катализирующие особые окислительновосстановительные реакции, в которых атомы кислорода включаются непосредственно в молекулу субстрата с образованием, например, новой гидроксильной или карбоксильной группы. Эти ферменты называются оксигеназами. Имеются два класса оксигеназ: диоксигеназы и монооксигеназы. Диоксигеназы катализируют реакции, в которых в молекулу субстрата включаются оба атома кислорода. Энергия в этих реакциях не образуется.
Наиболее многочисленны и особенно сложны монооксигеназые реакции, в которых участвуют цитохром Р-450, принадлежащий к группе гемопротеинов. Подобно митохондриальной цитохромоксидазе, цитохром Р-450 способен взаимодействовать с кислородом и с окисью углерода. Этот цитохром обычно содержится не в митохондриях , а в эндоплазматическом ретикулуме.
Биологическая роль микросомального окисления исключительно велика : гидроскилирование стеройдных гормонов ; обезвреживание ряда лекарственных препаратов и других чужеродных для организма веществ, особенно если эти вещества сравнительно плохо растворимы в воде . Гидроксилирование чужеродных веществ( ксенобиотиков) способствет их дектоксикации и выведению их организма.
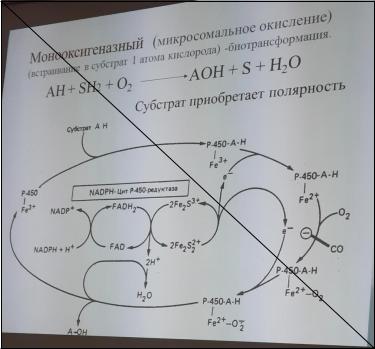
Монооксигеназам требуется два субстрата: главный субстрат, присоединяющий один атом кислорода, и косубстрат, поставляющий атомы водорода до воды. Поскольку в этих реациях главный субстрат гидроксилируется, эту группу ферментов называют гидроксилазами или оксигеназами. Монооксигеназы могут использовать в качестве косубстрата восстановленные коферменты НАДФН2 или ФАДН2.
Ферменты – оксидоредуктазы, оксигеназы
40) Оксидазный путь биологического окисления.
Оксидазный путь потребления кислорода протекает в митохондриях, потребляет 90% О2и обеспечивает процесс окислительного фосфорилирования. Окислительным фосфорилированием называют синтез АТФ из АДФ и Н3РО4 за счет энергии движении электронов по дыхательной цепи. Окислительное фосфорилирование является основным источником АТФ в аэробных клетках.
Процесс окисления происходит при движении электронов по дыхательной цепи от субстратов тканевого дыхания на кислород. Дыхательная цепь окислительного фосфорилирования состоит из 4 белковых комплексов, встроенных во внутреннюю мембрану митохондрий и небольших подвижных молекул убихинона и цитохрома С, которые циркулируют в липидном слое мембраны между белковыми комплексами.
Комплекс I – НАДН2 дегидрогеназный комплекс – самый большой из дыхательных ферментных комплексов – имеет молекулярную массу свыше 800КДа, состоит из более 22 полипептидных цепей, в качестве коферментов содержит ФМН и 5 железо-серных (Fe2S2 и Fe4S4) белков.
Комплекс II – СДГ. В качестве коферментов содержит ФАД и железо-серный белок.
Комплекс III – Комплекс b-c1 (фермент QH2 ДГ), имеет молекулярную массу 500КДа, состоит из 8 полипептидных цепей, и вероятно существует в виде димера. Каждый мономер содержит 3 гема, связанных с цитохромами b562, b566, с1, и железо-серный белок.
Комплекс IV – Цитохромоксидазный комплекс имеет молекулярную массу 300КДа, состоит из 8
полипептидных цепей, существует в виде димера. Каждый мономер содержит 2 цитохрома (а и а3) и 2 атома меди.
Коэнзим Q (убихинон). Липид, радикал которого у млекопитающих образован 10 изопреноидными единицами (Q10). Убихинон переносит по 2Н+ и 2е-.
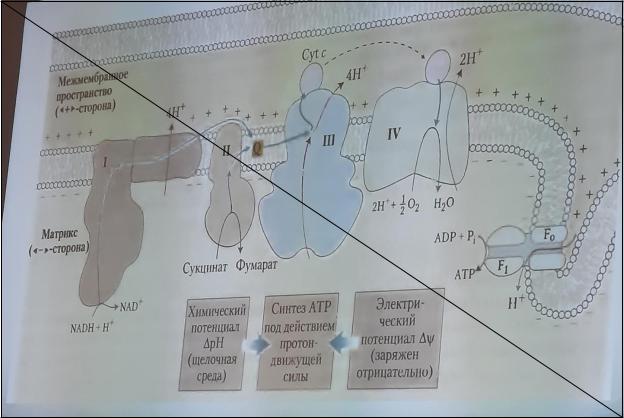
Цитохром с. Периферический водорастворимый мембранный белок с массой 12,5КДа, содержит 1 полипептидную цепь из 100 АК, и молекулу гема.
Этапы движения е- по дыхательной цепи
1.2е- от НАДН2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н+(механизм переноса Н+ неизвестен).
2.КоQ с 2е- забирает у воды 2Н+ из матрикса и превращается в КоQН2 (восстановление КоQ проходит также с участием комплекса II).
3.КоQН2 переносит 2е- на комплекс III, а 2Н+ в межмембранное пространство.
4.Цитохром С переносит е- c III комплекса на IV комплекс.
5.IV комплекс сбрасывает е- на О2, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+неизвестен).
41. Окислительное фосфорилирование. Роль отечественных ученых в изучении этого процесса.
Процесс сопряжения работы дыхательной цепи ( или тканевого дыхания ) и фосфорилирования получила название – окислительного фосфорилирования.
Важную роль в процессе окислительного фосфорилирования играет фермент, встроенный во внутреннюю мемьрану митохондрий; - АТФ – синтаза. Этот ферментный комплекс состоит из двух главных компанентов : Fo и F1. Компанент F1 напоминает “ шляпку гриба” обращенную в сторону матрикса митохондрий “ Шляпка”, чаще называемой головкой , с помощью ножки прикреплена к компоненту Fo, который встроен во внутреннюю мемьрану и пронизывает ее насквозь. Именно эту часть молекулы АТФ – синтазы связывает токсичный антибиотик олигомицин – мощный ингибитор этого фермента и следовательно ингибитор окислительного фосфорилирования.
Впервые в начале 30 – х годов профессор В.А. Энгельгард высказал предположение о наличии сопряжения между фосфолирированием АДФ в аэробном дыхании. Позже В.А.Белицер и соавт. Показали, что синтез АТФ из АДФ и H3PO4, осуществляется в митоходриях при миграции электродов от субстрата к кислороду через цепь дыхательных коферментов. При этом было показано, что отношение Р\О, т.е. число молекул неорганического фосфата, перешедших в органическую форму ( АТФ) в расчете на каждый поглощенный атом кислорода равно около 3-х. Далее, было установлено, что уменьшение свободной энергии системы при переносе пары электронных эквивалентов от НАДН2 к молекулярному кислороду составляет 220 кДж. ( 52, 7 ккал). Величина стандартной свободной энергии образования АТФ из АДФ и H3PO4 находиться в пределах 30, 2 кДж,т.е. 7,3 ккал.
На основании данных термодинамики была предсказана локализация трех пунктов окислительного фосфорилирования в дыхательной цепи( Ленинджер А., 1980, 1985г.).
По А. Ленинджеру, на трех этапах синтеза АТФ из АДФ и , H3PO4 количество выделяющейся свободной энергии приблизительно совпадает со свободной энергией образования АТФ. Дыхательная цепь представляет собой своего рода « каскал», при помощи которого клетка получает свободную энергию для использования ее на различные виды « работ».
42. Влияние различных ядов на тканевое дыхание. Назвать разобщители тканевого дыхания и окислительного фосфорилирования.
Нормальной работе электронно-транспортной цепи можно легко помешать и не создавая препятствий к поступлению кислорода: значительная информация о дыхательной цепи была получена при использовании различных ингибиторов. Существует целая плеяда веществ, одни рассматриваются как разобщители процессов окисления и фосфорилирования, т.е. цепь работает, но АТФ не образуется, другие называются ингибиторами цепи. Эти вещества препятствуют нормальному движению электронов по цепи, т.е. препятствуют созданию разности потенциалов на мембране.
Ингиборы можно разделить на три группы : ингиборы соответственно дыхательной цепи, ингибиторы окислительного фосфорилирования и разобщители окислительного фосфорилирования.. Ингибиторы , блокирующие дыхательную цепь, по –видимому , действуют в трех местах. Однако из них ингибируются барбитуратами ( например , аминобарбиталом, люминалом),а также антибиотиком пиерицидином А и высокотоксичным веществом, добываемое из растений ротеноном. Эти ингибиторы препятствуют окислению субстратов, которые поставляют окислительные эквиваленты в дыхательную цепь при участии НАД – зависимых дегидрогеназ.
Ротенон – растительный токсин, используемый в качестве инсектицида.
Амитал (аминобарбитал) – производное барбитуровой кислоты.
Антимицин А, олигомицин – антибиотики.
Демерол – синтетический опиоидный анальгетик.
Карбокин (карбоксим) реактиватор холинэстеразы
Теноилтрифторацетон – хелатирующий агент, ингибитор хинонов
2,4-динитрофенол – анттисептик древесины. Мембранный ионофор.
Дикумарол (дикумарин) – антикоагулянт непрямого действия
Димеркаптол и аптимицин А ингибируют дыхательную цепь на участке м ингибируют дыхательную цепь на участке между цитохромом в и цитохромом с.
Классические яды - сероводород (Н2S), окись углерода ( СО) и цианид ( СN-) – ингибируют цитохромоксидазу ( цитохром аа3). Карбоксин и ТТFA( теноилтрифторацетон) специфически ингибируют переход восстановительных эквивалентов от сукцинатдегидрогеназы на кофермент Q. Малонат является контурентным ингибитором сукцинатдегидрогеназы( со стр. 47.)
Антибиотик олигомицин полностью блокирует окисление и фосфорилирование. Однако, если вместе с олигомицином добавить к системе интактных митохондрий динитрофенол, то окисление протекает, но без фосфорилирования . Это означает, что олигоцитин не действует непосредственно на дыхательную цепь, а подавляет стадию фосфорилирования.
Атрактилозид ингибирует окислительное фосфорилирование, блокируя транспорт адениновых нуклеозидов через внутреннюю митохондриальную мембрану. Он ингибирует транспорт АДФ в митохондрии и выход АТФ из них.
Большая группа разобщителей нарушает систему сопряжения процессов окисления в дыхательной цепи и фосфорилирования. В этих условиях процесс дыхания происходит неконтролируемым образом , поскольку концентрация АДФ и Фн не являются лимитирующими. Чаще всего в качестве разобщителей используют 2,4 – динитрофенол; аналогичное действие оказывает ряд других соединений – динитрокрезол, пентахлорфенол, карбонилцианид – м -хлорфенилгидразон. Последний по эффективности в 100 раз превосходит динитрофенол.
43. Пероксидазный путь биологического окисления, субстраты, ферменты и коферменты этого пути биологического окисления.
Перекиси разлагаются в пероксисомах, в основном под влиянием каталазы или пероксидазы. Иногда такой путь окисления назвают пероксидазным.
Окисление субстрата путем дегидрирования. Два атома водорода переносятся на молекулу кислорода с образованием перекиси.
В этой реакции энергия окисления выделяется в виде тепла. Реакции этого типа катализируют ФАД-зависимые оксидазы (аэробные дегидрогеназы), содержащие в качестве простетической группы ФАД или ФМН. В клетке около 80 % этих ферментов сосредоточено в пероксисомах. Пероксидазный путь окисления активно протекает в лейкоцитах, макрофагах и других фагоцитирующих клетках. Образующийся пероксид водорода Н2О2 – сильный окислитель, обезвреживающий патогенные бактерии (защитная функция).
Реакция пероксидазного окисления протекает в 2 стадии:
1)Анаэробная - происходит дегидрирование восстановленного субстрата SH2, при этом протоны и электроны переносятся на ФАД (ФАД + 2Н+ → ФАДН2).
2)Аэробная - происходит окисление фермента (ФАДН2 → ФАД) кислородом (самопроизвольный процесс).
