
Ответы на зачет / зачет все ответы
.pdf
54. Биосинтез фосфолипидов и триглицеридов в тканях.
Триглицериды синтезируются в стенке кишечника, в печени и жировой ткани (в адипоцитах). Синтез триглицеридов в стенке кишечника может происходить из моноглицерида (из 2-моноацилглицерола) и двух молекул активных жирных кислот (остатки жирных кислот в комплексе с ацилпереносящим энзимом – S-КоА), или из глицерина и трех молекул активных жирных кислот с участием АТФ, что более характерно для процессов в печени и жировой ткани. Синтез жира из глицерина и жирных кислот в печени и жировой ткани происходит по следующему пути. Глицерин фосфорилируется с использованием АТФ до глицерофосфата (фермент глицеролкиназа), затем под действием фермента глицеролфосфатацилтрансферазы взаимодействует с двумя молекулами ацилкоэнзима-А (например, с пальмитил-КоА). Образуется фосфатидная кислота (3-фосфо-1,2-диацилглицерол). При взаимодействии последней с ацилкоэнзимом -А образуется триглицерид, свободный HS-КоА и остаток ортофосфорной кислоты. Печень – основной орган, где идет синтез жирных кислот из продуктов гликолиза. Основной путь синтеза триглицелидов в печени из жирных кислот и глицерофосфата. Глицерофосфат, в свою очередь, в печень поступает из гидролиза жиров, а так же при восстановлении диоксиацетонфосфата (из гликолиза) при помощи восстановленного НАДФ (НАДФ Н+Н).
Фосфолипиды синтезируются во всех клетках, содержащих ядро. Существует несколько путей синтеза глицерофосфолипидов. Рассмотрим синтез фосфатидилсерина и кефалина из фосфатидной кислоты и синтез лецитина из диглицерида и холина. Прежде чем холин вступит в синтез лецитина, происходит фосфорилирование холина и присоединение холина к нуклеотиду. При взаимодействии диацилглицерола с ЦДФхолином синтезируется лецитин и освобождается цитидинмонофосфат (ЦМФ). При отсутствии готового холина синтез фосфолипидов происходит на основе фосфатидной кислоты и аминокислоты серина, образуется фосфотидилсерин. При декарбоксилировании фосфатидилсерина образуется кефалин. Для синтеза лецитина из кефалина необходимо присоединить к азоту три метильных радикала. Источником метильных радикалов служит метионин в активной форме (S-аденозилматионин) с которого фермент метилтрансфераза переносит группу -CH3 на кефалин.
55. Биосинтез холестерина.
Биосинтез холестерина, кап и всех изопреноидов, начинается с ацетил-КоА (см. с. 58). Углеродный скелет С27-стерина строится из С2-звеньев в длинной и сложной последовательности реакций. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе из трех молекул ацетил-КоА образуется мевалонат (С6). На втором этапе мевалонат превращается в «активный изопрен», изопентенилдифосфат. На третьем этапе шесть молекул изопрена полимеризуются с образованием сквалена (С30). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин. На схеме представлены только наиболее важные промежуточные продукты биосинтеза.
1. Образование мевалоната. Превращение ацетил-КоА в ацетоацетил-КоА и затем в З- гидрокси-З-метилглутарил-КоА (3-ГМГ-КоА) соответствует пути биосинтеза кетоновых тел, однако этот процесс происходит не в митохондриях, а в эндоплазматическом ретикулуме (ЭР). 3-ГМГ-КоА восстанавливается с отщеплением кофермента А с участием 3-ГМГ-КоА-редуктазы, ключевого фермента биосинтеза холестерину (см. ниже). На этом важном этапе путем репрессии биосинтеза фермента (эффекторы: гидроксистерины), а также за счет взаимопревращения молекулы фермента (эффекторы: гормоны) осуществляется регуляция биосинтеза холестерина. Например, фосфорилированная
редуктаза представляет собой неактивную форму фермента; инсулин и тироксин стимулируют фермент, глюкагон тормозит; холестерин, поступающий с пищей, также подавляет 3-ГМГ-КоА-редуктазу.
2.Образование изопентенилдифосфата. Мевалонат за счет декарбоксилирования с потреблением АТФ превращается в изопентенилдифосфат, который и является тем структурным элементом, из которого строятся все изопреноиды
3.Образование сквалена. Изопентенилдифосфат подвергается изомеризации с образованием диметилаллилдифосфата. Обе С5-молекулы конденсируются в геранилдифосфат и в результате присоединения следующей молекулы изопентенилдифосфата образуют фарнезилдифосфат. При димеризации последнего по типу «голова к голове» образуется сквален. Фарнезилдифосфат является также исходным соединением для синтеза других полиизопреноидов, таких, как долихол и убихинон ).
4.Образование холестерина. Сквален, линейный изопреноид, циклизуется с потреблением кислорода в ланостерин, С30-стерин, от которого на последующих стадиях, катализируемых цитохромом Р450, отщепляются три метильные группы, вследствие чего образуется конечный продукт — холестерин.
Описанный путь биосинтеза локализован в гладком ЭР. Синтез идет за счет энергии, освобождающейся при расщеплении производных кофермента А и энергетически богатых фосфатов. Восстановителем при образовании мевалоната и сквалена, а также на последних стадиях биосинтеза холестерина является НАДФН + Η+. Для этого пути характерно то, что промежуточные метаболиты можно подразделить на три группы: производные кофермента А, дифосфаты и высоко липофильные соединения (от сквалена до холестерина), связанные с переносчиками стеринов.
56. Липопротеины крови
Липопротеи ны (липопротеиды) — класс сложных белков, простетическая группа которых представлена каким-либо липидом. Так, в составе липопротеинов могут быть свободные жирные кислоты, нейтральные жиры, фосфолипиды, холестериды.
Липопротеины представляют собой комплексы, состоящие из белков (аполипопротеинов; сокращенно — апо-ЛП) и липидов, связь между которыми осуществляется посредством гидрофобных и электростатических взаимодействий.
Липопротеины подразделяют на свободные, или растворимые в воде (липопротеины плазмы крови, молока и др.), и нерастворимые (структурные)-(липопротеины мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений).
Среди свободных липопротеинов (они занимают ключевое положение в транспорте и метаболизме липидов) наиболее изучены липопротеины плазмы крови, которые классифицируют по их плотности. Чем выше содержание в них липидов, тем ниже плотность липопротеинов. Различают липопротеины очень низкой плотности (ЛПОНП), низкой плотности (ЛПНП), высокой плотности (ЛПВП) и хиломикроны. Каждая группа липопротеинов очень неоднородна по размерам частиц (наиболее крупные — хиломикроны) и содержанию в ней апо-липопротеинов. Все группы липопротеинов плазмы содержат полярные и неполярные липиды в разных соотношениях. -Липопротеины высокой плотности (ЛВП)-Транспорт холестерина от периферийных тканей к печени -Липопротеины низкой плотности (ЛНП)-Транспорт холестерина, триацилглицеридов и
фосфолипидов от печени к периферийным тканям -Липопротеины промежуточной (средней) плотности ЛПП (ЛСП)-Транспорт холестерина,
триацилглицеридов и фосфолипидов от печени к периферийным тканям

-Липопротеины очень низкой плотности (ЛОНП)-Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям -Хиломикроны-Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень.
Нековалентная связь в липопротеинах между белками и липидами имеет важное биологическое значение. Она обусловливает возможность свободного обмена липидов и модуляцию свойств липопротеинов в организме.
Липопротеины являются:
структурными элементами мембран клеток животных организмов; транспортными белками, транспортирующими холестерин и другие стероиды, фосфолипиды и др.
57. Перекисное окисление липидов в тканях. Про - и антиоксидантная системы клеток.
Среди первичных механизмов повреждения клеток при окислительном стрессе лидирует перекисное окисление жирных кислот в фосфолипидах мембран. Это снижает их гидрофобность и нарушает устойчивость мембран, изменяет работу мембраносвязанных ферментов, повышает проницаемость мембран для ионов.
Реакции взаимодействия свободных радикалов с жирными кислотами получили широкую известность в связи с их актуальностью в пищевой промышленности. Появление неприятного запаха и прогоркание продуктов – это является проявлением перекисного окисления липидов (ПОЛ).
Основным субстратом для свободно-радикальных реакций являются двойные связи полиненасыщенных жирных кислот. В клеточных мембранах полиненасыщенные жирные кислоты находятся в составе фосфолипидов и гликолипидов. Также большое количество фосфолипидов с полиненасыщенными жирными кислотами локализуется в оболочке липопротеинов высокой, низкой и очень низкой плотности, что имеет значение в патогенезе атеросклероза.
Врезультате свободнорадикального окисления жирных кислот образуются
гидроперекиси и диеновые конъюгаты (первичные продукты), которые очень нестабильны. При участии металлов переменной валентности они быстро метаболизируют во вторичные (альдегиды и диальдегиды) и третичные (шиффовы основания) продукты перекисного окисления липидов.
Перекисное окисление липидов включает в себя несколько стадий:
1.Инициация.
2.Развитие.
3.Разветвление.
4.Обрыв цепи.
Вмомент инициации, например, гидроксил-радикалом атакуется метиленовая группа, расположенная между двойными связями, и выбивается атом водорода, восстанавливающий гидроксил-радикал до воды. Далее в жирной кислоте происходит перестановка двойной связи, смещение радикальной группы и взаимодействие ее с кислородом. В результате образуется липопероксильный радикал.
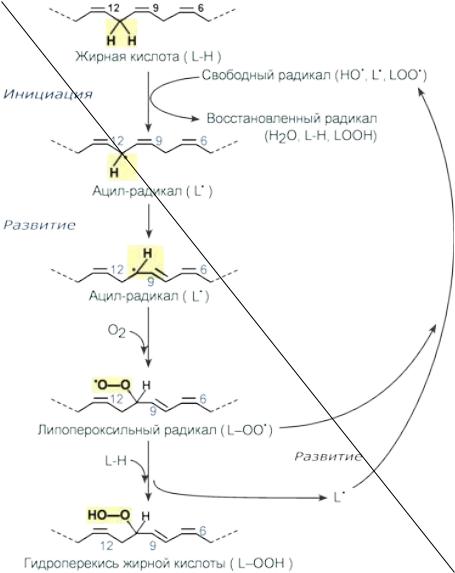
Дальнейшее взаимодействие полученного липопероксильного радикала с соседними жирными кислотами приводит к его нейтрализации и появлению новых липоперекисных радикалов, т.е. к развитию линейной цепной реакции с появлением новых окисленных жирных кислот.
Развитие реакций перекисного окисления липидов
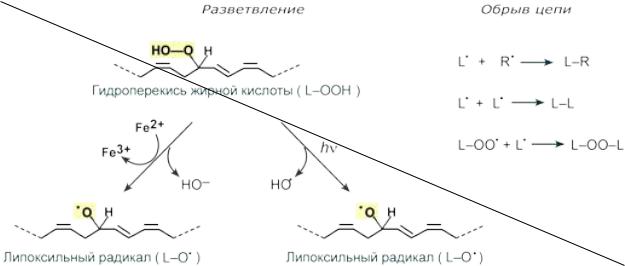
Кроме линейного развития, может происходить ветвление реакции за счет получения гидроперекисью электронов от каких-либо металлов или при воздействии излучения. Разветвление и обрыв реакций перекисного окисления липидов Обрыв цепной реакции происходит при взаимодействии радикалов друг с другом или в
реакции с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в довольно стабильную окисленную форму. Продукты перекисного окисления липидов
Первичными продуктами ПОЛ являются гидроперекиси жирных кислот, они подвергаются дальнейшему распаду с образованием вторичных продуктов ПОЛ – различных спиртов, кетонов, альдегидов и диальдегидов, эпоксидов и других соединений.
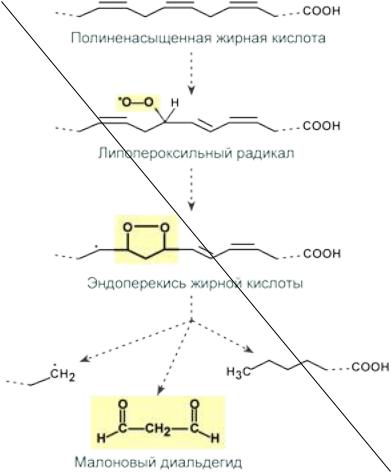
Наиболее реакционноспособным из вторичных продуктов ПОЛ является малоновый диальдегид (МДА), который способен образовывать ковалентные связи с NH2-группами белков и иных молекул с образованием шиффовых оснований.
Схема реакций образования малонового диальдегида Роль малонового диальдегида
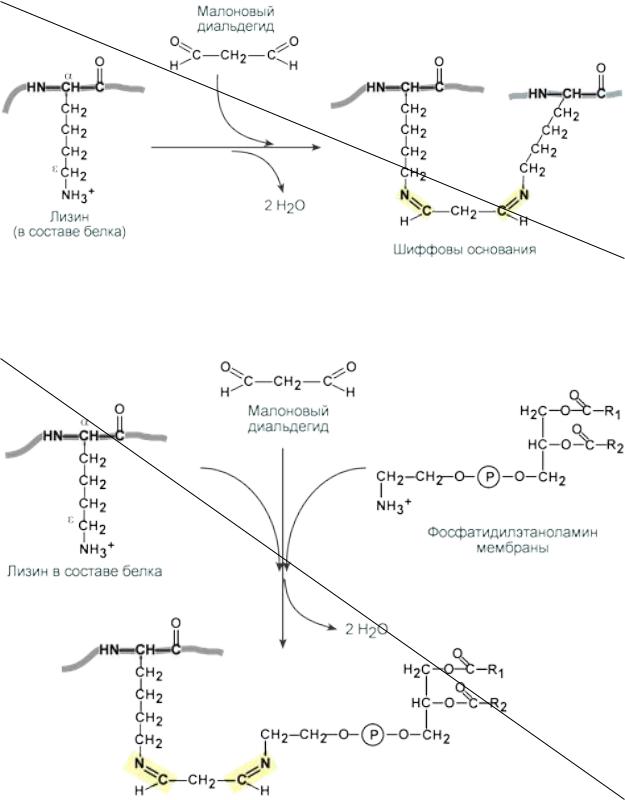
Малоновый диальдегид (МДА), образующийся при перекисном окислении липидов, способен реагировать с ε-NH2-группами лизина или N-концевыми аминокислотами белков, с NH2-группами фосфолипидов и гликозаминов. МДА формирует мостики внутри молекул и между ними с образованием шиффовых оснований.
Роль малонового диальдегида в образовании сшивок между белками
Роль малонового диальдегида в образовании сшивок между белками и фосфолипидами
В конечном результате после окислительной атаки в белках появляются поперечные сшивки внутри одной молекулы, между разными белками, между белками и фосфолипидами. Из-за этого активность ферментативных белков изменяется, возможности структурных и сократительных белков падают, каналообразующие белки мембраны деформируются и проницаемость мембран возрастает, жизнеспособность и функционирование клетки уменьшаются.
1. Ферментативная антиоксидантная система
К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450и пероксисом особенно велико.
Супероксиддисмутаза(СОД) превращает супероксидные анионы в перекись водорода: 2О∙2 + 2H+ → H2O2+ O2
Изоферменты СОД находятся и в цитозоле (Cu2+ иZn2+) и в митохондриях (Mn2+) и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода. СОД — индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется СРО.
Каталаза- геминовый фермент, катализирует реакцию разрушения перекиси водорода. При этом образуется вода и молекулярный кислород:
2Н2О2 → H2O+ O2
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество перекиси водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» и в эритроцитах, где она защищает гем гемоглобина от окисления.
Глутатионпероксидаза— обеспечивает разрушение перекиси водорода и гидропероксидов липидов при окислении глутатиона (у-глутамилцистеинилглицин): Н2О2+ 2 GSH → 2 Н2О + G-S-S-G. Глутатионпероксидаза в качестве кофермента содержит селен.
Глутатионредуктазавосстанавливает окисленный глутатион с участием НАДФН2: GS-SG + НАДФН2 → 2 GSH + НАДФ+.
Недостаток глутатиона в клетках, например эритроцитах, который может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий. Фосфолипазав мембране отщепляет от фосфолипидов окисленные жирные кислоты, содержащие гидроперекисную группу (LOOH), тем самым разрушаются гидроперекиси липидов, предотвращается разветвление цепей окисления липидов в мембранах.
2. Неферментативная антиоксидантная система
Липидные антиоксиданты" - производные фенола, способны инактивировать свободные радикалы в гидрофобном слое мембран и предотвращать развитие ПОЛ. К ним относится α-токоферол (витамин Е), убихинон (коэнзим Q), тироксин и синтетические соединения, например ионол (бутилированный гидрокситолуол).
Витамин Е(α-токоферол) самый распространённый липофильный антиоксидант. Различают 8 типов токоферолов, но α-токоферол наиболее активен. Витамин Е отдаёт
атом водорода радикалу липида ROO∙, восстанавливает его до гидропероксида (ROOH), прерывает ПОЛ, а сам превращается в свободный радикал.
Свободный радикал витамина Е стабилен и не поддерживает ПОЛ, он взаимодействует с радикалами липидных перекисей, восстанавливает их, а сам превращается в стабильную окисленную форму — токоферолхинон.
Витамин Сингибирует СРО с помощью двух различных механизмов: 1). восстанавливает в мембранах клеток токоферолхинон до витамина Е; 2). взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ин-гибирует ПОЛ.
Соединения, связывающие железо. Большинство из них, включая такие природные соединения как дипептид карнозин, не просто связывают железо, но, самое главное, не дают ему возможности приникнуть в липидную фазу мембран, поскольку образующиеся комплексы, в силу своей полярности, не проникают в гидрофобную зону.
Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина.
