
- •1. Понятие о катаболизме и анаболизме. Общая схема катаболизма углеводов, жиров и белков, общий и специфические пути распада.
- •Общая схема катаболизма углеводов, жиров и белков
- •2. Особенности ферментативного катализа. Зависимость скорости ферментативных реакций от температуры рH среды, количества фермента и концентрации субстрата. Константа Михаэлиса.
- •1) Влияние температуры:
- •2) Влияние pH:
- •3) Зависимость от количества фермента:
- •4) Зависимость от концентрации субстрата:
- •5) Константа Михаэлиса:
- •График соотношения констант
- •3. Активный центр и механизм действия ферментов. Специфичность действия ферментов.
- •4. Классификация ферментов, примеры ферментативных реакций каждого класса.
- •5. Кофакторы ферментов и их роль в катализе. Витамины – как предшественники коферментов.
- •6. Ингибирование ферментов: виды, характеристика, примеры. Использование ингибиторов в качестве лекарственных препаратов.
- •Обратимое ингибирование:
- •Конкурентное ингибирование:
- •Неконкурентное ингибирование:
- •Необратимое ингибирование:
- •Особенности строения и функционирования олигомерных белков. Аллостерические ферменты.
- •Строение гема, входящего в состав миоглобина и гемоглобина
- •Аллостерические ферменты
- •8. Аллостерические регуляция активности. Примеры метаболических путей, регулируемых аллостерическими ферментами.
- •Аллостерическая регуляция метаболизма жирных кислот в печени
- •Основные особенности метаболизма в печени в состоянии приема пищи. Аллостерическая регуляция ферментов
- •9. Регуляция активности ферментов: фосфорилирование – дефосфорилирование, роль протеинкиназ и протеинфосфатаз. Примеры метаболических путей, регулируемых такими способами.
- •Механизм фосфорилирования/дефосфорилирования ферментов
- •Механизм фосфорилирования/дефосфорилирования ферментов
- •10. Регуляция активности ферментов: частичный протеолиз, значение в переваривании белков и свертывании крови.
- •Регуляция путем частичного протеолиза.
- •Изоферменты.
- •Распределение и относительное кол-во изоферментов лдг в различных тканях
- •Энзимопатии.
- •Энзимотерапия.
- •Использование ферментов в медицине
- •Характеристика пируватдегидрогеназного комплекса.
- •13. Цикл трикарбоновых кислот (цитратный цикл): последовательность реакций, связь с цпэ, регуляция, биологическая роль.
- •14. Основные пути фосфорилирования адф и использования атф. Цикл адф-фтф.
- •Образование гтф, утф
- •15. Структурная организация дыхательной цепи переноса электронов (цпэ) в митохондриях: ферментные ансамбли, их последовательность расположения.
- •16. Окислительное фосфорилирование в митохондриях. Теория Митчелла. Условия синтеза атф. Коэффициент фосфорилирования р/о.
- •17. Регуляция тканевого дыхания. Дыхательный контроль. Ингибиторы и разобщители тканевого дыхания, примеры.
- •18. Углеводы пищи: структура, переваривание. Механизм трансмембранного переноса глюкозы. Примеры нарушения переваривания углеводов.
- •Основные углеводы пищи
- •Общая схема переваривания углеводов в жкт
- •19. Аэробный гликолиз: последовательность реакций, энергетический эффект, физиологическое значение.
- •Аэробный гликолиз
- •Расход атф
- •Регуляция пируваткиназы в печени
- •20. Анаэробный гликолиз последовательность реакций, энергетический эффект, физиологическое значение.
- •Глицерофосфатный челночный механизм
- •21. Глюконеогенез из молочной кислоты (схема процесса). Глюкозолактатный цикл. Биологическое значение.
- •22. Глюкозонеогенез из аминокислот и глицерина (схема процесса). Глюкозолактатный цикл. Биологическое значение.
- •Примеры вовлечения аминокислот в глюконеогенез
- •Реакции синтеза глюкозы из глицерина
- •23. Регуляция гликолиза и глюконеогенеза в печени.
- •Регуляция процессов гликолиза и глюконеогенеза
- •24. Строение, свойства и биологическая роль гликогена. Биосинтез и мобилизация гликогена, зависимость от ритма питания, гормональная регуляция.
- •Образование удф-глюкозы
- •Химизм реакции гликогенсинтазы
- •Реакция, осуществляемая гликогенфосфорилазой
- •Общая схема реакций расщепления гликогена
- •Активность основных ферментов обмена гликогена в зависимости от условий (промежуточные метаболиты и другие ферменты не показаны)
- •Аденилатциклазный механизм активации фосфорилазы
- •25. Пентозофасфатный путь превращения глюкозы: окислительные реакции, представление о неокислительном пути синтеза пентоз, распространение, физиологическое значение.
- •26. Переваривание и всасывание пищевых жиров. Ресинтез жиров в клетках кишечника, транспорт кровью, усвоение тканями. Роль желчи при переваривании и всасывании липидов.
- •Регуляция
- •28. Биосинтез жирных кислот: последовательность реакций, регуляция, зависимость от ритма питания, биологическая роль.
- •Синтез пальмитиновой кислоты
- •Этапы синтеза пальмитиновой кислоты
- •29. Синтез жиров из углеводов в печени и жировой ткани, биологическая роль, гормональная регуляция.
- •30. Мобилизация жиров из жировой ткани, биологическая роль, гормональная регуляция.
- •31. Синтез и использование кетоновых тел: последовательность реакций, биологическое значения, схема обмена. Причины и последствия кетонемии.
- •Строение кетоновых тел
- •Синтез кетоновых тел
- •32. Холестерол: строение, функции, баланс в организме, синтез (последовательность реакций до мевалоновой кислоты), регуляция синтеза.
- •Холестерол
- •Реакции синтеза мевалоновой кислоты
- •33. Гиперхолестеролемия: причины, последствия. Биохимические основы патогенеза атеросклероза и основные подходы к лечению.
- •34. Желчные кислоты: особенности строения, функции, синтез, энтерогепатическая циркуляция. Желчно-каменная болезнь.
- •Синтез первичных желчных кислот
- •Конъюгация желчных кислот с глицином и таурином на примере холевой кислоты
- •Регуляция синтеза желчных кислот в печени
- •Образование вторичных жирных кислот в кишечнике
- •Энтерогепатическая циркуляция желчных кислот
- •35. Хиломикроны (хм): образование, состав, функции, схема обмена. Гиперхиломикронемия.
- •Транспорт экзогенных и эндогенных триацилглицеролов
- •36. Липопротеины очень низкой плотности (лпонп): образование, состав, функции, схема обмена. Гипертриглицеролемии.
- •37. Липопротеины низкой плотности (лпон): образование, состав, функции, схема обмена. Гиперхолестеринемия.
- •Липиды и липидный транспорт
- •Положение рецептора лпнп в норме и при нарушении его структуры
- •38. Липопротеины выской плотности (лпвп): образование, состав, функции, схема обмена. Роль лхат.
- •Образование липопротеинов высокой плотности зрелых (лпвПз)
- •Метаболизм лпвп
- •39. Полноценные и неполноценные белки. Значение полноценного белкового питания для человека. Схема переваривания белков в желудочно-кишечном тракте: ферменты, их активация, биологическое значение.
- •40. Трансаминирование аминокислот: ферменты, роль витамина в6 в реакциях трансаминирования, биологическое значение процесса. Диагностическое значение определения активности трансаминаз.
- •41. Дезаминирование аминокислот: типы, роль глутаматдегидрогеназы в реакциях, дезаминирования. Биологическое значение.
- •42. Пути обмена безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Глюконеогенез из аминокислот, значение процесса.
- •43. Декарбоксилирование аминокислот (глу, три) в тканях. Обезвреживание биогенных аминов в печени с участием ферментов мао и дао.
- •44. Пути образования и обезвреживания аммиака в тканях. Токсичность аммиака. Гипераммониемии: причины и следствия.
- •45. Биосинтез мочевины: схема процесса, биологическое значение.
- •46. Гниение белков в толстом кишечнике и обезвреживание продуктов гниения в печени с участием удфгк и фафс.
- •Реакции превращения ароматических аминокислот в толстом кишечнике
- •Реакции превращения лизина и аргинина в толстом кишечнике
- •Строение активных форм глюкуроновой и серной кислот
- •47. Синтез катехоламинов: роль витамина в6 и метионина. Катаболизм катехоламинов. Роль s-аденозилметионина в реакциях метилирования.
- •Реакции синтеза катехоламинов
- •Синтез и регуляция секреции катехоламинов
- •Катаболизм катехоламинов
- •48. Распад фенилаланина и тирозина в разных тканях: схема процессов. Фенилкетонурия, альбинизм, алкаптонурия.
- •Реакция превращения фенилаланина в тирозин
- •49. Аденилатциклазная система передачи сигналов в клетки, роль g-белков в механизме трансдукции сигнала, вторичные посредники.
- •Упрощенная схема аденилатциклазного механизма действия гормонов
- •Инозитолфосфатная система
- •52. Адреналин: строение, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на метаболизм в тканях-мишенях.
- •Реакции синтеза котехоламинов
- •Регуляция секреции катехоламинов
- •53. Глюкагон: химическая природа, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на метаболизм в тканях-мишенях.
- •54. Инсулин: химическая природа, этапы биосинтеза, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на метаболизм в тканях-мишениях.
- •Структура проинсулина (справа) и инсулина (слева)
- •Активация рецептора инсулина - тирозиновой протеинкиназы
- •Общее представление о двух механизмах действия инсулина
- •Обмен углеводов
- •Обмен липидов
- •Обмен белков
- •55. Кортизол: строение, этапы биосинтеза, регуляция секреции, механизм передачи сигнала, влияние на метаболизм в тканях-мишенях.
- •Внутриклеточная локализация синтеза кортизола.
- •Строение глюкокортикоидов
- •56. Инсулин зависимый и инсулин независимый сахарный диабет: изменения гормонального статуса, метаболизма веществ и лабораторная диагностика.
- •Этиология инсулин-зависимого сд
- •Этиология инсулин-незвависимого сд
- •График изменения концентрации глюкозы
- •Типы гликемических кривых после нагрузки глюкозой
- •Структура тироксина и трийодтиронина
- •Регуляция секреции йодтиронинов
- •58. Вазопрессин: химическая природа, регуляция секреции, механизм передачи сигнала, влияние на метаболизм в клетках-мишенях. Несахарный диабет.
- •Структура вазопрессина
- •59. Альдостерон: химическая природа, синтез, регуляция секреции, механизм передачи сигнала, влияние на метаболизм в клетках-мишенях.
- •Структура альдостерона
- •60. Ренин-ангиотензин-альдостероновая система (раас): схема, биологическое значение. Биохимические основы использования ингибиторов апф при лечении почечной гипертонии.
- •Механизм дейсвтия ренин-ангиотензин-альдостероновой системы
- •61. Паратгормон: химическая природа, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на обмен ионов кальция и фосфатов.
- •62. Кальцитонин: химическая природа, регуляция секреции, ткани-мишени, механизм передачи сигнала, вляиние на обмен ионов кальция и фосфатов.
- •63. Кальцитриол: строение, биосинтез, механизм передачи сигнала, влияние на обмен кальция и фосфатов. Витамин д3 - предшественник кальцитриола, основные источника.
- •Ферменты и очередность синтеза
- •Структуры
- •64. Проявление гиповитаминоза, причины рахита.
- •65. Особенности метаболизма веществ в почках. Механизм образования мочи: клубочковая фильтрация, реабсорбция и секреция.
- •Фильтрационный (гематонефротический) барьер
- •Основные системы транспорта в проксимальном канальце нефрона.
- •66. Общие свойства и химический состав мочи в норме и при патологии. Коэффициент очищения крови (клиренс): понятие, виды.
- •67. Механизмы поддержания кос почками.
- •69. Гемоглобин: строение, виды, функции, регуляция сродства к кислороду (эффект Бора, влияние 2,3-дифосфоглицерата).
- •Структура гемоглобина
- •Структура гемоглобина а
- •70. Биосинтез гемма и гемоглобина: локализация, субстраты, ферменты, этапы, регуляция. Нарушение синтеза гема – порфирии. Анемии.
- •71. Обмен железа: всасывание, транспорт, депонирование, биороль. Нарушения обмена железа в организме человека.
- •Регуляция всасывания железа в кишечнике
- •Участие трансферритинового рецептора в транспорте железа в клетки
- •Причины железодефицитной анемии
- •72. Особенности метаболизма веществ в эритроцитах: механизмы сро и антиоксидантная защита в эритроцитах (аоз).
- •74. Противосвертывающие системы крови: антитромбиновая и фибринолитическая.
- •Регуляция ферментов фибринолиза
- •75. Механизм обезвреживания токсических веществ в печени: микросомальное окисление, реакции конъюгации.
- •76. Распад гема, образование и обезвреживание билирубина. «Прямой» и «Непрямой» билирубин.
- •Распад гемоглобина
- •Строение неконъюгированного билирубина
- •Обезвреживание билирубина в печени
- •Диглюкуронид билирубина
- •Отличия прямого и непрямого билирубина
- •77. Желтуха: классификация, причины, клиническая лабораторная диагностика.
- •78. Структурная организация межклеточного матрикса: состав, особенности строения. Структурные белки (коллаген, эластин, фибронектин, ламинин): особенности строения, функции.
- •Строение молекулы тропоколлагена
- •Строение препро-альфа-цепей коллагена
- •Углеводные компоненты коллагена
- •Дезаминирование остатков лизина в коллагене и образование межмолекулярных сшивок
- •Агрегация фибрилл и образование коллагенового волокна
- •Действие тканевой коллагеназы
- •80. Биохимические механизмы мышечного сокращения и расслабления. Роль градиента одновалентных ионов и ионов кальция в регуляции мышечного сокращения.
- •Цикл работы «головки» миозина
- •81. Особенности сокращения гладких мышц. Биохимическая диагностика инфаркта миокарда.
- •82. Особенности энергетического обмена быстро- и медленно сокращающихся миофибрилл. Особенности метаболизма веществ в скелетных мышцах и миокарде. Судьба лактата в сердечной и скелетной мышцах.
- •84. Витамины: определение, классификация, общая характеристика, роль в организме. Обмен витаминов в организме человека. Возможные пути развития эндогенной витаминной недостаточности.
- •85. Витамин а.
- •Строение ретиноидов (слева) и бета-каротина (справа)
- •Механизм участия ретиноевой кислоты в регуляции роста, деления и дифференцировки клеток
- •Фотохимический акт зрения
- •86. Витамин е.
- •Строение альфа-токоферола
- •87. Витамин в1.
- •Строение тиамина (слева) и тиаминдифосфата (справа)
- •Пример реакции с участием тиаминдифосфата
- •88. Витамин в6.
- •Строение пиридоксина и его коферментных форм
- •Пример реакции с участием пиридоксальфосфата
- •89. Витамин рр.
- •Строение витамина рр и его коферментных форм
- •Механизм участия над и надф в биохимических реакциях
- •Пример реакции с участием над
- •90. Витамин с.
- •Строение витамина с
- •Механизм участия витамина с в биохимических реакциях
- •Пример реакции с участием аскорбиновой кислоты
- •91. Схема переваривания нуклеопротеинов в жкт.
- •Реакции расщепления нуклеиновых кислот в жкт
- •92. Синтез пуриновых нуклеотидов: схема, ферменты, регуляция, запасные пути синтеза.
- •93. Распад пуриновых нуклеотидов: схема, ферменты. Нарушение обмена пуриновых нуклеотидов.
- •94. Биосинтез пиримидиновых нуклеотидов: схема, ферменты, регуляция, нарушения.
- •Синтез пиримидиновых нуклеотидов
- •Восстановление рибонуклеозиддифосфатов в дезоксипроизводные
- •Ферменты синтеза нуклеотидов как мишени действия противовирусных и противоопухолевых препаратов
- •95. Распад пиримидиновых нуклеотидов: схема, ферменты.
- •Распад пиримидиновых нуклеотидов
- •96. Репликация – синтез днк: матрица, затравка, субстраты, кофактор, ферменты и белки репликации.
- •Ферменты репликации эукариот и их функция
- •97. Транскрипция – синтез рнк: субстраты, этапы, факторы транскрипции, ферменты. Транскриптоны.
- •98. Трансляция – биосинтез белков: основные этапы функционирования белоксинтезирующей системы: активация аминокислот – синтез аминоацил-тРнк: инициация, элонгация, терминация.
- •99. Репарация ошибок и повреждений днк: этапы, биологическое значение.
- •100. Атеросклероз: определение, факторы риска, интегральная модель развития атеросклероза, «Порочный круг» в циркуляции хс и липопротеинов, биохимические основы профилактики и лечения.
- •Механизм развития атеросклероза
- •Гиперхолестеролемия
- •101. Биохимические изменения при панкреатитах: причина, механизмы развития, биохимическая диагностика. Биохимические аспекты лечения и профилактики панкреатитов.
- •Патогенез острого панкреатита
- •102. Перекисное окисление липидов (пол): субстраты, продукты пол, стадии, механизмы повреждающего действия (перекисная гипотеза гибели клеток).
- •103. Ферментативная и неферментативная антиоксидантные системы (аос) организма.
- •По природе и действию:
- •104. Молекулярные механизмы клеточной гибели: внешний, внутренний и перфорин-гранзимный пути реализации клеточной гибели. Нарушения апоптоза.
- •Общая схема молекулярных механизмов клеточной гибели
- •1 Стадия инициации: информационные сигналы рецептируются клеткой. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными.
- •Стадии апоптоза
- •Механизм апоптоза
- •Стадии апоптоза
- •Распознавание клеток-мишеней клетками ctl/nk-клетками
- •Локализация действия гранзимов
- •105. Канцерогенез: основные теории канцерогенеза, биохимические изменения в опухолевых клетках, онкомаркеры.
- •Усилением:
- •Ослаблением:
1. Понятие о катаболизме и анаболизме. Общая схема катаболизма углеводов, жиров и белков, общий и специфические пути распада.
Метаболизм – это двуединый процесс, складывающийся из 2-х частей: катаболизма и анаболизма.
Анаболизм (ассимиляция) – совокупность химических реакций, в результате которых из простых соединений образуются сложные органические вещества, специфичные для организма (нуклеиновые кислоты, белки и др.). Анаболические реакции протекают с использованием химической энергии в виде макроэргических связей (в основном АТФ) и восстановительных эквивалентов (НАДН2 и НАДФН2), образованных при распаде биоорганических соединений.
Катаболизм (диссимиляция) – распад сложных органических молекул до более простых или до образования низкомолекулярных конечных продуктов (СО2, Н2О и мочевины), выделяемых из организма. Катаболические реакции сопровождаются выделением свободной энергии, которая заключена в сложных молекулах органических веществ. Часть этой энергии превращается в химическую форму энергии (АТФ, восстановительные эквиваленты и др.) и запасается в клетках организма в виде углеводов, липидов и белков. Большая часть энергии рассеивается в виде тепла.
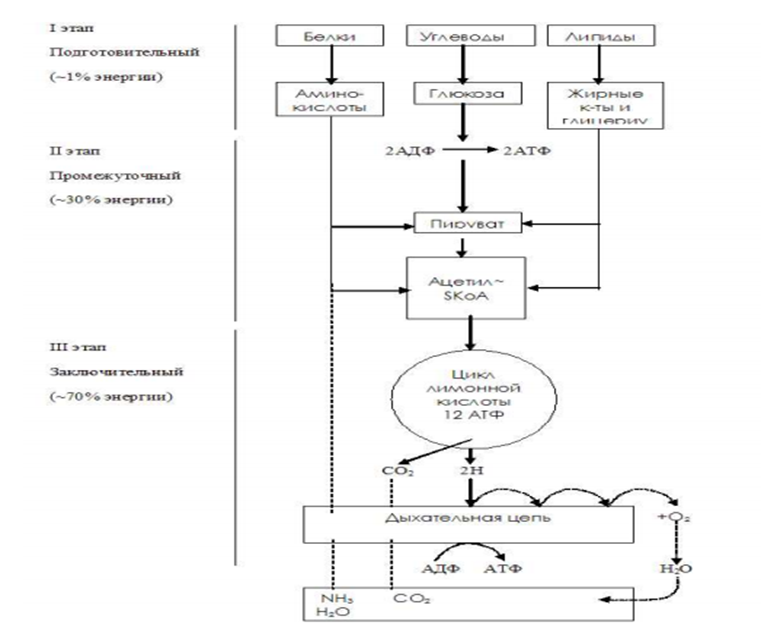
Общая схема катаболизма углеводов, жиров и белков
Общий и специфические пути распада:
К общим путям катаболизма относятся:
1. Окислительное декарбоксилирование пировиноградной кислоты.
2. Цикл трикарбоновых кислот (ЦТК).
3. Цепь переноса электронов (ЦПЭ) и окислительное фосфорилирование.
Основные специфические пути катаболизма:
1. Для моносахаридов – гликолиз, конечным метаболитом которого является пировиноградная кислота, которая далее подвергается окислительному декарбоксилированию и превращается в активную форму уксусной кислоты – ацетил-КоА;
2. Для жирных кислот – β-окисление, конечным продуктом которого является ацетил-КоА
3. Для глицерина – расщепление до пирувата, который далее превращается в ацетил-КоА;
4. Для аминокислот – дезаминирование и расщепление безазотистых молекул до ди- и трехуглеродных карбоновых кислот и их производных.
Большинство этих метаболитов превращается в ацетил-КоА.
Таким образом, в результате специфических путей катаболизма продукты переваривания пищевых веществ (моносахариды, жирные кислоты, глицерин и аминокислоты) превращаются всего в два соединения: ПВК и ацетил-КоА, которые затем направляются в общий путь катаболизма.
2. Особенности ферментативного катализа. Зависимость скорости ферментативных реакций от температуры рH среды, количества фермента и концентрации субстрата. Константа Михаэлиса.
Особенности ферментативного катализа:
1) Высокая эффективность: они могут ускорять реакцию в 108 -1012 раз.
2) Возможность регуляции их активности на генном уровне, условиями среды, присутствием различных низкомолекулярных веществ.
3) Высокая специфичность по отношению к субстрату и типу катализируемой реакции.
Зависимость скорости ферментативных реакций от температуры, рH среды, количества фермента и концентрации субстрата.
1) Влияние температуры:
Скорость ферментативной реакции (активность фермента) увеличивается с повышением температуры только до температуры денатурации белков (предел от 55-60 гр Цельсия) и подчиняется закону Вант-Гоффа:
- При увеличении температуры на каждые 10 градусов скорость реакции увеличивается от 2 до 4 раз.
Зависимость активности ферментов от температуры описывается колоколообразной кривой. Оптимальная температура – температура, при которой скорость реакции максимальна. Для большинства ферментов животного происхождения темп.оптимум лежит в интервале 37 и 40 градусов по Цельсию.
При повышении температуры (до оптимальной) – ускоряется движение молекул, увеличивается вероятность столкновения и скорость реакции повышается.
При дальнейшем повышении – активность ферментов повышается, а при температуре 50 градусов многие ферменты теряют свою активность из-за денатурации его белковой части и нарушения структуры активного центра.
При низких температурах (0 и ниже) активность ферментов снижается почти до нуля (фермент инактивируется) из-за уменьшения скорости движения молекул. Денатурации нет, значит с повышением температуры восстановится каталитическая активность.
Таким образом ферменты чувствительны (термолабильны) к действию температуры.
