
5 Тепловые расчеты
.docТЕПЛОВЫЕ РАСЧЕТЫ ОБОРУДОВАНИЯ
Назначение: определение расходов и расходных коэффициентов теплоносителей и хладоагентов, расчет поверхности теплообмена, необходимой для протекания процесса в регламентных условиях.
Исходные данные:
Данные материального баланса
2. Сведения о температурном режиме
Для непрерывного процесса – температура на входе и выходе из аппарата.
Для периодического процесса – температурный график процесса (зависимость температуры в аппарате от времени).
3. Химическая схема синтеза с указанием основной и и всех побочных реакций и выходов продуктов во всех реакциях.
4. Сведения о физико-химических превращениях, сопровождающих реакции или протекающих самостоятельно.
5. Тепловые характеристики исходных веществ, реакционных масс или их компонентов, а также теплоносителей и хладоагентов.
Порядок выполнения теплового расчета
Т![]() епловой
расчет выполняется в виде теплового
баланса:
епловой
расчет выполняется в виде теплового
баланса:
Для непрерывных процессов расчеты проводятся на часовую производительность в кДж/сек или кКал/час.
Для периодических процессов баланс составляется в кДж или кКал. В основе теплового расчета периодического процесса лежит температурный график. Поверхность теплообмена рассчитывается для стадии с максимальной тепловой нагрузкой.
Рассмотрим составные части теплового баланса.
Q1 – теплосодержание веществ в аппарате в начале процесса (для периодического процесса); тепло, вносимое с исходными веществами (для непрерывных процессов):
![]()
где Gн [кг] или [кг/час] – масса исходных веществ;
сн [ккал/кгград] – теплоемкость исходных веществ;
tн [oC] – температура исходных веществ (в начале периодического процесса).
Величины Gн берутся из данных материального расчета, значение tн задаются регламентом процесса.
Т![]() еплоемкости
твердых и жидких веществ могут быть
вычислены по формуле:
еплоемкости
твердых и жидких веществ могут быть
вычислены по формуле:
где сn – атомная теплоемкость;
n – число атомов данного элемента в молекуле;
М – молекулярная масса соединения.
Т![]() еплоемкости
растворов при отсутствии экспериментальных
данных могут быть определены по формуле:
еплоемкости
растворов при отсутствии экспериментальных
данных могут быть определены по формуле:
где ci – удельные теплоемкости компонентов в растворе;
gi –содержание компонентов в % массовых.
Q4 – теплосодержание веществ в аппарате в конце процесса (для периодического процесса); тепло, уносимое с продуктами реакции (для непрерывных процессов):
![]()
Расчеты проводятся аналогично расчетам Q1.
Q3 – тепловой эффект процесса.
![]()
где Qpi – теплота химической реакции;
Qфхп – теплота физико-химических превращений.
Q5 – тепло, расходуемое на нагрев аппарата или тепло, относимое от аппарата при охлаждении.
![]()
где Gапп – масса аппарата;
сапп – теплоемкость материала аппарата;
tкапп – конечная температура аппарата;
tнапп – начальная температура аппарата.
Величина Q5 рассчитывается только для периодических процессов для стадий нагревания и охлаждения. Для непрерывных процессов Q5=0.
Q6 – теплопотери в окружающую среду с поверхностей аппарата, которые не покрываются поверхностью теплопередачи. Эта величина рассчитывается для температур выше 100оС.
![]()
где – коэффициент теплоотдачи от нагретой поверхности к воздуху;
F – поверхность;
τ – время;
tапп – температура поверхности аппарата;
tв – температура окружающей среды .
При очень высоких температурах (t > 200оС) нагретая поверхность аппарата изолируется. В этом случае рассчитывают толщину слоя изоляции.
Q2 – тепло, которое необходимо подвести к аппарату или отвести от него для протекания процесса в регламентных условиях.
Тепловой баланс рассчитывается относительно Q2. Если Q2 > 0, то необходим подвод тепла; если Q2 < 0, то необходим отвод тепла.
Для периодических процессов величину Q2 рассчитывают для всех стадий теплообмена в соответствии с температурным графиком процесса.
Расчет теплоты химической реакции.
Если имеются экспериментальные данные по тепловому эффекту (энтальпии) реакции, то каких-либо дополнительных расчетов не требуется. Если такие данные отсутствуют, то необходимо рассчитать тепловой эффект реакции.
Рассмотрим следующую химическую реакцию:
aA + bB = cC + dD
Если известна удельная теплота данной реакции qp (теплота образования вещества С), то тепловой эффект процесса определяется по формуле:
![]()
где G(C) – масса вещества С [кг];
qр – теплота образования вещества С [ккал/моль];
Mr(C) – молярная масса вещества С.
Е![]() сли
экспериментальные данные отсутствуют,
то расчете теплоты реакции ведут по
закону Гесса через теплоты образования
соединений:
сли
экспериментальные данные отсутствуют,
то расчете теплоты реакции ведут по
закону Гесса через теплоты образования
соединений:
где
Σqк – суммарная теплота образования продуктов реакции [ккал/моль];
Σqн – суммарная теплота образования исходных веществ [ккал/моль].
В данном случае:
qр = qo(C) + (d/c)qo(D) – (a/c)qo(A) – (b/c)qo(B)
Теплоты образования многих веществ приведены в справочной литературе. Следует помнить, что теплоты образования и энтальпии образования имею противоположные знаки: qo(C) = - ΔH(C).
Если экспериментальные данные по теплоте образования отсутствуют, то эти величины рассчитывают с использованием величины теплоты сгорания:
![]()
где qo – теплота образования [ккал/моль];
na – число одноименных атомов в молекуле;
qa – теплота сгорания 1 г-атома элемента [ккал];
qсг – теплота сгорания соединения [ккал/моль].
Теплоты сгорания элементов приведены в справочной литературе.
Теплоты сгорания органических соединений в жидком состоянии могут быть рассчитаны приблизительно по формуле Карраша:
![]()
где n – число электронов, которое перемещается при полном сгорании соединения;
Δζ – тепловая поправка на элемент структуры или заместитель;
26.05 – тепловой эквивалент сгорания 1 г-экв электронов.
Предполагается, что при сгорании 1 атома атома углерода в углеводородах перемещается 4 электрона. В том случае, если атом углерода связан с электроноакцепторным заместителем, происходит перенос 3-х электронов. Примерами таких соединений могут служить фенол, бензолсульфокислота, хлорбензол, нитробензол. При сгорании атома углерода, связанного с аминогруппой, происходит перенос 4-х электронов.
Пример расчета теплоты сгорания фенола:
Число переносимых электронов: n = 45 + 31 + 15 = 28
Поправка на фенольный гидроксил: Δ(ОН) = +3.5
qсг(С6Н5ОН) = 26.0528 + 3.51 = 732.9 ккал/моль.
Величины тепловых поправок приведены в литературе.
Если вещество находится не в жидком, а в другом агрегатном состоянии, то необходимо учитывать удельную теплоту фазового перехода.
Теплота испарения может быть рассчитана по формуле:
![]()
где Тк – температура кипения в оК;
М – молекулярная масса.
Теплота плавления может быть рассчитана по формуле:
![]()
где К=5-7 для неорганических соединений;
К=2-3 для элементов;
К=13±3 для органических соединений
Тпл – температура плавления в оК;
М – молекулярная масса.
Расчет поверхности теплообмена.
П![]() осле
того как определены величины Q1,
Q3, Q4,
Q5 и Q6,
рассчитывают величину Q2,
из которой определяют необходимую
поверхность теплообмена:
осле
того как определены величины Q1,
Q3, Q4,
Q5 и Q6,
рассчитывают величину Q2,
из которой определяют необходимую
поверхность теплообмена:
где К – коэффициент теплопередачи [ккал/м2градс];
Δtср – средняя разность температур теплоносителя и реакционной массы в аппарате [град];
τ – продолжительность операции [с].
Величину поверхности теплообмена, F, рассчитывают для каждой стадии процесса в соответствии с температурным графиком. Поверхность теплообмена в аппаратах лимитируется ГОСТом или НТД на соответствующие аппараты. Выбирают максимальное расчетное значение поверхности теплообмена. Если расчетное значение меньше или равно заявленной в НТД поверхности теплообмена, то аппарат удовлетворяет условиям теплообмена. Если расчетное значение превышает заявленное в НТД значение, то необходимо рассматривать возможность увеличение поверхности теплообмена. Можно использовать дополнительный змеевик. В этом случае определяют геометрические размеры и число элементов поверхности теплообмена, например, число витков змеевика.
Поверхность витка змеевика определяется по формуле:
![]()
где dвитка – диаметр витка змеевика;
dтр – диаметр трубы змеевика.
Число витков змеевика определяется по формуле:
![]()
Е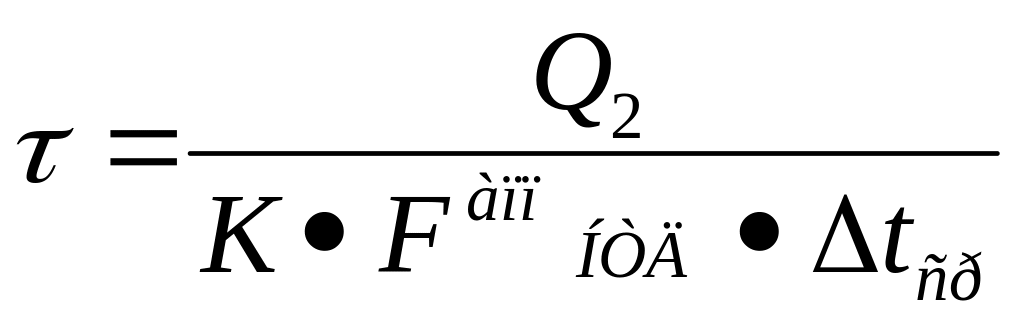 сли
поверхность теплообмена увеличить
нельзя, то необходимо пересчитывать
время теплообмена (продолжительность
операции):
сли
поверхность теплообмена увеличить
нельзя, то необходимо пересчитывать
время теплообмена (продолжительность
операции):
После этого проводится новый технологический расчет для данной стадии, а затем тепловой расчет.
Если процесс проводится в открытых аппаратах, и некоторая часть жидких веществ испаряется, то следует учитывать тепло, идущее на испарение:
![]()
где G – масса испаряемой жидкости [кг];
r – теплота испарения [ккал/кг].
Исходя из величины Q2, рассчитывают расход соответствующего теплоносителя.
При подводе тепла с острым паром уравнение теплового баланса имеет вид:
![]()
Отсюда определяют расход греющего пара, D.
