
диссертации / 85
.pdf
41
ER
PR
Примечание: ER – рецепторы эстрадиола, PRрецепторы прогестерона.
Таким образом, самая противоречивая патология с точки зрения экспрессии рецепторов эстрадиола и прогестерона - гиперплазия эндометрия без атипии.
1.5.Лечение гиперпластических процессов эндометрия
Тактика лечения пациенток с гиперпластическими процессами слизистой оболочки матки определяется многими факторами: возрастом пациентки,
характеристиками патологического процесса, этиопатогенеза заболевания,
сопутствующими гинекологическими и экстрагенитальными заболеваниями.
Основными целями терапии является остановка кровотечения, восстановление менструальной функции в репродуктивном периоде или достижение стойкой менопаузы в более старшем возрасте и профилактика рецидивов гиперпластического процесса.
Консервативные методы лечения гиперплазий эндометрия включают в себя применение прогестинов, комбинированных пероральных контрацептивов,
антигонадотропные препараты, агонисты гонадолиберина. Основными направлениями в гормональной терапии являются:
1.местное действие, направленное на подавление пролиферации эндометрия, приводящее к его атрофии;
2.центральное действие, направленное на подавление выделения гонадотропных гормонов гипофиза и, как следствие, - торможение стероидогенеза
вяичниках [14].
42
Первым этапом лечения гиперплазии эндометрия является раздельное лечебно-диагностическое выскабливание матки под контролем гистероскопии.
Гормональное лечение (второй этап) назначают только после получения результатов гистологического исследования удаленного эндометрия [14, 15].
Используемые при гиперпластических процессах эндометрия гормональные препараты можно разделить на несколько групп [14]:
гестагены (прогестерон и его производные: дидрогестерон,
медроксипрогестерона ацетат и другие) – подавляют пролиферацию, вызванную эстрогенами, и способствуют дифференцировке;
аналоги гонадолиберинов (бусерелин, гозерелин) - подавляют секрецию лютеинизирующего и фолликулостимулирующего гормонов при длительном применении, снижают секрецию эстрогенов в яичниках и способствуют атрофии эндометрия;
комбинированные пероральные контрацептивы (например,
дезогестрел+этинилэстрадиол), содержащие эстроген-гестагенные препараты.
При лечении больных с дисфункциональными маточными климактерическими кровотечениями и гиперплазией эндометрия могут быть также использованы препараты андрогенных гормонов.
Кроме того, применяют негормональный консервативный подход к лечению гиперпластических процессов эндометрия, включающий: диеты, коррекцию обменно-эндокринных нарушений (метионин, линетол), вещества,
нормализующие водно-электролитный обмен (спиронолактон, аспарагинаты магния или калия), средства для улучшения состояния центральной нервной системы (циннаризин, пирацетам), витамины, иммуномодуляторы, седативные препараты [14].Это подтверждает вовлечение различных органов и тканей в патогенез гиперплазии эндометрия.
Кроме того, перед решением вопроса о целесообразности гормонотерапии необходимо убедиться в чувствительности опухоли к прогестагенам, обращая внимание на степень дифференцировки опухоли, содержание рецепторов эстрогена и прогестерона и патогенетический тип заболевания.
43
С другой стороны, повысить эффективность терапии гиперпластических процессов эндометрия можно созданием новых соединений, обладающих, с одной стороны, более высокой активностью по отношению к гиперплазированной ткани эндометрия и, с другой стороны, оптимальным профилем безопасности.
Прегна-D’-пентараны являются высокоактивными соединениями с разделенными биологическими функциями в зависимости от модификаций их молекулы, что делает их перспективными для дальнейшего применения в клинике в качестве активных гестагенов. А поскольку основными препаратами при лечении гиперпластических процессов эндометрия являются лиганды рецепторов прогестерона, то прегна-D’-пентараны могут помочь в создании соединений с высокой противоопухолевой активностью.
1.6.Заключение
Подводя итоги, можно сказать, что, несмотря на наличие сведений о роли иммунной системы в этиопатогенезе гиперпластических процессов эндометрия,
сведений о рецепторном профиле иммунокомпетентных клеток периферической крови при развитии гормон-зависимых патологий достаточно мало. Поэтому необходимо продолжить изучение рецепторного профиля мононуклеарных клеток периферической крови пациенток при развитии различных патологий тканей матки, что может позволить более глубоко изучить роли рецепторов эстрадиола и прогестерона в этиопатогенезе гиперпластических процессов эндометрия для решения фундаментальных и прикладных проблем. Кроме того, поиск и анализ новых лекарственных соединений является перспективным направлением для повышения эффективности и резерва консервативной терапии гормон-зависимых патологий эндометрия.
44
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1.Материалы для исследования
2.1.1. Используемые реактивы
1.физиологический раствор, 0,9% раствор натрия хлорида
(«Биосинтез», Россия);
2.раствор фиколла, ρ=1,077 г/см3 («ПанЭко», Россия);
3.реактивы набора "Рибо-преп" (ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Россия);
4.реактивы набора "Реверта-L" (ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Россия);
5.реактивы "Реакционная смесь 2,5х для проведения ПЦР-РВ в присутствии SYBR Green I" («Синтол», Россия);
6.праймеры для полимеразной цепной реакции («Синтол», Россия);
7.среда DMEM с глутамином и гентамицином («ПанЭко», Россия);
8.сыворотка крови эмбриональная телячья («ПанЭко», Россия);
9.трис-аминометан (TRIS) («Merck», Германия);
10.ЭДТА («Sigma», США);
11.трипановый синий («ПанЭко», Россия)
12.дитиотрейтол (DTT) («Calbiochem», Англия);
13.сцинтилляционная жидкость Ultima Gold AB («PerkinElmer»,
США);
14.[1,2,6,7]3Н-Р4 («GE Healthcare Ltd», Англия);
15.прогестерон («Merck», Германия);
16.гидрокортизон («Merck», Германия);
17.декстран Т-70 («Pharmacosmos», Дания)
18.глицерин («ПанЭко», Россия);
45
19.3-(4,5-диметилтиазолил-2)-2,5-дифенилтетразолиум бромид (МТТ) («Sigma», США);
20.ДМСО (диметилсульфоксид) («Serva», Германия);
21.набор реагентов для иммуноферментного определения концентрации фактора некроза опухолей типа альфа в сыворотке крови «альфа-
ФНО-ИФА-БЕСТ» («Вектор-БЕСТ», Россия);
2.1.2. Используемое оборудование
1.центрифуга РС-6 («ТНК Дастан», Киргизская Республика);
2.центрифужные пробирки из полистирола на 10 мл («F.L. Medical»,
Италия);
3.камера Горяева;
4.пробирки микроцентрифужные типа Эппендорф стерильные на 1,5
и0,2 мл;
5.автоматические дозаторы Thermo на 1000, 200 и 10 мкл
(«Ленпипет», Россия);
6.термостат электрический суховоздушный ТС-80М
(«МЕДЛАБОРТЕХНИКА», СССР);
7.насадки для микропипеток на 1000, 200 и 10 мкл с/без аэрозольного
барьера;
8.вортекс MicrospinFV-2400 («BioSan», Латвия);
9.микроцентрифуга Eppendorf mini spin («Eppendorf», Германия);
10.термостат Гном («ДНК-Технология», Россия);
11.амплификатор iCycler iQ5 real-time PCR («BioRad», Германия);
12.ламинарный бокс («LS», Россия);
13.микроскоп Биолам П2-1(«ЛОМО», Россия);
14.плоскодонные и круглодонные 96-луночные планшеты
(«Медполимер», Россия);
15.стеклянные фильтры Whatman GF/B (Whatman Grade GF/B Glass
46
Microfiber Filters) («GE Healthcare Ltd», Англия);
16.анализатор иммуноферментных реакций "УНИПЛАН" АИФР-01
(«Пикон», Россия);
17.сцинтилляционные флаконы («PerkinElmer», США);
18.жидкостной сцинтилляционный альфа-бета радиометр «Tri-carb
3110» («PerkinElmer», США).
2.1.3. Объекты исследования
В исследовании использованы образцы периферической крови 110
пациенток репродуктивного и постменопаузального возраста, наблюдавшихся в период в 2008-2014 годов в гинекологической клинике кафедры акушерства и гинекологии педиатрического факультета Государственное бюджетное образовательное учреждение высшего профессионального образования
"Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Министерства здравоохранения Российской Федерации им. Н.И.
Пирогова (зав. – д.м.н., академик РАН, профессор Савельева Г.М.) врачами к.м.н.
Мартиросян К. А. и Ивановской Т.Н., и проходивших плановое обследование в отделении гинекологической эндокринологии Государственное бюджетное учреждение здравоохранения Московской области "Московский областной научно-исследовательский институт акушерства и гинекологии" (директор – д.м.н., чл.–корр. РАН, профессор Краснопольский В.И.) врачом Горенковой О.С.
Перед включением в исследование пациенток у каждой получено информированное согласие на участие.
Условиями включения в исследование явились: неиспользование гормональных препаратов в течение 3 последних месяцев, тяжелая соматическая патология и выраженные метаболические нарушения в стадии декомпенсации.
Возраст пациенток репродуктивного возраста составил в среднем 39,1 ± 11,9
года. Возраст больных постменопаузального возраста составил в среднем 63,7 ± 9,2 года, длительность менопаузы варьировала от 2 до 40 лет – 13,9 ± 9,8 лет.
47
Пациентки были разделены на две группы: в контрольную (I) были включены 40 больных без гинекологической патологии, тяжелых соматических заболеваний и выраженных метаболических нарушений; в основную (II) вошли 53
пациентки с гиперпластическими процессами: с полипами, гиперплазией и аденокарциномой эндометрия.
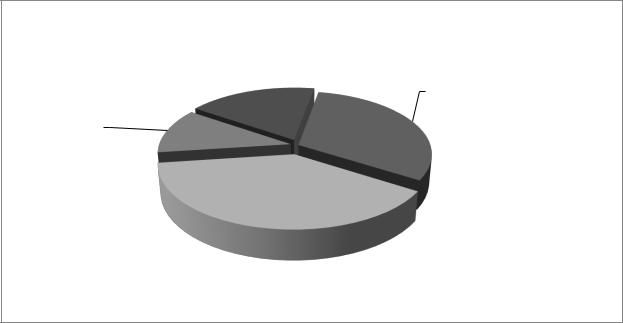
Распределение пациенток постменопаузального возраста в зависимости от результатов гистологического исследования эндометрия представлено на диаграмме 1.
Диаграмма 1.
Состав исследуемой группы пациенток постменопаузального возраста
по характеру патологии эндометрия (n = 96).
|
аденокарцинома |
без |
|
|
18% |
||
железистаяи |
гинекологических |
||
|
|||
железисто- |
|
патологий |
|
кистозная |
|
31% |
|
гиперплазия |
|
|
|
12% |
|
|
|
|
железисто- |
|
|
|
фиброзные полипы |
|
|
|
39% |
|
Забор крови у больных репродуктивного возраста производили из локтевой вены в пролиферативную фазу менструального цикла. Забор крови из локтевой вены у пациенток основной группы производили перед оперативным вмешательством, а у контрольной группы – натощак.

48
Культуры клеток HeLa (эпителиоидный рак шейки матки человека), MOLT-
4 (Т-клеточный лейкоз человека) получены из банка клеток Всероссийского научного центра молекулярной диагностики и лечения (директор – чл.-кор. РАН,
профессор Северин Е.С.).
Восемь прегна-D’-пентаранов были синтезированы и любезно предоставлены сотрудниками лаборатории химии стероидов и оксилипинов N22
д.х.н., профессором Левиной И.С. и д.х.н., профессором Камерницким А.В. (зав.
д.х.н. И.В. Заварзин) Института органической химии им. Н.Д. Зелинского РАН.
Структуры полученных лигандов рецептора прогестерона представлены в таблице
5.
Таблица 5.
Химическая структура исследуемых прегна- D’-пентаранов.
№№ |
Название стероида |
Структурная формула |
P4 Прогестерон
|
6-(E)-гидроксиимино- |
|
K-1044 |
16α,17α- |
|
циклогексанопрегн-4- |
||
|
||
|
ен-3β-ол-20-он |

49
6-(E)-гидроксиимино-
K-1045 16α,17α-
циклогексанопрегн-4- ен-3,20-дион
6-(E)-метоксиимино-
K-1046 16α,17α-
циклогексанопрегн-4-
ен-3β-ол-20-он
6-(E)-метоксиимино-
K-1047 16α,17α-
циклогексанопрегн-4- ен-3,20-дион

50
16α,17α-
К-338 циклопропанопрегн-4- ен-3,20-дион
16α,17α-циклогексано-4-
К-1036 оксапрегн-5-ен-3,20-
дион
3'-фенил[16α,17α]-
К-1030 циклопропанопрегн-4- ен-3,20-дион
3'-п-
К-1039 Фторфенил[16α,17α]- циклопропанопрегн-4-
ен-3,20-дион
2.1.4. Дизайн исследования.
Исследование влияния прегна-D’-пентаранов на мононуклеарную фракцию
клеток периферической крови проводили согласно схеме 1.
