
диссертации / 85
.pdf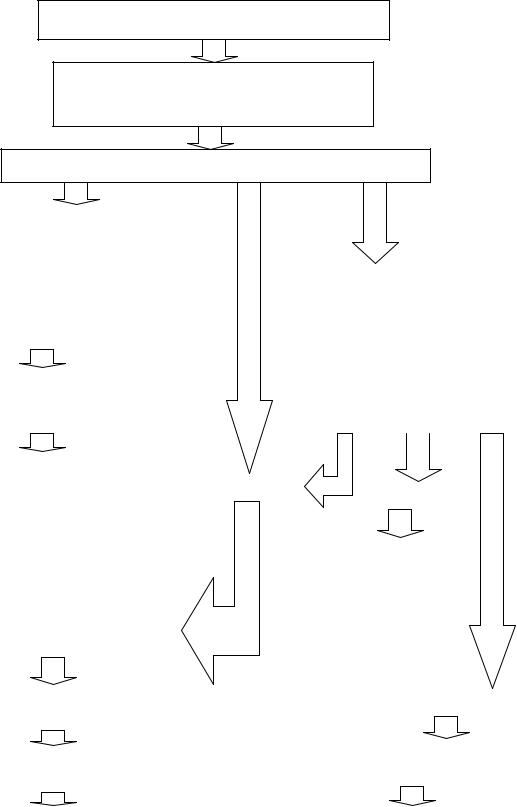
51
Схема 1.
Последовательность экспериментов по оценке влияния лигандов рецепторов прогестерона на мононуклеарную фракцию клеток периферической крови.
ПЕРИФЕРИЧЕСКАЯ КРОВЬ
СЕДИМЕНТАЦИЯ В ГРАДИЕНТЕ ПЛОТНОСТИ ФИКОЛЛА
МОНОНУКЛЕАРНАЯ ФРАКЦИЯ КЛЕТОК
|
|
|
|
|
ИНКУБАЦИЯ С ПРЕГНА-D- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
ПЕНТАРАНАМИ, |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
ПРОГЕСТЕРОНОМ И 3Н- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
ПРОГЕСТЕРОНОМ |
|
|
|
|
|
|
|
ИНКУБАЦИЯ С |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
(60 мин, 37 |
0 |
С, концентрация |
|
|
|
|
|
|
|
|
|
|
|
|
ПРЕГНА-D- |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
ПЕНТАРАНАМИ И |
|
|
|||||||||
|
|
|
|
|
соединений - 10-8М) |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПРОГЕСТЕРОНОМ |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(72 ч, 37 0С, концентрация |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
ЖИДКОСТНАЯ |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
СЦИНТИЛЛЯЦИОННАЯ |
|
|
|
|
|
|
|
|
|
|
соединений - 10-8М) |
|
|
||||||
|
|
|
|
|
РАДИОМЕТРИЯ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОПРЕДЕЛЕНИЕ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
СПЕЦИФИЧЕСКОГО |
|
|
|
|
КЛЕТКИ |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
МТТ-ТЕСТ |
|
|
|
|||||||||||||
|
|
|
|
|
СВЯЗЫВАНИЯ ПРЕГНА-D- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
ПЕНТАРАНОВ С ПРОГЕСТЕРОН- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
СВЯЗЫВАЮЩИМИ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
ОПРЕДЕЛЕНИЕ |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЖИЗНЕСПОСОБНОСТИ |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КЛЕТОК |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
ВЫДЕЛЕНИЕ МРНК МЕТОДОМ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
ПРЕЦИПИТАЦИИ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ПОЛУЧЕНИЕ КДНК РЕАКЦИЕЙ |
|
|
|
|
|
|
|
|
|
СУПЕРНАТАНТ |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
ОБРАТНОЙ ТРАНСКРИПЦИИ |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ИММУНОФЕРМЕНТНЫЙ |
|
|
|||
|
|
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ В |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
АНАЛИЗ |
|
|
||||||||||||
|
|
|
|
|
РЕАЛЬНОМ ВРЕМЕНИ |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОПРЕДЕЛЕНИЕ УРОВНЯ ЭКСПРЕССИИ |
|
|
|
|
|
|
ОПРЕДЕЛЕНИЕ |
|
|
|||||||||||||
|
|
ГЕНОВ РЕЦЕПТОРОВ ПРОГЕСТЕРОНА |
|
|
|
|
|
|
КОНЦЕНТРАЦИИ ФНОα |
|
|
|||||||||||||
|
|
|
|
|
И ЭСТРАДИОЛА |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

52
2.2. Методы исследования
2.2.1. Выделение мононуклеарной фракции клеток из периферической
крови
Получение мононуклеаров из периферической крови осуществляли методом центрифугирования в градиенте плотности фиколла («ПанЭко», Россия) по
Boyum [38]. Кровь с гепарином (10 и 1 мл, соответственно) разводили физиологическим раствором в объемном соотношении 1 : 1. Разведенную кровь по 5 мл наслаивали на 3 мл раствора фиколла комнатной температуры (ρ=1,077
г/см3) в полистирольной центрифужной пробирке на 10 мл и центрифугировали
45 мин при 2000 об/мин и 4 0С на приборе РС-6 («ТНК Дастан», Киргизия). Затем автоматическим дозатором отбирали фракцию мононуклеарных клеток,
находящуюся на границе плотности (рисунок 6), переносили ее в чистую центрифужную пробирку и доводили объем физиологическим раствором до 10
мл.
Рисунок 6.
Разделение форменных элементов крови в градиенте плотности
фиколла.
53
Примечание: 1 – плазма крови, 2 – слой мононуклеарных клеток, 3 –
фиколл, 4 – эритроциты.
Далее полученную взвесь центрифугировали 15 мин при 1600 об/мин и 4 0С
(РС-6), сливали супернатант и доводили объем физиологическим раствором до 10
мл, снова центрифугировали 15 мин при 1600 об/мин и 4 0С и сливали надосадочную жидкость. Оставшийся осадок (МНФК) использовали для анализа.
Подсчет и анализ жизнеспособности клеток производили в камере Горяева под микроскопом Биолам П2-1(«ЛОМО», Россия) в среде DMEM («ПанЭко», Россия)
спомощью красителя трипанового синего («ПанЭко», Россия).
2.2.2.Определение специфического связывания 3Н-прогестерона с прогестерон-связывающими участками МНФК периферической крови
Изучение специфического связывания прогестерона в мононуклеарной фракции проводили с помощью конкурентного радиолигандного анализа [2].Для определения общего связывания пробы содержали 20 нМ [1,2,6,7]-3Н-Р4 («GE Healthcare Ltd», Англия) и 1мкМ гидрокортизона («Merck», Германия) в
инкубационной среде. Для определения неспецифического связывания пробы дополнительно содержали 2 мкМ прогестерона («Merck», Германия). Этанол,
используемый для разведения стероидов, после раскапывания в 96-луночный планшет, испаряли. Затем добавляли по 100 мкл мононуклеарной фракции клеток крови (~ 1 млн. клеток/лунка) в среде DMEM («ПанЭко», Россия), инкубировали
60 мин при 37 0С, после чего клеточную суспензию из каждой лунки с помощью автоматического дозатора помещали на стеклянные фильтры Whatman GF/B («GE Healthcare Ltd», GB) и промывали 100-кратным избытком ледяного ТЭД-буфера
(10 мМ TRIS («Merck», Германия), 1,5 мМ ЭДТА («Sigma», США), 0,5 мМ дитиотрейтол («Calbiochem», Англия), 10% глицерина («ПанЭко», Россия), pH=7,4). Стеклянный фильтр из каждой пробы после высушивания помещали во
54
флаконы с 10 мл сцинтилляционной жидкости Ultima Gold AB («PerkinElmer»,
США).
Все исследования проводили в триплетах. Связывание стероидных гормонов в МНФК выражали в фемтомолях гормона на млн. клеток, которое рассчитывали по формуле:
N = ( T – NSB ) / ( K * С )
Примечание: N – количество рецепторов прогестерона (фмоль на 1млн.
клеток); Т - средняя величина общего (в отсутствии конкурента) связывания меченого гормона в dpm (decompositions per min, распад в минуту); NSB- средняя величина неспецифического (в присутствии конкурента) связывания в аналогичной аликвоте в dpm, регистрируемых β-радиометром; K – коэффициент пересчета количества связанного гормона из dpm в фмоль, зависящий от удельной радиоактивности 3Н-прогестерона; С – концентрация клеток в лунке (100 мкл).
2.2.3. Определение специфического связывания синтетических
стероидов с рецепторами прогестерона
Исследование специфического связывания прегна-D’-пентаранов с прогестерон-связывающими участками МНФ проводили аналогично определению специфического связывания прогестерона с рецепторами прогестерона, но вместо избытка немеченого прогестерона в лунки планшета вносили по 2 мкМ образцов прегна-D’пентаранов. Величину специфического связывания лигандов рецепторов прогестерона (% ингибирования специфического связывания Н3-
прогестерона веществом) оценивали согласно «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ» [27] по формуле:
И= (В спец. преп./В спец. горм.)*100%, где
55
И – ингибирование специфического связывания с рецептором 3Н-
прогестерона препаратом, В спец. преп. – специфическое связывание прогестерона в присутствии препарата; В спец. горм. – специфическое
связывание прогестерона в отсутствии препарата.
2.2.4. Жидкостная сцинтилляционная радиометрия
Воснове метода лежит свойство β-частиц вызывать сцинтилляцию веществ
вспециальных средах. Это дает возможность с большой эффективностью регистрировать β-излучение, обладающее малой энергией. Для регистрации радиоактивности образцы с меченым тритием прогестероном помещали во флаконы с 10 мл сцинтилляционной жидкости Ultima Gold AB («PerkinElmer»,
США). Смесь перемешивали и регистрировали радиоактивность образца на жидкостном сцинтилляционном альфа-бета радиометре «Tri-carb 3110» («PerkinElmer», США). Эффективность счета для 3Н составила 64-68%.
2.2.5. Инкубация клеток с прегна-D’-пентаранами и прогестероном.
Работу с клетками осуществляли в стерильных условиях – в ламинарном боксе («LS», Россия).
Cпиртовые растворы прегна-D’-пентаранов и прогестерона вносили во все лунки стерильного плоскодонного 96-луночного планшета, кроме лунок контроля так, чтобы их конечная концентрация в инкубационной среде составила 10-8 М.
Этанол после раскапывания испаряли. Затем в лунки планшета добавляли по 200
мкл суспензии клеток в полной среде DMEM (среда DMEM (100 мкг/мл L-
глутамина и 40 мкг/мл гентамицина сульфата) («ПанЭко», Россия) с 20 %
термоинактивированной эмбриональной телячьей сыворотки («ПанЭко»,
Россия)), количество клеток в лунке составляло 0,1-0,5 млн. клеток. Клетки инкубировали в термостате ТС-80М («МЕДЛАБОРТЕХНИКА», СССР) при 37ºС в условиях 5% СО2, во влажной среде для исключения высыхания, в течение 3-х
56
суток. После инкубации отбирали автоматической пипеткой 100 мкл супернатанта для определения концентрации ФНО-альфа в супернатанте, оставшиеся клетки использовали для постановки МТТ-теста и выделения мРНК.
2.2.6. Оценка метаболической активности клеток (МТТ-тест)
Оценку жизнеспособности клеток проводили согласно «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ» [27]. Метод основан на способности ферментов дыхательной цепи митохондрий (сукцинатдегидрогеназ) живых клеток восстанавливать бледно-
желтый водорастворимый 3-(4,5-диметилтиазолил-2)-2,5-дифенилтетразолиум бромид (МТТ) в голубые кристаллы формазана, не растворимые в воде.
Количество образовавшегося формазана характеризует интенсивность окислительно-восстановительных процессов в клетках, то есть их жизнеспособность.
После завершения инкубации клеток с соединениями к 100 мкл суспензии клеток добавляли по 10 мкл МТТ-раствора (концентрация МТТ («Sigma», США)
составляла 10 мг/мл), приготовленного на среде DMEM («ПанЭко», Россия).
Затем планшеты с клетками инкубировали в термостате в течение 3 ч при 37 0С, 5% СО2. После инкубации супернатант из лунок аккуратно отбирали шприцом и вносили в каждую лунку планшета по 100 мкл ДМСО (диметилсульфоксида) («Serva», Германия), перемешивали 30 мин для растворения образовавшихся кристаллов формазана. Развитие окраски регистрировали с помощью определения оптической плотности при λ=530 нм на планшетном фотометре «Униплан» АИФР-01 («Пикон», Россия). Оптическую плотность контрольных образцов, в
отсутствие исследуемых соединений, принимали за 100% жизнеспособность клеток. Погрешность измерения составила ±0,007%.
57
2.2.7. Определение уровня ФНО-α иммуноферментным анализом
Для анализа концентрации цитокина отбирали по 100 мкл супернатанта из каждой лунки планшета по окончании инкубации c веществами (п. 2.2.5.)
Иммуноферментный анализ проводили согласно инструкции, прилагаемой к набору готовых реагентов альфа-ФНО-ИФА-БЕСТ («Вектор-БЕСТ», Россия).
Регистрацию результатов проводили с помощью планшетного фотометра
«Униплан» АИФР-01 («Пикон», Россия) при длине волны 450 нм. Погрешность измерения составила ±0,008%.
2.2.8. Выделение мРНК из клинического материала
Выделение РНК из клеток МНФК периферической крови проводили методом преципитации с помощью набора готовых реагентов "Рибо-преп" (ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Россия) согласно инструкции производителя.
2.2.9. Реакция обратной транскрипции для получения кДНК
Получение кДНК на матрице мРНК осуществляли реакцией обратной транскрипции с использованием комплекта готовых реагентов "Реверта-L" (ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, Россия) согласно инструкции производителя.
2.2.10. Полимеразная цепная реакция в реальном времени для
определения уровня экспрессии генов
Для реакции использовали набор реактивов для ПЦР "Реакционная смесь
2,5х для проведения ПЦР-РВ в присутствии SYBR Green I" («Синтол», Россия) на

58
приборе iCycler iQ 5 real-time PCR («BioRad», Германия). В качестве
контрольного гена использовали ген GAPDH.
Для постановки 12 реакций с праймерами для одного гена в 1,5 мл микроцентрифужные пробирки добавляли 117 мкл H2Oдд, 117 мкл MIX-смеси, 13
мкл MgCl2, перемешивали и отбирали 19 мкл полученной смеси в 200 мкл микропробирки для первого контроля. Затем в полученную смесь вносили по 24
мкл прямого и обратного праймеров (up и low), перемешивали и отбирали 23 мкл полученной смеси в 200 мкл микропробирки для второго контроля.
Последовательности нуклеотидов в используемых праймерах представлены в
таблице 6 («Синтол», Россия).
Таблица 6.
Последовательности нуклеотидов (5’-3’ последовательности) в
праймерах для определения экспрессии генов мембранных и ядерных
рецепторов прогестерона и эстрадиола.
|
Прямой |
Обратный |
|
|
|
GAPDH |
gaa-ggt-gaa-ggt-cgg-agt |
gaa-gat-ggt-gat-ggg-att-tcc |
|
|
|
mER |
agg-gac-aag-ctg-agg-ctg-ta |
gtc-tac-acg-gca-ctg-ctg-aa |
|
|
|
ERα |
tgc-caa-gga-gac-tcg-cta-ct |
ctg-gcg-ctt-gtg-ttt-caa-c |
|
|
|
ERβ |
tca-gct-tgt-gac-ctc-tgt-gg |
tgt-atg-acc-tgc-tgc-tgg-ac |
|
|
|
PR-A |
aaa-tca-ttg-cca-ggt-ttt-cg |
tac-agc-atc-tgc-cca-ctg-ac |
|
|
|
PR-B |
gac-tga-gct-gaa-ggc-aaa-gg |
cga-aac-tcc-agg-caa-ggt-gt |
|
|
|
mPR |
tgc-cct-gct-gtg-tga-tct-ta |
gat-agc-tga-ggc-tcc-tgg-at |
|
|
|
PGRmC1 |
tgc-cct-gct-gtg-tga-tct-ta |
gat-agc-tga-ggc-tcc-tgg-at |
|
|
|
Примечание: ген сравнения – GAPDH (глицеральдегид-
фосфатдегидрогеназа); mER – мембранные рецепторы эстрадиола, ERαи ERβ–
ядерные рецепторы эстрадиола, mPR и PGRmC1 – мембранные рецепторы прогестерона, PR-Аи PR-В – ядерные рецепторы прогестерона.
59
После приготовления готовой реакционной смеси ее вносили по 23 мкл в
200 мкл микропробирки, добавляли по 2 мкл кДНК, тщательно перемешивали и ставили в прибор iCycler iQ5 real-time PCR («BioRad», Германия). Затем запускали программу амплификации и плавления.
1. Программа амплификации:
а) 1 цикл: 10:00 мин – 95 0С;
б) 2-40 циклы: 00:15 мин – 95 0С, 01:00 мин – 60 0С.
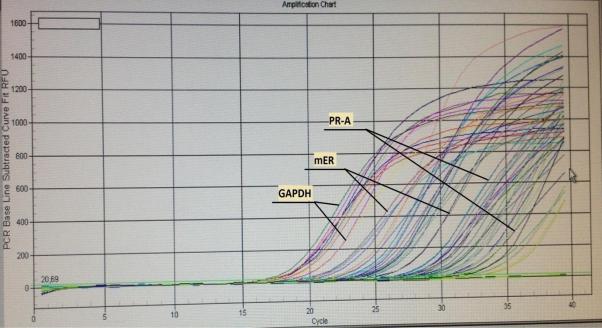
В результате эксперимента получали кривые амплификации и плавления
(рисунки 7, 8), которые позволяли определить численные значения уровней экспрессии изучаемых генов.
Рисунок 7.
Кривые амплификации кДНК на примере генов GAPDH, mER, PR-A.
2. Программа плавления: a) 1 цикл: 01:00 мин – 950C;
б) 2 цикл: 01:00 мин – 55 0С; в) 3-84 цикл: 00:10 мин – 55 0С
60
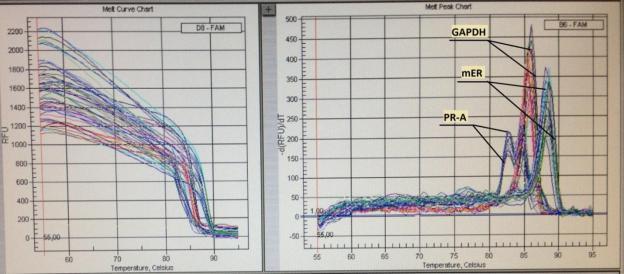
Рисунок 8.
Кривые плавления продуктов амплификации на примере генов Gapdh,
mER, PR-A.
Для оценки числа копий мРНК применяли Сt-метод по формуле 1/2-∆Ct
(для выявления различий) и 2-∆∆Ct (для определения кратности разницы), где Ct –
пороговый цикл (threshold cycle), соответствующий числу циклов амплификации,
необходимых для достижения порогового значения флуоресценции, ∆Сt – разница между пороговым циклом исследуемого гена и геном сравнения (GAPDH), ∆∆Сt –
сравнение значений ΔCt контрольного и опытного образцов [89].
2.2.11. Статистическая обработка результатов
Все данные исследования обрабатывали с использованием программ
Microsoft Office Excel 2007 и GraphPad Prism 5.0. Результаты представили в виде среднего значения (М) и стандартной ошибки (SE).
Для проверки гипотезы о принадлежности наблюдаемой выборки нормальному закону распределения использовали критерий Колмогорова-
Смирнова. При параметрическом распределении изучаемых параметров для
