
- •СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ
- •ГЛАВА I
- •1.1.1 Особенности этиологии, патогенеза и клинической картины форм ПМД, обуславливающие различные подходы в реабилитации детей
- •1.1.3. Особенности состояния здоровья детей с МДД
- •1.2. Современные подходы к реабилитации детей с МДД
- •1.2.1. Медикаментозные методы терапии детей с МДД
- •1.3. Эффективность систем виртуальной реальности (ВР) в реабилитации взрослых и детей с различными заболеваниями
- •1.3.1. Игровые системы ВР в педиатрической практике
- •1.4. Совершенствование системы раннего выявления и реабилитации детей с ПМД
- •1.4.1. Существующие подходы к раннему выявлению детей с отклонениями в развитии как маркеру ПМД
- •ГЛАВА II.
- •2.3 Методы исследования
- •ГЛАВА III.
- •3.1.1. Особенности генеалогического, биологического анамнеза у детей с ПМД
- •3.1.2 Клиническая характеристика детей с ПМД
- •3.1.3. Результаты лабораторных и инструментальных исследований детей с ПМД
- •3.2. Эффективность реабилитации детей с ПМД с использованием cистемы виртуальной реальности (ВР)
- •3.2.1 Шкалы МFM, Vignos и Brooke как критерии оценки эффективности систем ВР в реабилитации детей с ПМД и МДД
- •Глава IV
- •Полученные данные о показателях нервно-психического развития детей с ПМД, о влиянии и взаимосвязи многих факторов биологического анамнеза указывают на высокую значимость этих показателей в ранней диагностике ПМД.
- •4.3. Результаты оценки нервно-психического развития детей первого года жизни с использованием компьютерной версии KID-опросника
- •ЗАКЛЮЧЕНИЕ
- •ВЫВОДЫ
- •ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- •СПИСОК ЛИТЕРАТУРЫ
- •ПРИЛОЖЕНИЯ
- •Приложение 1
- •Приложение 3
- •Приложение 4
- •BOTMP =Bruininks–Oseretsky test of motor proficiency; VMI= Developmental Test of Visual Motor Integration Test; TSIF= Test for Sensory Integration Function; ICF= International Classification of Functioning
- •Приложение 6
- •Приложение 7
- •Приложение 8
- •Приложение 9
- •Приложение 10
- •Приложение 11
- •Приложение 12
59
3.1.2 Клиническая характеристика детей с ПМД
Одним из критериев состояния здоровья детей является уровень физического развития и степень его гармоничности. По данным Т.В. Русовой (1996) [25], установлена зависимость темпов физического и интеллектуального развития учащихся в школьном возрасте от гармоничности физического, интеллектуального развития, биологического созревания и моторной зрелости на момент начала обучения, поэтому важным для нас является анализ этих показателей.
Средний рост 61 детей составил 122,41±11,95 и средний вес 25,63±10,61 кг. У детей с МДД средний рост был 121,82±11,08 см (n=34) и средний вес
26,73±11,77кг (n=36).
Важным являлся анализ клинических данных, специфичных для данного заболевания. Выявлена зависимость наличия псевдогипертрофии мышц от типов ПМД (различия достоверны, p<0,001). Выявлено, что псевдогипертрофии икроножных мышц наиболее подвержены дети с МДД – из всех детей она определена в этой подгруппе в 38 (97,4%) детей, в 6 (66,7%) случаев среди детей с ПМД Эрба-Рота и в 2 (28,6%) случаев среди детей с ПМД неуточнённой формы. Из 68 детей с ПМД, у 22 (32,4%) не наблюдали псевдогипертрофию икроножных мышц (у всех детей с ПМД Ландузи-Дежерина, врожденной ПМД, ПМД ЭмериДрейфуса псевдогипертрофии не обнаружено).
Учитывая частые изменения по стороны костно-мышечной системы у детей с ПМД (как вследствие самого заболевания, так и вследствие стероидной терапии), нами был проведен анализ частоты встречаемости нарушений со стороны этой системы. Из 67 детей с ПМД, у 5 (7,5%) детей не отмечали патологии со стороны позвоночника; у 27 (40,3%) детей был выявлен сколиоз; у 12 (17,9%) детей – кифоз и у 23 (34,3%)детей – гиперлордоз позвоночника.
Анализ силы мышц конечностей, рефлексов и наличия/отсутствия контрактур представлял большую ценность для решения вопроса о назначении реабилитациии,вчастности, лечебнойфизкультурыспомощьюсистемыВР, детям с ПМД.
60
В среднем сила мышц верхних конечностей у 66 детей с ПМД по 5 -бальной системе составляла 3,64±0,8балла, сила мышц нижних конечностей– 3,0±0,86 балл и сила ягодичных мышц – 2,73±0,87 балл (табл. 5).
Таблица 5 Распределение детей с ПМД в зависимости от силы мышц верхних, нижних
конечностей и ягодичных мышц
Диагноз |
|
Сила мышц |
Сила мышц |
Сила |
|
|
верхних |
нижних |
ягодичных |
||
|
|
конечностей |
конечностей |
мышц |
|
МДД |
M |
3,61 |
2,87 |
2,63 |
|
N |
38 |
38 |
38 |
||
|
σ |
0,823 |
0,875 |
0,875 |
|
ПМД Ландузи- |
M |
3,5 |
4 |
3 |
|
N |
2 |
2 |
2 |
||
Дежерина |
|
|
|
|
|
σ |
0,707 |
0 |
0 |
||
|
|||||
Врожденная |
M |
3,13 |
2,38 |
2,13 |
|
N |
8 |
8 |
8 |
||
ПМД |
|||||
σ |
0,641 |
0,916 |
0,835 |
||
|
|||||
ПМД Эрба-Рота |
M |
4 |
3,22 |
2,89 |
|
N |
9 |
9 |
9 |
||
|
σ |
0 |
0,441 |
0,601 |
|
ПМД Эмери- |
M |
3,67 |
3,33 |
3,33 |
|
|
|
|
|
||
N |
3 |
3 |
3 |
||
Дрейфуса |
|||||
σ |
0,577 |
0,577 |
0,577 |
||
|
|||||
ПМД не |
M |
4 |
3,83 |
3,5 |
|
уточнённой |
|
|
|
|
|
N |
6 |
6 |
6 |
||
формы |
|
|
|
|
|
σ |
1,265 |
0,408 |
0,837 |
||
|
|||||
Всего |
M |
3,64 |
3 |
2,73 |
|
N |
66 |
66 |
66 |
||
|
σ |
0,797 |
0,859 |
0,865 |
|
р |
|
0,259 |
0,008 |
0,042 |
61
3.1.3. Результаты лабораторных и инструментальных исследований детей с ПМД
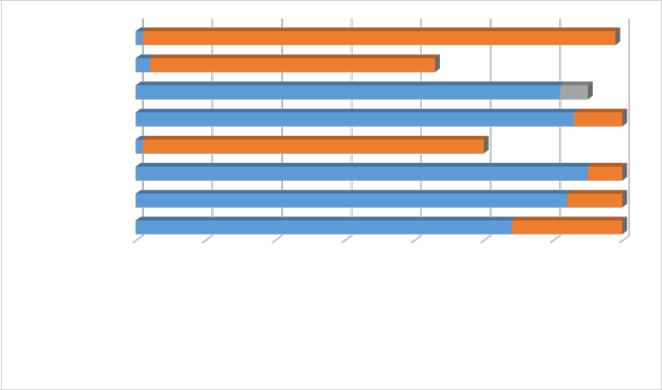
По данным биохимического анализа повышение АЛТ обнаружено у 77,1% детей,АСТ– у88,6%, КФК –у92,9%,ЩФ– у2,0%,ЛДГ– у90,0%, неорганический фосфор – у 4,7%, общий белок – у 1,4%. Общий кальций был ниже нормы у 6,2% детей и в пределах нормы у 93,8% детей (диагр.6).
Общий белок Неорг. фосфор Общий Кальций ЛДГ ЩФ КФК АСТ АЛТ
|
|
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АЛТ |
АСТ |
КФК |
ЩФ |
ЛДГ |
Общий |
Неорг. |
Общий |
|
|
|
Кальций |
фосфор |
белок |
|||||
|
|
Выше нормы |
54 |
62 |
65 |
1 |
63 |
61 |
2 |
1 |
|
|
|||||||||
|
|
|||||||||
|
|
Норма |
16 |
8 |
5 |
49 |
7 |
0 |
41 |
68 |
|
|
|||||||||
|
|
|||||||||
|
|
Ниже нормы |
0 |
0 |
0 |
0 |
0 |
4 |
0 |
0 |
|
|
|||||||||
|
|
Диагр.6. Результаты биохимического анализа у детей с ПМД Былаустановленазависимостьрезультатовбиохимическогоанализакровиот
различныхформ ПМД. Так, уровеньповышения КФКв крови зависелот типа ПМД (корреляционная связь достоверна, р=0,001). Самый высокий уровень КФК в крови было отмечен у детей с МДД (в среднем 15631,25±13422,80 Ед/л). На втором месте
– дети с ПМДнеуточнённойформы(всреднем5097,00±7035,99 Ед/л),далее– ПМД Эрба-Рота (в среднем 4081,40±6041,95 Ед/л), ПМД Ландузи-Дежерина (в среднем 908,0±83,44 Ед/л), ПМД Эмери-Дрейфуса (в среднем 679,00±167,05 Ед/л) и врожденная ПМД (в среднем 515,25±507,93 Ед/л). Согласно данным литературы, чрезмерное повышение КФК обычно встречается при МДД и при нескольких
62
формах ПМД Эрба-Рота (LGMD 1C, LGMD 2A, LGMD 2B). [116] При остальных видах ПМД обычно отмечается нормальный уровень или умеренное повышение КФК [116].
Было установлено, что уровень АСТ (корреляционная связь достоверна, р<0,001),АЛТ (корреляционная связь достоверна,р<0,001) и ЛДГ (корреляционная связь достоверна, р<0,001) в крови также связан с типом ПМД. Самый высокий уровень АСТ в крови отмечен у детей с МДД (в среднем 193,98±69,80 МЕ/л). За этим – последовали дети с ПМД неуточнённой формы (в среднем 207,86±122,31 МЕ/л), ПМД Эрба-Рота (в среднем 96,30±61,39 МЕ/л), ПМД Эмери-Дрейфуса (в среднем69,67±26,65МЕ/л),ПМДЛандузи-Дежерина(всреднем53,00±11,31МЕ/л) и врожденная ПМД (в среднем 36,25±18,13 МЕ/л).
Самый высокий уровень АЛТ в крови был также отмечен у детей с МДД (в среднем 229,12±81,82 МЕ/л). За этим (по мере понижения) следовали дети с ПМД неуточнённой формы (в среднем 172,49±108,15 МЕ/л), ПМД Эрба-Рота (в среднем 132,10±103,98 МЕ/л), ПМД Ландузи-Дежерина (в среднем 42,50±13,43 МЕ/л), врожденная ПМД (в среднем 34,23±13,74 МЕ/л) и ПМД Эмери-Дрейфуса (в среднем 32,67±4,51 МЕ/л).
Самый высокий уровень ЛДГ в крови был отмечен также у детей с МДД (в среднем 1512,55±549,41 Ед/л). На втором месте (по мере понижения) – дети с ПМД неуточнённой формы (в среднем 1184,29±620,50 Ед/л), ПМД Эрба-Рота (в среднем 1006,40±520,49 Ед/л), ПМД Эмери-Дрейфуса (в среднем 674±235,06 Ед/л), ПМД Ландузи-Дежерина (в среднем 635±363,45 Ед/л) и врожденная ПМД (в среднем 586,88±214,28 Ед/л). По данным литературы, чрезмерное повышение АСТ, АЛТ и ЛДГ бывает при МДД [116]. При остальных видах ПМД обычно отмечается нормальный уровень или умеренное повышение АСТ, АЛТ и ЛДГ [116].
При анализе данных ЭКГ и ЭХО-КГ было установлено, что из 67 детей с ПМД у 28 (42,0 %) детей патологии со стороны сердечно-сосудистой системы было не обнаружено. У 17 (25,4%) детей были признаки кардиомиопатии, у 22 (33,0%) детей наблюдалась кардиопатия (различия достоверны, p=0,002).
63
По данным УЗИ и/или гастроскопии было установлено что, из 67 детей 16 (23,9%) имели патологию со стороны желудочно-кишечного тракта.
По данным исследования ФВД, проведенного 53 детям с ПМД, у 18 (34,0%) детей были отмечены легкие реструктивные нарушения, у 21 (39,6%) детей наблюдались умеренные реструктивные нарушения и у 11 (20,8%) детей – выраженные нарушения. Среднее значение ЖЕЛвд у детей с ПМД составлял 66,77±15,13, средний ЖЕЛвыд у детей с ПМД составлял 81,47±16,58 и средний ПИП у детей с ПМД составлял 50,91±47,61.
По данным денситометрии, у 59 детей с ПМД, проблемы с минеральной плотностью костной ткани на период обследования не были обнаружены. У 7 (9,7%) детей отмечали остеопороз и у 1 (1,4%) ребенка – остеопению.
При анализе полученных статистических данных о состоянии здоровья детей
сПМД, были выявлены следующие особенности:
–корреляционная зависимость между типом ПМД и полом детей (различия достоверны, р<0,001). Все дети с МДД и ПМД Эмери Дрейфуса были мальчиками. Все дети с ПМД Ландузи-Дежерина были девочками. В группе врожденной ПМД и ПМД Эрба-Рота присутствовали оба пола. Этот факт можно объяснить тем, что МДД и ПМД Эмери-Дрейфуса наследуются по рецессивному, сцепленному с Х- хромосомой типу, и при этом типе заболевания болеют чаще мальчики и очень редко девочки [7]. ПМД Ландузи-Дежерина наследуется чаще по аутосомнодоминантному типу, при котором болеют обычно оба пола, хотя и, по данным литературы, у девочек это заболевание отмечается раньше, чем у мальчиков [16]. Врожденная ПМД и ПМД Эрба-Рота наследуются чаще по аутосомнорецессивному типу наследования, при котором оба пола болеют одинаково [167, 188];
– выявлена зависимость диагноза ПМД от наличия отягощённого анамнеза по нейромышечным заболеваниям (различия достоверны, р=0,004). Наличие отягощённого анамнеза по нейромышечным заболеваниям встречается чаще среди детей с типами ПМД, которые наследуются по рецессивному, сцепленному с Х-
64
хромосомой типу (МДД и с ПМД Эмери-Дрейфуса), чем среди детей с другими видами ПМД;
–способ диагностики/подтверждения заболевания зависит от типа ПМД (различия достоверны, р<0,001). У большинства детей с МДД подтверждение диагноза происходило с помощью биопсии мышц и ДНК-диагностики. У детей с ПМД Ландузи-Дежерина диагноз подтверждался при клиническом осмотре. У большинства детей с ПМД Эмери-Дрейфуса, врожденной ПМД, ПМД Эрба-Рота и ПМД неуточнённой формы диагноз подтверждался с помощью биопсии мышц. При всех видах ПМД (при неотягощённом семейном анамнезе) проводили в первую очередь биопсию мышц и, при получении данных в пользу ПМД, проводили ДНК-диагностику. У детей с МДД после биопсии проводили экспрессДНК диагностику методом мультиплексной ПЦР, при которой можно диагностировать самые распространенные делеции в гене дистрофина (обычно до 70-90% случаев) [2]. Характерная клиническая симптоматика при ПМД ЛандузиДежерина (заболевание обычно «распространяется» на верхнюю часть тела и реже
–ниже) позволяет подтверждать диагноз клинически, без проведения биопсии и ДНК-диагностики. При ПМД Эмери-Дрейфуса подтверждение диагноза в большинстве случаев проводили по результатам биопсии мышц, так как примерно
в64% случаев ДНК-диагностика не помогает в определении точной мутации в генах EMD, FHL1 и LMNA [99]. При врожденной ПМД и ПМД Эрба-Рота редко можно подтверждать диагноз с помощью ДНК-диагностики, так как мутации происходят в большом количестве генов [82];
–тип ПМД связан с наличием патологии со стороны сердечно-сосудистой системы (различия достоверны, р=0,002). Проблемы со стороны сердечнососудистой системы были диагностированы у 32 (84,2%) детей с МДД, у 1 (33,3%) ребенка с ПМД Эмери-Дрейфуса, у 2 (28,6%) детей с ПМД неуточнённой формы, у 2 (25,0%) детей с врожденной ПМД, у 2 (22,2%) детей с ПМД Эрба-Рота и не обнаружены у детей с ПМД Ландузи-Дежерина. По данным литературы, при ПМД Ландузи-Дежерина редко встречаются проблемы с этой системой [135]. У детей с
65
МДД, ПМД Эрба-Рота, и ПМД Эмери-Дрейфуса проблемы с сердечно-сосудистой системой бывают очень часто и зависят от возраста ребенка, от темпа прогрессирования заболевания и т.д. [56, 167]. При врожденной ПМД проблемы отмечаются при нескольких субтипах заболевания [188];
–была выявлена зависимость силы мышц нижних конечностей от типов ПМД (корреляционная связь достоверна, р=0,008). Дети с врожденной ПМД имеют самую низкую силу мышц среди всех детей с ПМД (в среднем 2,38±0,92 балл). На втором месте (по мере повышения силы мышц) находятся дети с МДД (в среднем 2,87±0,88 балл), на третьем (по мере повышения силы) – дети с ПМД Эрба-Рота (в среднем 3,22±0,44 балл), дети с ПМД Эмери-Дрейфуса (в среднем 3,33±0,58 балл)
идети с ПМД неуточнённой формы (в среднем 3,83±0,41 балл). Дети с ПМД Ландузи-Дежерина имеют самую высокую оценку силы мышц среди всех детей с ПМД (в среднем 4,00±0,00 балл);
–выявлена связь между различными формами ПМД и силой ягодичных мышц (корреляционная связь достоверна, р=0,042). Среди всех детей с ПМД самую низкую силу ягодичных мышц имели дети со врожденной ПМД (в среднем 2,13±0,835 балл). На втором месте – дети с МДД (в среднем 2,63±0,88 балл), далее: дети с ПМД Эрба-Рота (в среднем 2,89±0,60 балл), дети с ПМД Ландузи-Дежерина (в среднем 3,00±0,00 балл), дети с ПМД Эмери-Дрейфуса (в среднем 3,33±0,58 балл) и дети с ПМД неуточнённой формы (в среднем 3,50±0,84 балл).
Очевидно, что полученные результаты также обусловлены особенностями клинической картины при различных формах ПМД. Так, врожденная ПМД считается одной из наиболее злокачественных типов ПМД из-за ранней прогрессирующей мышечной слабости и гипотонии (чаще с рождения), нарастания контрактур суставов верхних и нижних конечностей и деформации позвоночника. ДетиприврожденнойПМДобычноотстаютвразвитииивмногих случаевнеходят
срождения [188]. При МДД мышечная слабость нижних конечностей отмечается в среднем с 5 лет и прогрессирует во всем теле по мере взросления ребенка [82]. При ПМД Эрба-Рота вначале нарастает мышечная слабость и атрофия мышц тазового
