
диссертации / 27
.pdfУ семидесяти семи (61,1%) пациентов имелось сочетание более 2
модулируемых факторов риска.
При проведении лабораторно-инструментальных методов иследования получены следующие данные.
Показатели липидограммы представлены в Табл. 3.1:
Таблица 3.1
Данные липидограммы у пациентов с ИИ
Показа- |
Все |
АТ |
Лак |
КЭ |
ИДИЭ |
ИНЭ |
тель |
пациенты |
инсульт |
инсульт |
инсульт |
|
|
|
|
|
|
|
|
|
хол |
5,1±1,46 |
5,44±2,1 |
5,53±0,93 |
4,33±1,24 |
4,29±1,18 |
4,84±0,83 |
|
|
|
|
|
|
|
ТГ |
1,8±1,18 |
2,28±0,98 |
2,47±1,74 |
1,2±0,87 |
1,41±0,71 |
1,23±0,51 |
|
|
|
|
|
|
|
ХВП |
1,03±0,34 |
0,92±0,39 |
0,97±0,31 |
1,01±0,31 |
1,11±0,21 |
1,20±0,32 |
|
|
|
|
|
|
|
ЛПНП |
3,17±0,91 |
3,30±0,94 |
3,45±0,85 |
2,83±0,99 |
2,71±1,01 |
3,07±0,85 |
|
|
|
|
|
|
|
ЛПОНП |
0,72±0,43 |
0,89±0,37 |
0,91±0,58 |
0,46±0,32 |
0,79±0,29 |
0,46±0,20 |
|
|
|
|
|
|
|
КА |
4,2±2,17 |
5,38±2,36 |
4,88±1,9 |
3,37±1,33 |
2,53±2,05 |
3,26±1,58 |
|
|
|
|
|
|
|
При сравнения показателей липидограммы у пациентов с разными патогенетическими вариантами ишемического инсульта в молодом возрасте статистически достоверных различий не получено (р>0,05).
Средний уровень глюкозы во всей группе пациентов с ИИ был
5,88±1,87 ммоль/л; у больных с АТ вариантом 6,34±2,25 ммоль/л, в группе с КЭ инсультом - 4,98±0,84 ммоль/л, у пациентов с лакунарным патогенетическим вариантом - 6,3±2,62 ммоль/л, у больных с инсультом другой известной этиологии - 5,56±1,01 ммоль/л и у пациентов с
«криптогенным» инсультом - 5,42±0,74 ммоль/л. Различия между средним уровнем глюкозы в группах больных статистически недостоверны (p>0,05).
При исследовании коагулограммы были получены следующие результаты (Табл. 3.2).
71
Таблица 3.2
Данные коагулограммы у пациентов с ИИ
Показатель |
Все |
АТ |
Лак |
КЭ |
ИДИЭ |
ИНЭ |
|
пациенты |
инсульт |
инсульт |
инсуль |
|
|
|
|
|
|
т |
|
|
Антитромби |
92,3±37,7 |
93,6±40,7 |
80±40,1 |
115,3± |
106,4±23 |
87,9±34,7 |
н III (80- |
|
|
|
35,6 |
|
|
120%) |
|
|
|
|
|
|
Протеин С |
99,4±62,9 |
104,7±77, |
68,8±54,8 |
107,2± |
112,1± |
109,5±63,3 |
(70-130%) |
|
3 |
|
13,4 |
23,8 |
|
|
|
|
|
|
|
|
АЧТВ (30- |
35,5±7,9 |
37,2±4,8 |
33,5±5,6 |
36,7± |
32,9±8,8 |
35,5±12,2 |
40 сек) |
|
|
|
2,8 |
|
|
|
|
|
|
|
|
|
Активность |
100,2±35,9 |
85,5±22,2 |
109,7±36,7 |
89,5± |
130,6± |
104,3±36,7 |
факторов |
|
|
|
10,4 |
62,9 |
|
внутреннего |
|
|
|
|
|
|
пути |
|
|
|
|
|
|
образования |
|
|
|
|
|
|
протромбин |
|
|
|
|
|
|
азы в % по |
|
|
|
|
|
|
Квику (70- |
|
|
|
|
|
|
140%) |
|
|
|
|
|
|
Активность |
93,4±15,6 |
92,5±16,3 |
103,9±13,9 |
81,2± |
96,9± |
90,2±13,9 |
факторов |
|
|
|
111,1 |
14,7 |
|
протромбин |
|
|
|
|
|
|
ового |
|
|
|
|
|
|
комплекса в |
|
|
|
|
|
|
% по Квику |
|
|
|
|
|
|
(85-105%) |
|
|
|
|
|
|
МНО (0,9- |
1,1±0,2 |
1,1±0,3 |
0,9±0,1 |
1,2±0,2 |
1,1±0,1 |
1,1±0,2 |
1,2) |
|
|
|
|
|
|
Фибриноген |
344,4± |
390,5± |
392,7± |
279,2± |
328,2± |
282,1±62,2 |
(по |
117,6 |
104,4 |
159,5 |
80,6 |
111,1 |
|
Клауссу) |
|
|
|
|
|
|
(200-400 |
|
|
|
|
|
|
мг/дл) |
|
|
|
|
|
|
Активирова |
45,7±12,9 |
44,7±15,5 |
48,4±11,1 |
46,7±1 |
48,3±16, |
44,2±9,9 |
нное время |
|
|
|
5,7 |
9 |
|
рекальцифи |
|
|
|
|
|
|
кации (30- |
|
|
|
|
|
|
45 сек) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
72 |
Тромбоплас |
103,4±70,7 |
129,4±11 |
87,1±21,9 |
98,2±3 |
84,2±27, |
93,4±33,7 |
тиновая |
|
5,9 |
|
3,1 |
1 |
|
активность |
|
|
|
|
|
|
тромбоцито |
|
|
|
|
|
|
в (80-120) |
|
|
|
|
|
|
|
|
|
|
|
|
|
РФМК (до |
8,5±7,3 |
10,2±7,6 |
7,1±6,2 |
10,3±1 |
8,8±6,4 |
7,2±7,0 |
5,5 г/л/10 (- |
|
|
|
0,4 |
|
|
2)) |
|
|
|
|
|
|
Хагеман- |
12,6±12,5 |
12,8±7,9 |
15,6±21,9 |
17,2±1 |
7,5±2,1 |
10,6±8,7 |
зависимый |
|
|
|
6,1 |
|
|
фибринолиз |
|
|
|
|
|
|
(5-12 мин) |
|
|
|
|
|
|
|
|
|
|
|
|
|
При проведении однофакторного дисперсионного анализа для сравнения показателей коагулограммы у пациентов с разными патогенетическими вариантами ишемического инсульта статистически
достоверных различий не получено (р>0,05).
При анализе агрегатограммы статистически достоверных различий в группах пациентов с различными патогенетическими вариантами инсульта
также получено не было (ANOVA, p>0,05) (Табл. 3.3).
Таблица 3.3
Данные агрегатограммы у пациентов с ИИ
Показатель |
Все |
АТ |
Лак |
КЭ |
ИДИЭ |
ИНЭ |
|
пациенты |
|
|
|
|
|
|
|
|
|
|
|
|
низкотемпер |
1,4±0,8 |
1,3±0,5 |
1,2±0,4 |
1,1±0,2 |
1,2±0,4 |
1,7±1,2 |
атурная |
|
|
|
|
|
|
активация |
|
|
|
|
|
|
|
|
|
|
|
|
|
АДФмД |
22±15,7 |
23,6±16,6 |
16,4±13,1 |
20,7±13,1 |
25,2±16,7 |
23,5±17,2 |
|
|
|
|
|
|
|
АДФсД |
31,1±17,4 |
33,9±17,3 |
25,7±13,9 |
29,7±21,1 |
24,4±15,9 |
35,2±18,9 |
|
|
|
|
|
|
|
АДФбД |
41,1±18,2 |
38,1±19,7 |
36,1±14,8 |
43,2±19,6 |
43,9±23,0 |
46,2±16,9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
73 |
Ристомицин |
65,6±25,2 |
59,3±28,4 |
53,7±21,9 |
69,8±16,0 |
73,8±37,7 |
78,1±15,9 |
|
|
|
|
|
|
|
Коллаген |
48,2±20,9 |
42,8±22,2 |
43,1±24,7 |
50,7±21,3 |
52,1±17,0 |
55,4±17,1 |
|
|
|
|
|
|
|
Уровень гомоцистеина был определен у 68 пациентов с атеротромботическим, лакунарным и инсультом неустановленной этиологии.
У 53 (77,9%) пациентов уровень гомоцистеина превышал верхнюю границу нормы (11,0 мкмоль/мл). У пациентов с АТ инсультом средний уровень гомоцистеина составил 18,7±5,2 мкмоль/мл, у больных с лакунарным вариантом ИИ – 12,1±2,9 мкмоль/мл, в группе пациентов с инсультом неустановленной этиологии 12,9±4,0мкмоль/мл. Таким образом, при проведении однофакторного дисперсионного анализа, было выявлено,
статистически достоверное увеличение среднего уровня гомоцистеина у пациентов с АТ вариантом ИИ (ANOVA, p<0,001).
Ультразвуковое исследование магистральных артерий головы проводилось 92 пациентам. Атеросклеротические изменения выявлены у 71
(77,2%) больного. Стенозирующий атеросклеротический процесс обнаружен у 52 (56,5%) пациентов. Стенозы малых градаций (до 50%) выявлены у 30
(32,6 %) больных, средних (50-69%) – у 12 (13,0%) пациентов, больших (7099%) – у 10 (10,9%) человек. Осложненные атеросклеротические бляшки выявлены у 34 (36,96%) пациентов.
При сравнении средних показателей липидограммы у пациентов с наличием и отсутствием атеросклеротических изменений (Табл. 3.4), а также наличием и отсутствием стенозирующего атеросклероза (Табл. 3.4) наиболее тесная взаимосвязь наличия атеросклеротических изменений и стенозирующего атеросклероза отмечается при увеличении коэффициента атерогенности (ANOVA).
74
Таблица 3.4
Сравнение показателей липидограммы при наличии
атеросклеротических изменений
Показатели |
Атеросклеротич |
p |
Характер |
|
p |
|
липидограм |
еские изменения |
|
атеросклероза |
|
||
мы |
|
|
|
|
|
|
|
есть |
нет |
|
Стенозиру |
Нестеноз |
|
|
|
|
|
ющий |
ирующий |
|
|
|
|
|
|
|
|
холестерин |
5,4±1,6 |
4,5±0,9 |
p=0,008* |
5,4±1,7 |
4,8±1,0 |
p=0,065 |
|
|
|
|
|
|
|
ХВП |
0,9±0,3 |
1,2±0,3 |
p=0,027* |
1,00±0,4 |
1,1±0,3 |
p=0,1 |
|
|
|
|
|
|
|
ЛПНП |
3,3±0,9 |
2,9±0,9 |
p=0,084 |
3,2±0,8 |
3,0±0,9 |
p=0,26 |
|
|
|
|
|
|
|
КА |
4,8±2,1 |
2,9±1,7 |
p<0,001* |
4,7±2,0 |
3,5±2,2 |
p=0,018* |
|
|
|
|
|
|
|
Тромбоз брахиоцефальных артерий обнаружен у 23 (25%) больных, у
восьми из них (8,7%) выявлен окклюзирующий тромбоз, у 18 пациентов
(19,6%) – сочетание тромбоза и атеросклероза. Среди этих пациентов - 14
больных с атеротромботическим инсультом, 7 – с «криптогенным» инсультом (причина тромбоза при обследовании осталась неизвестной), одна пациентка с кардиоэмболическим инсультом (с дефектом межпредсердной перегородки) и одна пациентка с диссекцией ВСА.
При анализе показателей коагулограммы у пациентов с тромбозами БЦА и без них статистически достоверных различий получено не было
(p>0,05, ANOVA).
У 32 (34,78%) больных были выявлены сосудистые аномалии
(гипоплазия позвоночной артерии, передняя трифуркация, задняя трифуркация, деформации сонных артерий, гипертоническая макроангиопатия). В 10 (10,87%) случаях выявлена связь ишемического инсульта с наличием сосудистых аномалий. У восьми (8,7%) пациентов отмечалось сочетание ишемического инсульта в вертебро-базилярном бассейне с гипоплазией позвоночной артерии. У двух пациентов (2,2%)
75
сочетание ишемического инсульта в каротидном бассейне с деформацией внутренних сонных артерий.
При изучении семейного анамнеза выясняли наличие у родственников сердечно-сосудистой патологии (ишемическая болезнь сердца, инфаркт миокарда, артериальная гипертензия), цереброваскулярных заболеваний
(ишемический инсульт), эндокринных и обменных нарушений (сахарный диабет, ожирение).
Семейный анамнез по сосудистым заболеваниям был проанализирован у 89 пациентов. У 48 (53,9%) больных выявлена наследственная отягощенность по инсульту, причем у 20 – по отцовской линии, а у 25 – по материнской. И у трех пациентов – по обеим родительским линиям.
Наследственная отягощенность по инфаркту миокарда была выявлена у 41 (46,1%) пациента (у 19 - по материнской линии, у 21 - по отцовской, у двух -
по обеим родительским линиям). У 64 (71,9%) пациентов выявлена наследственная предрасположенность к артериальной гипертензии, у 42 – по обеим линиям, у 10 - по отцовской, у 12 - по материнской. Наследственность по сердечно-сосудистой патологии из всей выборки выявлена у 76 (85,4%)
пациентов (Рис. 3.7).
76

Рисунок 3.7 Наследственность по сердечно-сосудистой патологии у пациентов с ишемическим инсультом
Наследственность по сахарному диабету 2 типа выявлена у 18 (20,2%)
пациентов. Из них 6 пациентов страдали сахарным диабетом на момент заболевания ИИ, а у 10 больных было выявлено нарушение толерантности к углеводам, только 2 пациента из этой группы на момент заболевания не имели нарушений со стороны углеводного обмена.
Тяжесть ишемического инсульта оценивалась по шкале Национального института здоровья (NIH) [42] на 1 и 21 сутки. Степень функционального восстановления по шкале Bartel [145] на 7-и и 21-и сутки (оценивался у 124
пациентов, в связи с тем, что две пациентки умерли в более короткие сроки).
Получены следующие результаты. Степень выраженности неврологического дефицита у пациентов молодого возраста на 1 сутки составила 7,2±4,4, на 21-
и сутки – 3,4±3,2 (Рис. 3.8).
77
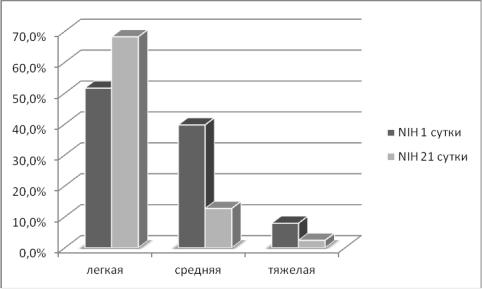
Рисунок 3.8 Степень выраженности неврологического дефицита у пациентов на 1 и 21 сутки
У одного пациента (0,8%) с транзиторной ишемической атакой изменений в неврологическом статусе на момент поступления в стационар не наблюдалось, симптоматика регрессировала на догоспитальном этапе. На 21
сутки полное восстановление неврологического дефицита отмечалось у 21
пациента, что составило 16,7 %
Легкий неврологический дефицит (от 1 до 6 баллов) отмечался на 1-3
сутки у 65 пациентов (51,6%), на 21-и сутки у 86 пациентов (68,2%).
Средний неврологический дефицит (7-13 баллов): на 1-3 сутки у 50
больных (39,7%), на 21-и сутки у 16 (12,7%).
Грубый неврологический дефицит (14 и выше): на 1-3 сутки в 10
случаях (7,9%), на 21-и сутки у 3-х больных (2,4%).
Степень функционального восстановления по шкале Bartel на 7-и сутки составила – 81,6±26,9, на 21-и – 92,7±18,2 (Рис. 3.9).
78
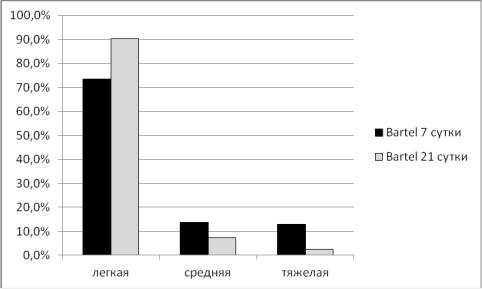
Рисунок 3.9 Степень функционального восстановления по шкале Bartel
на 7-и сутки и 21 сутки На 7-и сутки тяжелая степень инвалидизации отмечалась у 16
пациентов (12,9%). У 17 больных (13,7%) умеренная степень инвалидизации.
Ограничение неврологических функций выявлено у 91 больного (73,4%).
На 21-и сутки тяжелая степень инвалидизации отмечался у 3 пациентов
(2,4%), умеренная - у 9 (7,3%) больных. Ограничение неврологических функций у 112 человек (90,3%)
Таким образом, у всех наблюдавшихся пациентов молодого возраста отмечалось довольно легкое течение заболевания с достаточно быстрым и практически полным восстановлением функций.
Из всей группы больных умерло 2 человека (1,57%). Обе пациентки были женщины, 42 и 23 лет, одна с атеротромботическим вариантом, вторая с инсультом неустановленной этиологии соответственно. Смерть наступила в обоих случаях в связи с острым инфарктом миокарда.
Таким образом, в нашем исследовании у пациентов с ИИ в возрасте до
50 лет преобладают мужчины, в соотношении 3:1. В данной возрастной группе велико значение, как вклада модифицируемых факторов риска, так и наследственной предрасположенности. Более чем у половины пациентов
79
(61,1%) отмечалось наличие 2 и более модифицируемых факторов риска, а у
85% больных была выявлена наследственность по сердечно-сосудистой патологии. У 81,7% пациентов была диагностирована дислипидемия и у
77,2% атеросклеротические изменения брахиоцефальных артерий, у 77,9%
гипергомоцистеинемия. Кроме того, стенозирующий атеросклероз был выявлен в 56,5% случаев с преобладанием стенозов малых градаций (32,6%
больных). Наличие атеросклеротических изменений и стенозирующего атеросклероза наиболее тесно ассоциировано с увеличением коэффициента атерогенности (p < 0,001). У пациентов с атеротромботическим инсультом статистически достоверно увеличен уровень гомоцистеина по сравнению с другими патогенетическими вариантами (p<0,001). При анализе как агрегатограммы, так и коагулограммы статистически достоверных различий среди пациентов выявлено не было. Несмотря на ранний возраст развития сосудистого события, у пациентов имелось сочетание как модифицируемых,
так и немодифицируемых факторов риска, а также раннее развитие атеросклеротических изменений сосудов БЦА, дислипидемии и гипергомоцистеинемии. Кроме того, у большинства больных молодого возраста отмечалось довольно легкое течение заболевания с достаточно быстрым и практически полным восстановлением функций.
80
