
- •Кафедра медицинской и биологической химии
- •Цель лекции
- •РАССМАТРИВАЕМЫЕ ВОПРОСЫ
- •Образование комплексных
- •Строение комплексных
- •Основы теории Вернера
- •Строение комплексного
- •Координационное число в комплексном соединении
- •Координационное число (КЧ) комплекса и его пространственная структура
- •Координационное число (КЧ) комплекса и
- •Координационное число (КЧ) комплекса и
- •Пространственная изомерия в комплексах ведёт к образованию комплексков разного цвета
- •Другие виды изомерии
- •Классификация комплексов
- •Классификация комплексов
- •Номенклатура комплексных соединений
- •Номенклатура комплексных
- •Природа связи в комплексных
- •Химическая связь в комплексах
- •Устойчивость комплексных
- •Биологически активные комплексные соединения. Хелаты
- •Аминокислоты образуют с гидроксидами или солями металлов комплексные соединения
- •Слово хелат произошло от греческого слова Chele – клешня
- •Биологически активне комплексные
- •Ферроцен
- •Природные хелатные комплексы
- •Тетрапиррольные соединения
- •Витамин В12
- •Двунатриевая соль этилендиамминтетрауксусной кислоты (Комплексон-III)
- •Комплексонометрия
- •Хелатотерапия
- •Правила хелатотерапии
Кафедра медицинской и биологической химии
Медицинская химия I КУРС
ТЕМА: Комплексные соединения.
Биологически активные комплексы
ЛЕКЦИЯ №5
Цель лекции
Более 700 соединений, участвующих в
обмене веществ организма являются комплексными соединениями. Для изучения действия ферментов в организме необходимо знать их структуру и свойства в качестве комплексных соединений.
При отравлении металлами, их выводят из организма в виде комплексов с органическими лигандами, что является основой хелатотерапии. Изучение условий комплексообразования позволяет проводить эту работу на более эффективном уровне. Для полного понимания структуры и свойств комплексных соединений возникает необходимость изучения природы химической связи в этих соединениях.
РАССМАТРИВАЕМЫЕ ВОПРОСЫ
1.Образование комплексных соединений 2.Структура комплексных соединений
3.Пространственное строение комплексных соединений
4.Номенклатура комплексных соединений.
5.Природа химической связи в комплексах.
6.Состояние равновесия в растворах комплексных
соединений. Константы нестойкости и устойчивости
комплексных соединений 7.Внутрикомплексные соединения
8. Значение комплексных соединений в медицине. Биокомплексы и их использование.
Образование комплексных
соединений
Комплексные соединения могут образовываться в реакциях обмена при использовании избытка одного из исходных веществ, например:
AgNO3 + KCN = AgCN + K NO3
AgCN + KCN = К [Ag (CN)2]
Таким же образом образуются следующие комплексные соединения:
K PtCl |
Pt(NH ) |

Строение комплексных
соединений
Структура и свойства комплексных соединений объясняется кооординационной теорией, предложенной швейцарским химиком Альфредом
Вернером в 1893 году..
Швейцарский химик Альфред Вернер (1866- 1919), в 1913 году был удостоен Нобелевской премии за заслуги в
области химии
комплексных
соединений.
Основы теории Вернера
1. 1. Центральное место в комплексном соединении занимает центральный атом или комплексообразователь.
2. 2. Вокруг него координируются противоположно заряжённые ионы или нейтральные молекулы, называемые лигандами или аддендами и они вместе образуют внутреннюю координационную сферу комплекса.
3. 3. Ионы, не поместившиеся во внутреннюю сферу располагаются чуть поодаль, образуя внешнюю сферу комплекса.
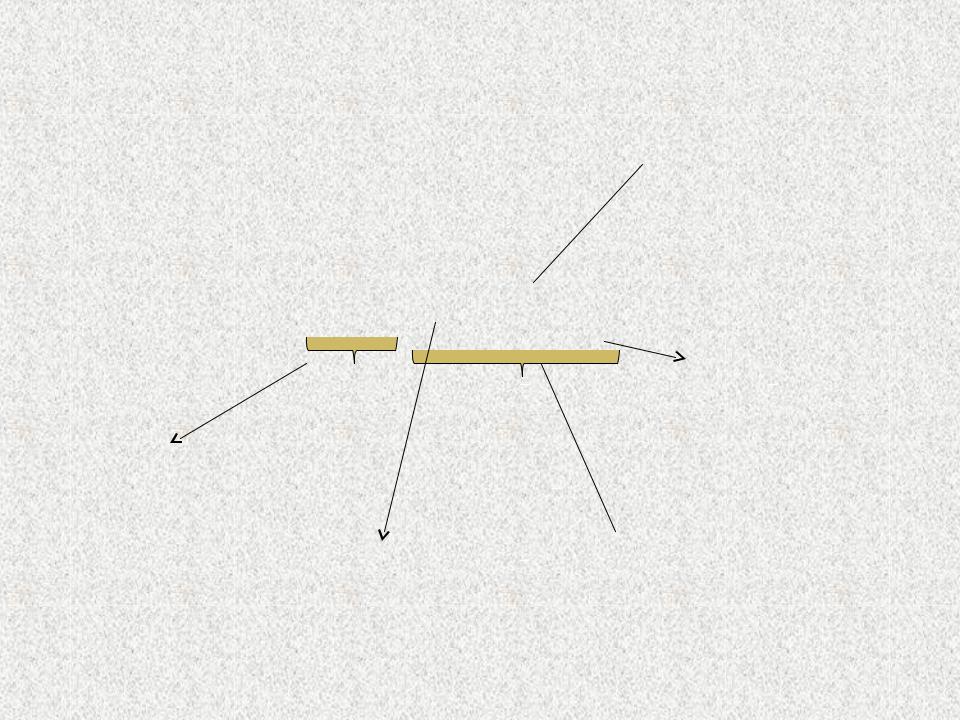
Строение комплексного
соединения
 Лиганды
Лиганды
K3[Fe(CN)6]Координационное
число
Внешняя
сфераЦентральный  Внутренняя атом сфера
Внутренняя атом сфера
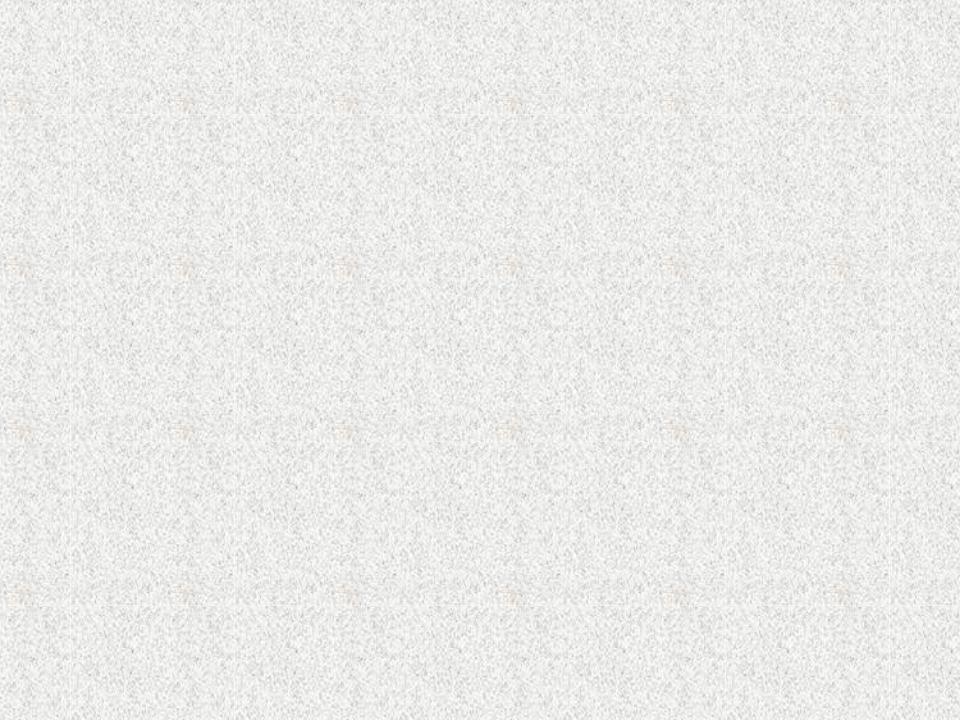
Координационное число в комплексном соединении
Центральный атом
заряд |
координационное число |
+1 |
2 |
+2 |
4, 6 |
+3 |
6, 4 |
+4 |
8 |
Координационное число (КЧ) комплекса и его пространственная структура
КЧ = 2 характерно для Cu(I), |
КЧ = 3 встречается |
|
Ag(I), Au(I) и Hg(II), которые |
||
крайне редко |
||
образуют линейную структуру |
||
K[Cu(CN)3] |
||
( угол 180о) |
||
|
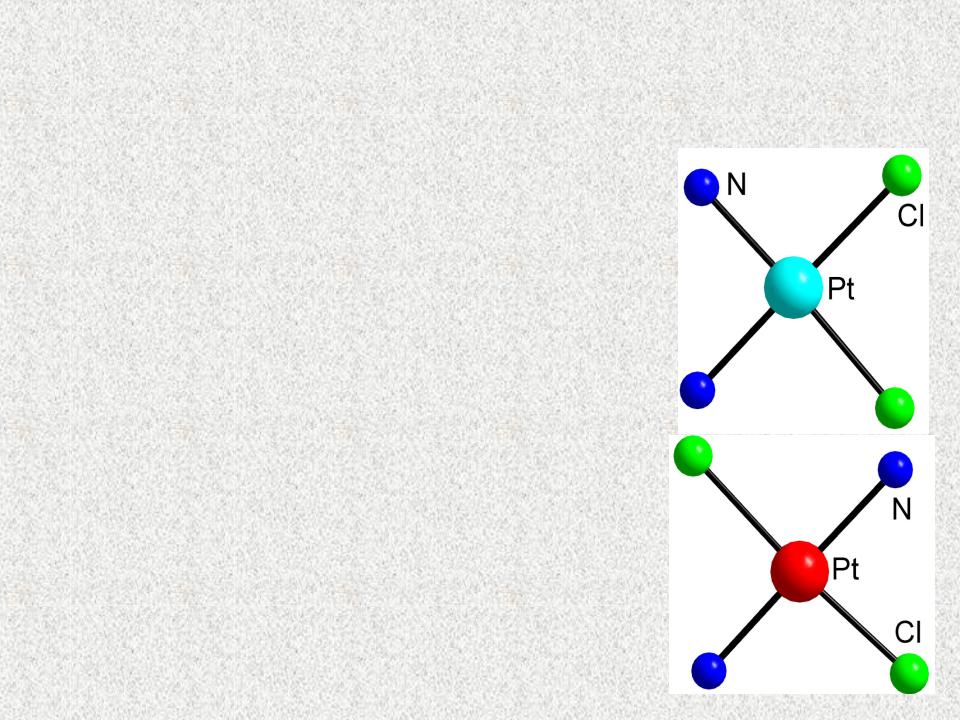
Координационное число (КЧ) комплекса и
его пространственная структура
Квадратная конфигурация более характерна для Ме с электронной структурой d8 - Pt(II) и Pd(II);
Ni(II), Rh(I), Ir(I), Au(III). [Pt(NH3)2Cl2] – Образует два
геометрических изомера – цис- и транс- конфигурации, которые отличаются биологической активностью: цис- изомер используется в медицине как противоопухолевый препарат, транс- изомер является ядом для организма.
