
- •(1) Предмет неорганической химии и ее значение в биологии и охране окружающей среды.
- •(1) Химическая теория образования растворов. (2) Сольваты, гидраты, тепловой эффект растворения. (3) Способы выражения концентрации растворов. (4) Роль растворов в природе.
- •(1) Слабые электролиты. (2) Степень и константа диссоциации. (3) Закон разбавления Оствальда.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель. Роль концентрации водородных ионов в биологических процессах.
- •Свойства буферных растворов
- •Кинетика химических реакции. Закон действия масс.
- •Гомогенный и гетерогенный катализ. Ферментативный катализ.
- •Химическое равновесие и закон действующих масс. Константа равновесия и ее физический смысл. Смещение химического равновесия. Принцип Ле Шателье.
- •Строение атома. Планетарная и квантово-механическая модель.
- •Ковалентная полярная и неполярная связи. Квантово-механическое объяснение ковалентной связи.
- •Кратные связи. Механизм образования двойных и тройных связей, σ- и π- связи. Энергия и длина связи.
- •Водородная связь. Биологическое значение водородной связи.
- •Водород. Химические свойства и способы получения.
- •Натрий, калий. Химические свойства. Оксиды, гидроксиды, соли натрия и калия. Роль в жизнедеятельности организмов.
- •Магний, кальций. Химические свойства. Хлорофилл. Значение кальция и магния для живых организмов.
- •Оксид углерода (II) со, или угарный газ.
- •Оксид углерода (IV), или углекислый газ со2.
- •Азот. Химические свойства. Биологическая роль азота.
- •Кислородные соединения фосфора. Фосфорные удобрения.
- •Кислород. Химические свойства. Озон. Биологическая роль кислорода.
- •Сера. Химические свойства. Оксиды серы. Роль серы и ее соединений в жизнедеятельности растений.
- •Фтор и йод как микроэлементы. Химические свойства и важнейшие соединения.
- •Химия бора и алюминия. Оксиды и гидроксиды. Бор и алюминий в биосистемах.
- •Оксид кремния IV - SiO2
- •Кремниевая кислота
- •Вопросы к экзамену по органической и физколлоидной химии
Ковалентная полярная и неполярная связи. Квантово-механическое объяснение ковалентной связи.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2.
(2) Получить ответ, удовлетворительно объясняющий природу и механизм химической связи, оказалось возможным только после появления квантово-механической теории строения атома, так как при образовании связи проявляются специфические для микрообъектов свойства электронов.
С точки зрения квантовой механики при образовании химической связи между атомами их электронные орбитали перекрываются. В результате в межъядерной области создается повышенная электронная плотность по сравнению с электронной плотностью в изолированных атомах, которая как бы стягивает ядра в единую устойчивую систему. В силу особенностей электронных состояний между ядрами может происходить не повышение электронной плотности, а, наоборот, уменьшение ее до нуля. В этом случае химическая связь не образуется. Причины устойчивости многоатомной частицы заключаются в понижении энергии ее образования.
Донорно-акцепторная связь. Примеры.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
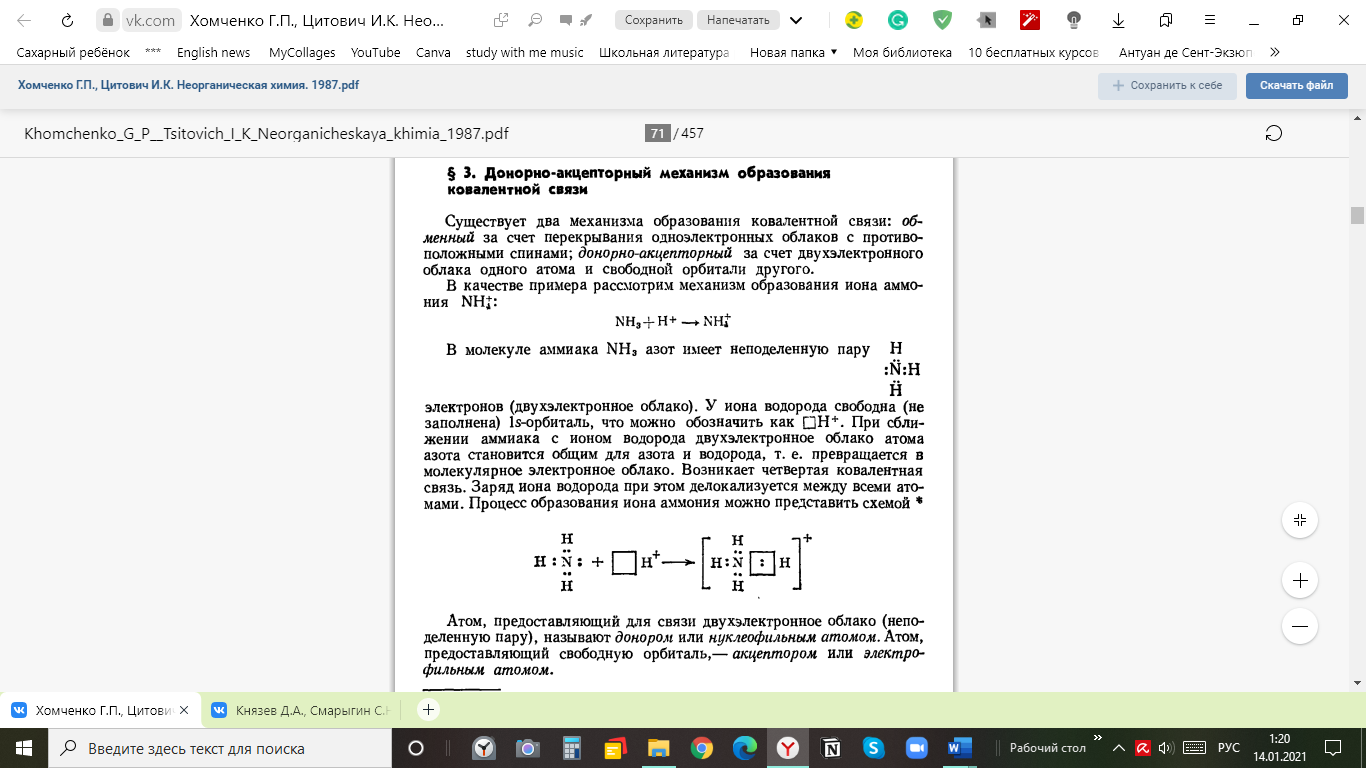
Гибридизация атомных орбиталей. Строение молекул.
Пространственную конфигурацию молекул объясняет теория гибридизации. Гибридизация – это видоизменение и смешивание атомных орбиталей, приводящее к выравниванию их формы и энергии, а, следовательно, к наибольшему их перекрыванию с орбиталями других атомов и выигрышу энергии.
Различают следующие типы гибридизации:
а) sp3 – гибридизация встречается в молекулах, в которых центральный атом имеет четыре гибридные орбитали, образующиеся при смешении одной s - орбитали трех р-орбиталей. Так, например, четыре sp3-гибридные орбитали углерода в молекуле метана направлены в вершины правильного тетраэдра (рис. 10). Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°28'.
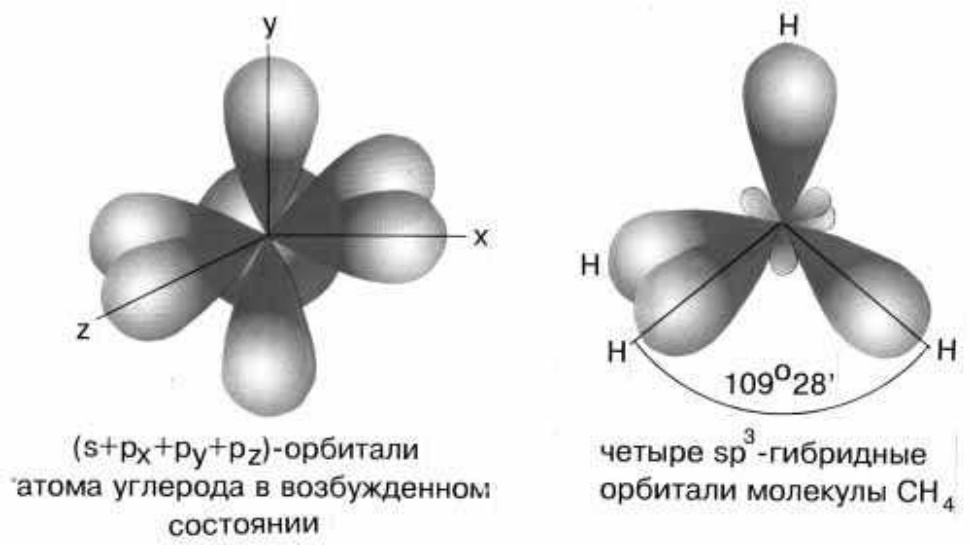
sp3-гибридизация валентных орбиталей углерода в метане.
б) sp2 – гибридизация дает несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3. Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120°. Молекула имеет форму плоского треугольника.
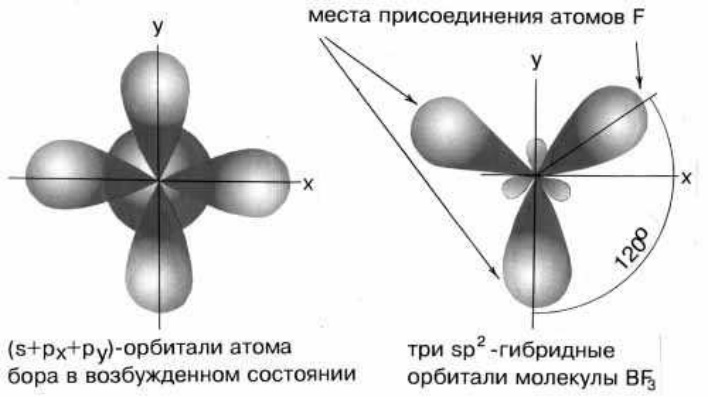
sp2-Гибридизация валентных орбиталей бора в соединении BF3.
в) sp – гибридизация центрального атома приводит к образованию линейных молекул. Например, в молекуле хлорида бериллия BeCl2 все три ее атома находятся на одной прямой, а обе связи Be−Cl совершенно одинаковы (рис. 12). Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы.
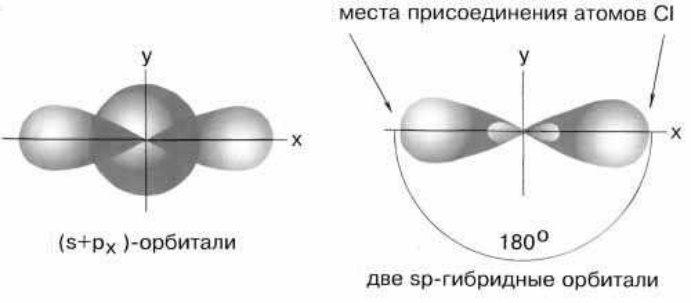
sp-Гибридизация валентных орбиталей бериллия соединении BeCl2.
Если все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не отличаются друг от друга. В других случаях встречаются небольшие отклонения от стандартных валентных углов. Например, в молекуле воды H2O кислород - sp3-гибридный, находится в центре неправильного тетраэдра, в вершины которого "смотрят" два атома водорода и две неподеленные пары электронов (рис. 13а). Валентный угол HОН составляет 105°, а молекула имеет угловую форму.
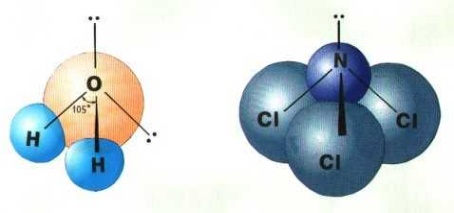 а)
б)
Рисунок
13. sp3-Гибридизация
в молекулах а) H2O
и б) NCl3.
а)
б)
Рисунок
13. sp3-Гибридизация
в молекулах а) H2O
и б) NCl3.
В молекуле трихлорида азота NCl3 (рис.13б) одна не поделенная пара электронов и углы между связями 107,780. Молекула имеет форму неправильной пирамиды.
