
- •(1) Предмет неорганической химии и ее значение в биологии и охране окружающей среды.
- •(1) Химическая теория образования растворов. (2) Сольваты, гидраты, тепловой эффект растворения. (3) Способы выражения концентрации растворов. (4) Роль растворов в природе.
- •(1) Слабые электролиты. (2) Степень и константа диссоциации. (3) Закон разбавления Оствальда.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель. Роль концентрации водородных ионов в биологических процессах.
- •Свойства буферных растворов
- •Кинетика химических реакции. Закон действия масс.
- •Гомогенный и гетерогенный катализ. Ферментативный катализ.
- •Химическое равновесие и закон действующих масс. Константа равновесия и ее физический смысл. Смещение химического равновесия. Принцип Ле Шателье.
- •Строение атома. Планетарная и квантово-механическая модель.
- •Ковалентная полярная и неполярная связи. Квантово-механическое объяснение ковалентной связи.
- •Кратные связи. Механизм образования двойных и тройных связей, σ- и π- связи. Энергия и длина связи.
- •Водородная связь. Биологическое значение водородной связи.
- •Водород. Химические свойства и способы получения.
- •Натрий, калий. Химические свойства. Оксиды, гидроксиды, соли натрия и калия. Роль в жизнедеятельности организмов.
- •Магний, кальций. Химические свойства. Хлорофилл. Значение кальция и магния для живых организмов.
- •Оксид углерода (II) со, или угарный газ.
- •Оксид углерода (IV), или углекислый газ со2.
- •Азот. Химические свойства. Биологическая роль азота.
- •Кислородные соединения фосфора. Фосфорные удобрения.
- •Кислород. Химические свойства. Озон. Биологическая роль кислорода.
- •Сера. Химические свойства. Оксиды серы. Роль серы и ее соединений в жизнедеятельности растений.
- •Фтор и йод как микроэлементы. Химические свойства и важнейшие соединения.
- •Химия бора и алюминия. Оксиды и гидроксиды. Бор и алюминий в биосистемах.
- •Оксид кремния IV - SiO2
- •Кремниевая кислота
- •Вопросы к экзамену по органической и физколлоидной химии
Магний, кальций. Химические свойства. Хлорофилл. Значение кальция и магния для живых организмов.
Магний и кальций — серебристые металлы, существенно более твердые, чем щелочные металлы, но более мягкие и пластичные, чем бериллии. При хранении на воздухе магний покрывается защитной оксидной пленкой. Оксид кальция взаимодействует с водой и не защищает его от взаимодействия с атмосферой. Оба металла получают электролизом расплавов их солей. Вследствие высокой химической активности магния и кальция подавляющее большинство их бинарных соединений можно получить прямым синтезом из простых веществ.
Магний в чистом виде — это серебристо-белый, легкий металл; горит на воздухе ослепительно ярко с выделением ультрафиолетовых лучей:
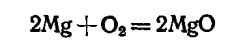
Магний химически активен, кипящую воду разлагает с выделением водорода:
![]()
Легко растворяется в разбавленных кислотах (кроме плавиковой); концентрированную серную кислоту восстанавливает до оксида серы (IV); со щелочами не взаимодействует. Сродство к кислороду столь велико, что магний отнимает кислород у многих оксидов, например у оксида кремния.
Магний имеет большое биологическое значение, он входит в состав хлорофилла, участвует в процессе фотосинтеза, в образовании или распаде углеводов и жиров, в превращениях фосфорных соединений. Недостаток магния в почве как микроэлемента вызывает заболевания растений (хлороз, мраморность листьев и др.). При низких содержаниях его в кормах наблюдаются заболевания и у сельскохозяйственных животных.
ХЛОРОФИЛЛ
Чистый кальций — это белый, твердый и ковкий металл, покрывающийся на воздухе рыхлой пленкой оксида. Он сильный восстановитель. При нагревании воспламеняется:
![]()
Кальций легко вытесняет водород из разбавленных кислот (кроме азотной).
Реагируя с водородом, образует гидрит:
![]()
Недостаток кальция задерживает рост, развитие корневой системы; иногда, листья покрываются коричневыми пятнами или отмирают. Недостаток кальция вызывает у сельскохозяйственных животных рахит, ослабление сердечной деятельности; кровь, обедненная кальцием, плохо свертывается на воздухе. Поэтому соли кальция применяют в ветеринарии: хлорид и карбонат кальция дают животным при рахите и инфекционных заболеваниях, фосфат кальция Са3(Р04)2 вводят в рацион молодняка. Известковой водой Са(ОН)2 лечат кожные заболевания животных.
В биохимии растений особую роль играет комплексное соединение магния — хлорофилл. Хлорофилл является важнейшей частью фотосинтетического аппарата растительной клетки. Координационные связи между донорными атомами азота и катионом магния в хлорофилле не очень прочны. Поэтому Mg может быть замещен другими двухзарядными катионами Сu, Со, а также двумя катионами Н. Однако ни один из этих катионов, внедренных в хлорофилл, не может повторить координационное поведение Mg. Комплексные соединения ФТС цикла с другими катионами не обеспечивают фотосинтетическую активность хлоропласта.
Роль Ca и Mg:
Активация ферментов
катионы магния эффективно стабилизируют двойную спираль ДНК
Увеличение концентрации катионов Са во внутриклеточном растворе инициирует ряд биохимических и физиологических процессов: сокращение мышечных волокон, передача нервного импульса от одного нейрона к другому, свертывание крови, выделение гормонов.
Минеральной основой клеточных стенок растений, панцирей моллюсков, скорлупы яиц служит карбонат кальция СаСОз.
Жесткость воды и методы ее устранения.
Это свойство природной воды, обусловленное присутствием в ней катионов Са и Mg. При использовании жесткой воды в системах горячего водоснабжения образуются осадки нерастворимых солей кальция и магния (накипь). Карбонатная жесткость обусловлена присутствием в воде растворимых гидрокарбонатов С а(Н С О з)2 и M g (H C O з)2. Ее можно устранить кипячением воды. При этом растворимые гидрокарбонаты разлагаются, а кальций и магний выпадают в осадок в виде нерастворимых солей. Некарбонатная жесткость вызвана наличием сульфатов, хлоридов, нитратов и фосфатов кальция и магния.

Углерод как биогенный элемент. Химические свойства. Кислородные соединения углерода.
УГЛЕРОД - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности. Значительная часть необходимой организмам энергии образуется в клетках за счёт окисления углерода.
Химические свойства:
с кислородом
C0 + O2 –t°= CO2 углекислый газ при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
со фтором
С + 2F2 = CF4
с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
с оксидами металлов.
C0 + 2CuO –t°= 2Cu + C+4O2
с кислотами – окислителями: C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
с серой образует сероуглерод:
С + 2S2 = СS2.
Углерод как окислитель:
с некоторыми металлами образует карбиды
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
с водородом — метан (а также огромное количество органических соединений)
C0 + 2H2 = CH4
с кремнием, образует карборунд (при 2000 °C в электропечи):
Si + C = SiC.
