
- •(1) Предмет неорганической химии и ее значение в биологии и охране окружающей среды.
- •(1) Химическая теория образования растворов. (2) Сольваты, гидраты, тепловой эффект растворения. (3) Способы выражения концентрации растворов. (4) Роль растворов в природе.
- •(1) Слабые электролиты. (2) Степень и константа диссоциации. (3) Закон разбавления Оствальда.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель. Роль концентрации водородных ионов в биологических процессах.
- •Свойства буферных растворов
- •Кинетика химических реакции. Закон действия масс.
- •Гомогенный и гетерогенный катализ. Ферментативный катализ.
- •Химическое равновесие и закон действующих масс. Константа равновесия и ее физический смысл. Смещение химического равновесия. Принцип Ле Шателье.
- •Строение атома. Планетарная и квантово-механическая модель.
- •Ковалентная полярная и неполярная связи. Квантово-механическое объяснение ковалентной связи.
- •Кратные связи. Механизм образования двойных и тройных связей, σ- и π- связи. Энергия и длина связи.
- •Водородная связь. Биологическое значение водородной связи.
- •Водород. Химические свойства и способы получения.
- •Натрий, калий. Химические свойства. Оксиды, гидроксиды, соли натрия и калия. Роль в жизнедеятельности организмов.
- •Магний, кальций. Химические свойства. Хлорофилл. Значение кальция и магния для живых организмов.
- •Оксид углерода (II) со, или угарный газ.
- •Оксид углерода (IV), или углекислый газ со2.
- •Азот. Химические свойства. Биологическая роль азота.
- •Кислородные соединения фосфора. Фосфорные удобрения.
- •Кислород. Химические свойства. Озон. Биологическая роль кислорода.
- •Сера. Химические свойства. Оксиды серы. Роль серы и ее соединений в жизнедеятельности растений.
- •Фтор и йод как микроэлементы. Химические свойства и важнейшие соединения.
- •Химия бора и алюминия. Оксиды и гидроксиды. Бор и алюминий в биосистемах.
- •Оксид кремния IV - SiO2
- •Кремниевая кислота
- •Вопросы к экзамену по органической и физколлоидной химии
Натрий, калий. Химические свойства. Оксиды, гидроксиды, соли натрия и калия. Роль в жизнедеятельности организмов.
Калий и натрий — щелочной металл, относится к 1А подгруппе. По распространенности в литосфере натрий занимает шестое место среди других элементов системы Менделеева. Доказано присутствие его в атмосфере Солнца и в космическом пространстве. Наиболее распространен в природе хлорид натрия, содержащийся в морской воде. Подобно натрию, калий широко распространен в природе и не встречается в свободном состоянии из-за высокой активности. Щелочные металлы не восстанавливаются из природных соединений углем, оксидом углерода (II) и водородом. Поэтому для получения их в свободном виде прибегают к электролизу расплавленных солей или гидроксидов. схожи по физическим свойствам: легкие серебристо-белые мягкие металлы, с невысокими температурами плавления и кипения, малой плотностью. Соединения натрия легко вымываются из почв и концентрируются в морях и океанах. А калий в большей степени поглощается почвой, затем растениями.
(2.1) Металлический натрий — серебристо-белый, мягкий металл, который во избежание окисления хранят под слоем керосина. Взаимодействие его с водой проходит бурно и сопровождается выделением теплоты:
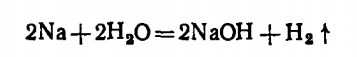 +Q
+Q
Кислород воздуха (при обычной температуре) окисляет по схеме с образование оксида, но при высоких тепм в избытке кислорода образуется пероксид натрия
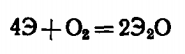
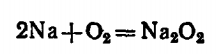
Оксид натрия Na2O получают сплавлением пероксида с металлическим натрием.
![]()
Оксид натрия, присоединяя воду, превращается в гидроксид натрия. Его получают электролизом водного раствора хлорида натрия или взаимодействием карбоната натрия с гидроксидом кальция.
![]()
Химически чистый гидроксид натрия — бесцветное кристаллическое гигроскопическое вещество, на воздухе покрывается налетом карбоната натрия.

(2.2) Металлический калий окисляется и горит на воздухе, непосредственно соединяется с галогенами, серой, фосфором, некоторыми другими элементами.
С водородом при 350 °С он образует гидрид КН.
Калий вытесняет водород из воды легче, чем натрий:
![]()
Супероксид калия К204 образуется при сгорании калия в избытке кислорода. Как и пероксид натрия, это сильный окислитель. Оксид калия КаО2 получают косвенным путем. Оба соединения, взаимодействуя с водой, дают гидроксид калия:
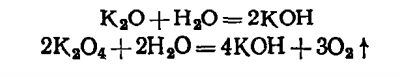
Гидроксид калия КОН в технике получают электролизом водного раствора хлорида калия; это твердое кристаллическое вещество, похожее на гидроксид натрия, оно разрушает животные и растительные ткани. Почти все соли калия хорошо растворимы в воде, но в отличие от солей натрия не содержат кристаллизационной воды. Вместе с азотом и фосфором калий — один из основных элементов питания растений; при отсутствии его они погибают.
ия.
Хлорид калия КСL — наиболее концентрированное калийное удобрение. Добывают его из природных руд. Нитрат калия (калийная селитра) KNO3 содержит два элемента питания растений — калий и азот. Такие удобрения называют сложными.
Метафосфат калия КРОз также представляет собой сложное удобрение, содержащее два элемента питания растений — калий и фосфор.
Сульфат калия K2S04 получают из природных калийных солей и применяют как удобрение.
Карбонат калия (или поташ) К2СО3 раньше выделяли из золы растений (например, подсолнечника); сейчас в промышленности его получают, пропуская оксид углерода (IV) через раствор гидроксида калия.
(3) Роль в жд организмов:
Являются активными центрами ферментов
Составляют калий-натриевый насос, образуя клеточный потенциал
Натрий участвует в регуляции кислотно-основного состояния
Участвуют в возникновении нервного импульса
Калий участвует в синтезе гликогена и белка
Калий-основа питания растений, без него они погибают
