
к экзамену последний семестр / ответики
.pdf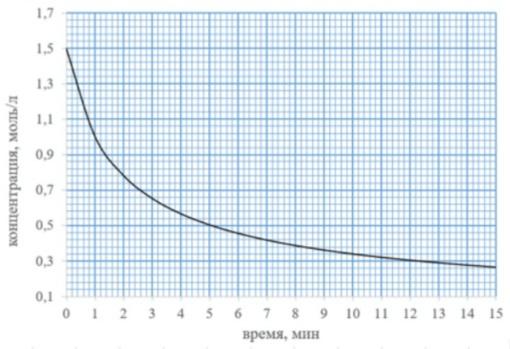
Уксусная кислота при температуре 700С разлагается одновременно по двум направлениям: Период полураспада кислоты не зависит от начальной концентрации и равен 0,087с. Отношение
числа молей обр метана и кетена в любой момент времени равно 0,8. Рассчитайте значение константы скорости первой стадии.
Ответ: К1=3,5; К2=4,5
Выберите выражение для полной активности сильного электролита Na2SO4 как компонента водного раствора с моляльностью m.
Ответ: 4m^3*y^3
Константа скорости некоторой реакции при 9,4С равно 2,37 л*моль-1*мин-1, а при 14,4С равно с*моль-1*мин-1. Найдите Еа реакции.
Ответ: 41 кДж/моль
Пользуясь справочными данными, рассчитайте средний ионный коэффициент активности в децимоляльном водном растворе CdCl2, если ЭДС нижеприведенного гальванического элемента при 298К составляет 0,77В.
Ответ: 0,146
На графике представлена кинетическая кривая реакции, порядок которой равен 2,5. Определите константу скорости этой реакции (концентрации исходных веществ считать одинаковыми).
Ответ: 0,3
Выразите в общем виде константу диссоциации слабой кислоты Н2А через степень диссоциации а и молярную концентрацию электролита с.
Ответ: Кд= (4а^3c^2)/(1-а)

Может ли квантовый выход фотохимической реакции быть >1? И, если да, то при каких условиях протекания реакции?
Ответ: Может, если в первичном ф/х процессе возникают частицы со свободной валентностью (атомы или радикалы).
При 293К измена удельная электрическая проводимость водных растворов сильного бинарного электролита при следующих концентрациях:
Определите молярную электрическую проводимость электролита при бесконечном разведении.
Ответ: 126,2*10^(-4)
Укажите правильную схему записи электрохимической цепи без переноса с учетом правила знаков ЭДС и электронных потенциалов.
Вычислите ЭДС элемента при 25С, используя справочные данные:
Ответ: 0,0146В
Какой электрод можно использовать в качестве электрода сравнения при измерении ЭДС электрохимической цепи?
Сравнивания ряд реакций с различными величинами энергии активации Еа и температурного коэффициента Вант-Гоффа y. Для каких реакций скорость изменяется более резко с повышением температуры?
Ответ: для реакций, у которых Еа меньше
Радиус ионной атмосферы зависит от ионной силы раствора, температуры, диэлектричекой проницаемости среды, и не зависит от степени диссоциации.
В обратимой реакции скорости прямой и обратной реакции соответственно равны 4,5мин-1 и 1,5мин-1. В момент начала реакции система содержит только вещество А. За какое время его конц уменьшится в 2 раза.
Ответ: 0,183 мин
Для некоторой реакции первого порядка период полупревращения при 25С равен 104ч, а при 35С равен 39ч. Определите температурный коэффициент Вант-Гоффа.
Ответ: 2,7
Пользуясь справочными данными, определить для раствора FeCl2 с концентрацией 1,0 моль/кг Н2О среднеионную активность при 298 К.
Ответ: 0,810
При 504С ацетон разлагается в газовой фазе по реакции
CH3COCH3=C2H4 +CO+H2
Константа скорости этой реакции равна 4,27*10^(-4)с-1. Рассчитайте, чему будет равно парциальное давление ацетона через 1200с от начала опыта, если начальное давление было равно 1 атм.
Ответ: 0,6 атм
При 504С ацетон разлагается в газовой фазе по реакции
CH3COCH3=C2H4 +CO+H2
Константа скорости этой реакции равна 4,27*10^(-4)с-1. Рассчитайте, чему будет равно общее давление газовой смеси через 20 минут от начала опыта, если начальное давление было равно 1 атм.
Ответ: 1,8 ат
Какова должна быть площадь электродов, расположенных на расстоянии 1см друг от друга, чтобы электрическая проводимость раствора электролита с концентрацией 0,2 моль/л, помещенного в измерительную электрохимическую ячейку, отвечала молярной электрической проводимости этого электролита.
Ответ: 5*10^(-3) м^2
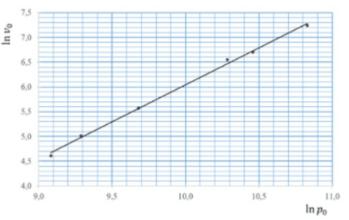
При изучении зависимости начальной скорости распада ацетальдегида от начального давления были получены данные, представленные в виде графика. Найдите порядок реакции.
Ответ: 1,5
Температурный коэффициент Вант-Гоффа некоторой реакции равен 3. При 20С реакция заканчивается за два часа. При какой температуре она закончится за 25 минут?
Ответ: 34С
Определите средний ионный коэффициент активности сульфата меди (m=0,0005моль/кг), если в растворе также присутствует нитрат калия (m=0,0025моль/кг). Температура составляет 298К.
Ответ: 0,73
Удельная электропроводность водного раствора некоторой одноосновной кислоты с разведением 1024 л/моль составляет 4,23 мСм/м. Определите константу диссоциации данной кислоты, если ее
электропроводность при бесконечном разведении составляет 385,6 См*см2/моль.
Ответ: 1,4*10^(-5) моль/л
Пользуясь справочными данными рассчитайте во сколько раз изменится средняя ионная активность Pb(NO3)2 в водном растворе при 25 С, если концентрация раствора изменится от m1=0.001 до m2=0.01
Ответ: увеличится в 7,84 раз
Укажите, какая характеристика является ошибочной для концентрационных цепей:
Ответ: Очень большие значения ЭДС
Какой из приведённых законов не является законом фотохимии?
Ответ: Брендстеда-Бьеррума
Температурный коэффициент Вант-Гоффа некоторой реакции равен 3. При 20 С реакция заканчивается за два часа. При какой температуре она закончится за 25 минут?
Ответ: 34 С
Разложение пербората натрия
NaBO3 + H2O = NaH2BO3 + ½ O2
реакция первого порядка. Константы скорости реакции при 303 и 308 К соответственно равны 2.2*10^(-3) и 4.1*10^(-3) мин^(-1). Вычислите время, в течение которого при 313 К разложится 99% пербората натрия.
Ответ: 615 мин.
Сравнивается ряд реакций с различными величинами энергии активации Еа и температурного коэффициента Вант-Гоффа Y. Для каких реакций скорость изменяется более резко с повышением температуры? Сильнее изменяется скорость тех реакций, для которых:
Ответ: Еа больше
Растворимость BaSO4 в воде при некоторой температуре составляет 1.31*10^(-5) моль/л. Определите растворимость этой соли в растворе Na2SO4 с моляльной концентрацией 0,002 моль/1000г Н2О.
Ответ: 1,78*10^(-7) моль/кг
Какая из характеристик является ошибочной для элемента Вестона:
Ответ: Элемент с переносом
Обратимая реакция первого порядка
А в В (к1,к2)
характеризуется следующими данными: исходная концентрация вещества А равна 0,05 моль/л, а при достижении равновесия - 0,01 моль/л. Вещество В в исходной реакционной смеси отсутствует. Определите отношение констант скорости k1 и k2.
Ответ: 4,0
Какой из представленных электродов может использоваться в качестве электрода сравнения при измерении ЭДС электрохимической цепи?
Ответ: 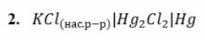
Имеются разбавленные водные растворы KNO3, KCl, CaCl2 при 298 К. Концентрация 1-го раствора в 2 раза выше концентрации 2-го и в 3 раза выше концентрации 3-го растворов. Средний ионный коэффициент активности какого электролита больше?
Ответ: KCl
Укажите, какой из приведённых электродов может служить индикаторным при измерении pH раствора.
Ответ: Хингидронный
Каким из приведенных уравнений нельзя описать поведение слабого электролита:
Ответ: 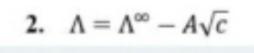
При изучении кинетики некоторой реакции были получены следующие данные об изменении концентрации исходного вещества в ходе процесса:

Определите порядок реакции.
Ответ: 2,0
Энергии активации двух реакций примерно одинаковы, а предэкспоненциальный множитель второй реакции больше, чем предэкспоненциальный множитель первой реакции. Сравните величины констант скоростей этих реакций при некоторой температуре Т.
Ответ: k2>k1
Каким из приведенных уравнений нельзя описать поведение сильного электролита:
Ответ:
Какое из приведенных ниже выражений отвечает кинетическому уравнению необратимой реакции третьего порядка (концентрации исходных веществ одинаковы и равны c, t - время)
Ответ: 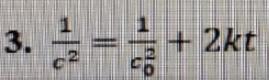
Какое из приведенных ниже выражений отвечает кинетическому уравнению необратимой реакции второго порядка (концентрации исходных веществ одинаковы и равны c, t - время)
Ответ: 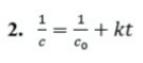
Какое из приведенных ниже выражений отвечает кинетическому уравнению необратимой реакции первого порядка (концентрации исходных веществ одинаковы и равны c, t - время)
Ответ: 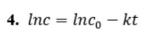
Вычислить константу прямой стадии обратимой гомогенной реакции первого порядка А в В, протекающей в газовой фазе. Концентрация вещества А в момент начала реакции составляла 18,5 моль/м^3, а через 12 минут - 15,9 моль/м^3, равновесные концентрации веществ А и В составили
14,14 и 7,07 моль/м^3.
Ответ: 0.0252 мин^(-1)
Рассчитайте ЭДС гальванического элемента при 298 К

где m1=0,01, а m2=0,1, а p(Н2)=1 атм.
Ответ: 0,267 В
Укажите правильную схему записи электрохимической цепи с переносом с учетом правила знаков ЭДС и электродных потенциалов.
Определите средний ионный коэффициент активности сульфата меди (m=0,0005 моль/кг), если в растворе также присутствует нитрат калия (m=0,0025 моль/кг). Температура составляет 298 К.
Ответ: 0,730
Определить растворимость Ag2CrО4 в водном растворе нитрата натрия с моляльностью 0,01 моль/кг при температуре 298 К. Произведение растворимости хромата серебра составляет 4,7*10^(-12).
Ответ: 1,34*10^(-4) моль/кг
Зависимость удельной электрической проводимости водных растворов электролитов от концентрации проходит через максимум. Какой характер носит зависимость удельной электрической проводимости от разведения, k=f(V)?
Ответ: Проходит через максимум
В растворе содержатся 0,1 моль этилацетата и 0,1 моль едкого натра. При 10 С в течение 15 минут реагирует 10% эфира, а при 25 С за то же время 20%. Вычислите энергию активации реакции.
Ответ: 38 кДж/моль
Удельная электропроводность водного раствора некоторой одноосновной кислоты с разведением 1024 л/моль составляет 4,23 мСм/м. Определите константу диссоциации данной кислоты, если её электропроводность при бесконечном разведении составляет 385,6 (См*см^2)/(моль).
Ответ: 1,4*10^(-5) моль/л
Вычислите ЭДС элемента:
при 25 С, используя справочные данные.
Ответ: 0,0146 В

Какое из приведенных ниже названий отражает суть одного из основных механизмов обрыва цепи в разветвленных цепных реакциях:
Ответ: Квадратичный
Разложение оксида азота (II) при 1300 К протекает по двум параллельным реакциям:
Начальная концентрация оксида азота (II) равна 4 моль/л. Через 0,02 с она уменьшается на 77,85%. Отношение концентраций N2 и N2О в любой момент времени равно 1,4. Найдите значения константы скорости первой стадии, считая, что кинетика разложения оксида азота (II) подчиняется второму порядку.
Ответ: 18,3 л*моль^(-1)*с^(-1)
Под каким давлением поступает водород в левый электрод, если ЭДС гальванического элемента при 25 С составляет 0,0118 В
где m=0,4 моль/кг, а p2(Н2)=1,5 атм.
Ответ: 3,77 атм
Укажите правильную схему записи электрохимической цепи без переноса с учетом правила знаков ЭДС и электродных потенциалов.
Как изменится скорость фотохимической реакции при увеличении интенсивности падающего света в 4 раза?
Ответ: Возрастет в 4 раза
Как связаны между собой удельная (См*м^(-1)) и молярная (См*м^2/моль) электрические проводимости раствора электролита и концентрация (моль/л) раствора электролита?

В обратимой реакции:
А=(к1,к2)=В
константы скорости прямой и обратной реакции соответственно равны 4,5 мин^(-1) и 1,5 мин^(-1). В момент начала реакции система содержит только вещество А. За какое время его концентрация уменьшится в два раза?
Ответ: 0,183 мин
Укажите уравнение Аррениуса в интегральной форме:
Ответ: 
Для некоторой реакции первого порядка период полупревращения при 25 С равен 104 ч, а при 35 С равен 39 ч. Определите температурный коэффициент Вант-Гоффа этой реакции.
Ответ: 2,7
Какой из представленных гальванических элементов может быть использован для определения среднеионного коэффициента активности CuSO4?
В соответствии с первым приближением теории Дебая-Хюккеля зависимость среднего ионного коэффициента активности электролита АВ от ионной силы раствора может быть представлена уравнением:
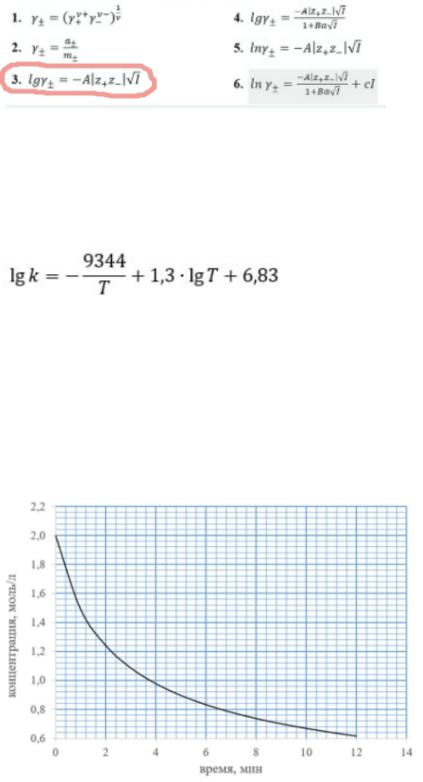
Произведение растворимости BaSO4 при 298 К составляет 1,0*10^(-10). Определите растворимость этой соли в растворе KNO3 с моляльной концентрацией 0,002 моль/1000 г Н2О.
Ответ: 7,52*10^(-5) моль/кг
Температурная зависимость константы скорости (с^(-1)) некоторой реакции выражается уравнением:
Найдите энергию активации этой реакции при 500 К.
Ответ: 184 кДж/моль
На графике представлена кинетическая кривая реакции третьего порядка. Определите константу скорости этой реакции (концентрации исходных веществ считать одинаковыми).
Ответ: 0,1 л^2*моль^(-2)*мин^(-1)
Период полупревращения t ½ исходного вещества в односторонней реакции третьего порядка выражается формулой (с0 - начальная концентрация, к - константа скорости реакции):
